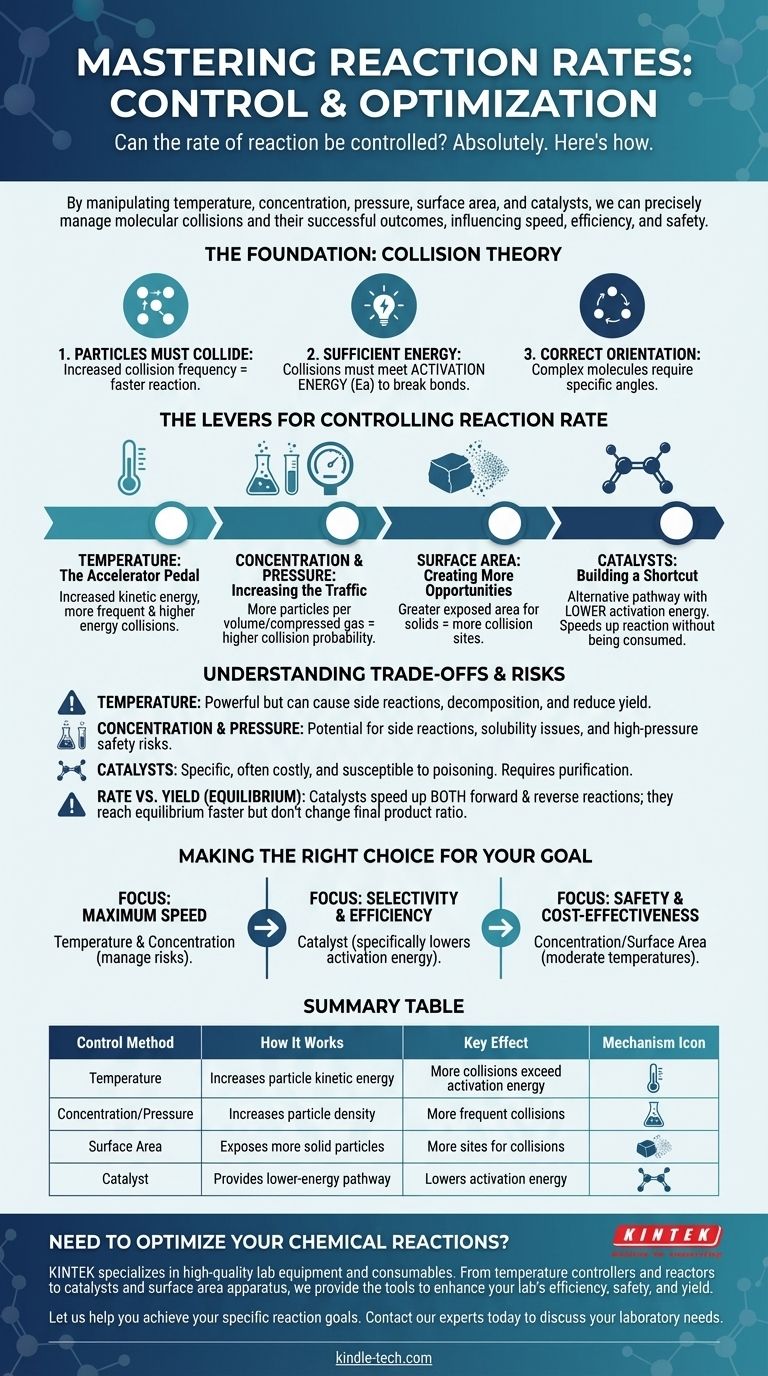
Absolut. Die Geschwindigkeit einer chemischen Reaktion ist keine feste Eigenschaft; sie kann präzise gesteuert werden. Durch die Manipulation spezifischer physikalischer und chemischer Faktoren können wir eine Reaktion bewusst beschleunigen, verlangsamen oder sogar anhalten. Die primären Hebel für diese Steuerung sind Temperatur, Konzentration der Reaktanten, Druck (für Gase), Oberfläche (für Feststoffe) und die Zugabe von Katalysatoren.
Die Steuerung der Reaktionsgeschwindigkeit besteht im Wesentlichen darin, die Häufigkeit und Energie molekularer Kollisionen zu managen. Jede Methode, vom Erhitzen einer Substanz bis zur Zugabe eines Katalysators, beeinflusst, wie oft Partikel kollidieren und ob diese Kollisionen erfolgreich sind.

Die Grundlage: Kollisionstheorie
Um eine Reaktion zu steuern, müssen Sie zunächst verstehen, was sie auslöst. Die Geschwindigkeit jeder Reaktion wird durch die Prinzipien der Kollisionstheorie bestimmt, die besagt, dass drei Bedingungen erfüllt sein müssen, damit eine Reaktion stattfindet.
1. Partikel müssen kollidieren
Damit zwei oder mehr Moleküle reagieren, müssen sie zuerst physisch in Kontakt treten. Je häufiger Partikel kollidieren, desto mehr Möglichkeiten haben sie zu reagieren, was die Reaktionsgeschwindigkeit erhöht.
2. Kollisionen müssen ausreichend Energie haben
Einfaches Kollidieren reicht nicht aus. Die kollidierenden Partikel müssen eine minimale Menge an kombinierter kinetischer Energie besitzen, bekannt als Aktivierungsenergie (Ea). Diese Energie ist erforderlich, um bestehende chemische Bindungen zu brechen, damit neue entstehen können.
Kollisionen mit weniger als der Aktivierungsenergie sind erfolglos; die Partikel prallen einfach unverändert voneinander ab.
3. Partikel müssen die richtige Ausrichtung haben
Bei komplexen Molekülen muss die Kollision auch in einem bestimmten Winkel oder einer bestimmten Ausrichtung erfolgen. Wenn die reaktiven Teile der Moleküle während der Kollision nicht richtig ausgerichtet sind, findet keine Reaktion statt, selbst wenn die Energieanforderung erfüllt ist.
Die Hebel zur Steuerung der Reaktionsgeschwindigkeit
Das Verständnis der Kollisionstheorie gibt uns einen klaren Fahrplan zur Manipulation der Reaktionsgeschwindigkeit. Jede Steuerungsmethode wirkt, indem sie eine oder mehrere der Bedingungen ändert, die für eine erfolgreiche Kollision erforderlich sind.
Temperatur: Das Gaspedal
Eine Erhöhung der Temperatur erhöht die durchschnittliche kinetische Energie der Partikel. Dies hat einen starken, zweifachen Effekt.
Erstens führt es dazu, dass sich Partikel schneller bewegen, was zu häufigeren Kollisionen führt. Zweitens, und wichtiger, bedeutet es, dass ein viel größerer Anteil dieser Kollisionen Energie gleich oder größer als die Aktivierungsenergie haben wird, was die Rate erfolgreicher Reaktionen dramatisch erhöht.
Konzentration und Druck: Erhöhung des Verkehrs
Eine Erhöhung der Konzentration der Reaktanten in einer Lösung bedeutet, dass mehr Partikel im selben Volumen verpackt sind. Dies erhöht direkt die Wahrscheinlichkeit einer Kollision und damit die Reaktionsgeschwindigkeit.
Für Gase hat eine Erhöhung des Drucks den gleichen Effekt. Sie zwingt Gasmoleküle näher zusammen, erhöht effektiv ihre Konzentration und führt zu häufigeren Kollisionen.
Oberfläche: Mehr Möglichkeiten schaffen
Dieser Faktor ist entscheidend, wenn ein Feststoff mit einer Flüssigkeit oder einem Gas reagiert. Durch das Zerkleinern eines Feststoffs in kleinere Stücke (z. B. von einem festen Klumpen zu einem Pulver) erhöhen Sie dessen Gesamtoberfläche dramatisch.
Dies setzt mehr Partikel des Feststoffs dem anderen Reaktanten aus, wodurch weitaus mehr Stellen entstehen, an denen Kollisionen stattfinden können, und die gesamte Reaktionsgeschwindigkeit erhöht wird.
Katalysatoren: Eine Abkürzung bauen
Ein Katalysator ist eine Substanz, die die Reaktionsgeschwindigkeit erhöht, ohne dabei verbraucht zu werden. Er wirkt, indem er einen alternativen Reaktionsweg mit einer niedrigeren Aktivierungsenergie bereitstellt.
Ein Katalysator lässt Partikel nicht häufiger oder mit mehr Energie kollidieren. Stattdessen senkt er die Energie-"Barriere", die eine Kollision überwinden muss, um erfolgreich zu sein, wodurch eine Reaktion viel leichter ablaufen kann.
Verständnis der Kompromisse und Risiken
Obwohl diese Hebel wirksam sind, sind sie nicht ohne Folgen. Die Wahl der richtigen Methode erfordert das Verständnis ihrer Einschränkungen und potenziellen Nachteile.
Die brachiale Gewalt der Temperatur
Hitze ist ein mächtiges, aber undifferenziertes Werkzeug. Während sie Ihre gewünschte Reaktion beschleunigt, beschleunigt sie auch alle potenziellen Nebenreaktionen. Bei sehr hohen Temperaturen kann sie sogar dazu führen, dass Reaktanten oder Produkte zerfallen, was Ihre Gesamtausbeute mindert.
Die Gefahren von Konzentration und Druck
Hohe Konzentrationen können manchmal zu unerwünschten Nebenreaktionen oder Löslichkeitsproblemen führen. Kritischer ist, dass der Betrieb bei sehr hohen Drücken spezielle, teure und robuste Ausrüstung erfordert, um die erheblichen Sicherheitsrisiken eines potenziellen Containment-Versagens zu bewältigen.
Die Spezifität und Kosten von Katalysatoren
Katalysatoren sind oft hochspezifisch und können sehr teuer sein (z. B. solche, die Platin oder Palladium verwenden). Sie können auch durch Verunreinigungen unbrauchbar gemacht werden, ein Prozess, der als Katalysatorvergiftung bekannt ist und eine sorgfältige Reinigung der Reaktanten erfordert.
Geschwindigkeit vs. Ausbeute (Gleichgewicht)
Es ist entscheidend, zwischen Reaktionsgeschwindigkeit und Reaktionsausbeute zu unterscheiden. Bei reversiblen Reaktionen, die sowohl in Vorwärts- als auch in Rückwärtsrichtung ablaufen können, beschleunigt ein Katalysator beide Reaktionen gleichermaßen. Das bedeutet, dass Sie das Gleichgewicht schneller erreichen, aber das endgültige Verhältnis von Produkten zu Reaktanten wird sich nicht ändern.
Die richtige Wahl für Ihr Ziel treffen
Die optimale Strategie zur Steuerung einer Reaktion hängt vollständig von Ihrem spezifischen Ziel ab, sei es Geschwindigkeit, Effizienz oder Sicherheit.
- Wenn Ihr Hauptaugenmerk auf maximaler Geschwindigkeit liegt: Die Erhöhung von Temperatur und Konzentration sind Ihre direktesten Werkzeuge, aber Sie müssen die Risiken von Nebenreaktionen und Sicherheitsgefahren aktiv managen.
- Wenn Ihr Hauptaugenmerk auf Selektivität und Effizienz liegt: Ein Katalysator ist oft die beste Wahl, da er die Aktivierungsenergie für Ihre gewünschte Reaktion spezifisch senken kann, ohne andere zu fördern.
- Wenn Ihr Hauptaugenmerk auf Sicherheit und Kosteneffizienz liegt: Die Manipulation von Konzentration oder Oberfläche bei moderaten Temperaturen sind oft die zugänglichsten und risikoärmsten Methoden.
Die Beherrschung dieser Faktoren ermöglicht es Ihnen, chemische Reaktionen von festen Ereignissen in dynamische Prozesse zu verwandeln, die präzise gesteuert werden können, um ein bestimmtes Ergebnis zu erzielen.
Zusammenfassungstabelle:
| Kontrollmethode | Wie es funktioniert | Schlüsseleffekt |
|---|---|---|
| Temperatur | Erhöht die kinetische Energie der Partikel | Mehr Kollisionen überschreiten die Aktivierungsenergie |
| Konzentration/Druck | Erhöht die Partikeldichte | Häufigere Kollisionen |
| Oberfläche | Setzt mehr feste Reaktantpartikel frei | Mehr Kollisionsstellen |
| Katalysator | Bietet einen energieärmeren Reaktionsweg | Senkt die Aktivierungsenergie |
Müssen Sie Ihre chemischen Reaktionen optimieren?
Die präzise Steuerung der Reaktionsgeschwindigkeiten ist der Schlüssel zu erfolgreicher Laborarbeit. Ob Sie eine Synthese beschleunigen, die Selektivität verbessern oder einen sicheren Betrieb gewährleisten müssen, die richtige Ausrüstung ist unerlässlich.
KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborausrüstung und Verbrauchsmaterialien, um Ihnen zu helfen, diese Variablen zu meistern. Von Präzisions-Temperaturreglern und Reaktoren zur Steuerung von Wärme und Druck bis hin zu einer breiten Palette von Katalysatoren und Geräten, die für eine optimale Oberflächeninteraktion entwickelt wurden, haben wir die Werkzeuge, um die Effizienz, Sicherheit und Ausbeute Ihres Labors zu verbessern.
Lassen Sie uns Ihnen helfen, Ihre spezifischen Reaktionsziele zu erreichen. Kontaktieren Sie noch heute unsere Experten, um Ihre Laborbedürfnisse zu besprechen und die perfekte Lösung zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Anpassbare Hochdruckreaktoren für fortschrittliche wissenschaftliche und industrielle Anwendungen
- Anpassbare Labor-Hochtemperatur-Hochdruckreaktoren für vielfältige wissenschaftliche Anwendungen
- Mini-Hochdruck-Autoklavreaktor aus Edelstahl für Laboranwendungen
- Hochdruck-Laborautoklav-Reaktor für Hydrothermalsynthese
- Warm Isostatisches Pressen WIP Arbeitsplatz 300 MPa für Hochdruckanwendungen
Andere fragen auch
- Was ist die Bedeutung der Verwendung eines Hochdruckreaktors für die Behandlung von Reishülsen? Steigerung der Furfuralausbeute & Geschwindigkeit
- Was sind die Vorteile der Verwendung von Hochdruckreaktoren für die hydrothermale Karbonisierung? Effiziente Verarbeitung von nassem Biomasse
- Warum sind Reaktoren in der Chemieingenieurwissenschaft so wichtig? Das Herzstück der chemischen Produktion
- Wie verbessert ein Edelstahlreaktor die Photodegradation von Methotrexat? Beschleunigen Sie die Reaktionsgeschwindigkeit mit Optik
- Was sind die Vorteile der Verwendung von Zweiphasenreaktoren für die Furfuralforschung? Maximierung des Ertrags
- Was ist die Bedeutung einer hochpräzisen PID-Temperaturregelung bei der Synthese von Oligosacchariden aus Lignocellulose?
- Was ist der Zweck des Overlays in einem Bioreaktor? Präzise Gas- und pH-Kontrolle meistern
- Wie wirken sich temperaturkontrollierte Reaktionssysteme auf die Pechblende-Kristallisation aus? Maximierung der Uranentfernungseffizienz



















