Im Kern ist das Design eines Bioreaktors eine Übung in angewandter Biologie. Sie müssen zunächst die Bedürfnisse der Zellen oder Mikroorganismen, die Sie kultivieren möchten, genau verstehen. Erst dann können Sie ein physikalisches Gefäß und ein Kontrollsystem entwickeln, das die perfekte Umgebung schafft, damit sie gedeihen und Ihr gewünschtes Produkt erzeugen können.
Der häufigste Fehler beim Bioreaktor-Design ist, sich zuerst auf die Hardware zu konzentrieren. Das optimale Design leitet sich immer von der Biologie ab – die Anpassung der physikalischen Eigenschaften und Steuerungsfähigkeiten des Gefäßes an die präzisen metabolischen und scherempfindlichen Anforderungen Ihrer spezifischen Zelllinie.

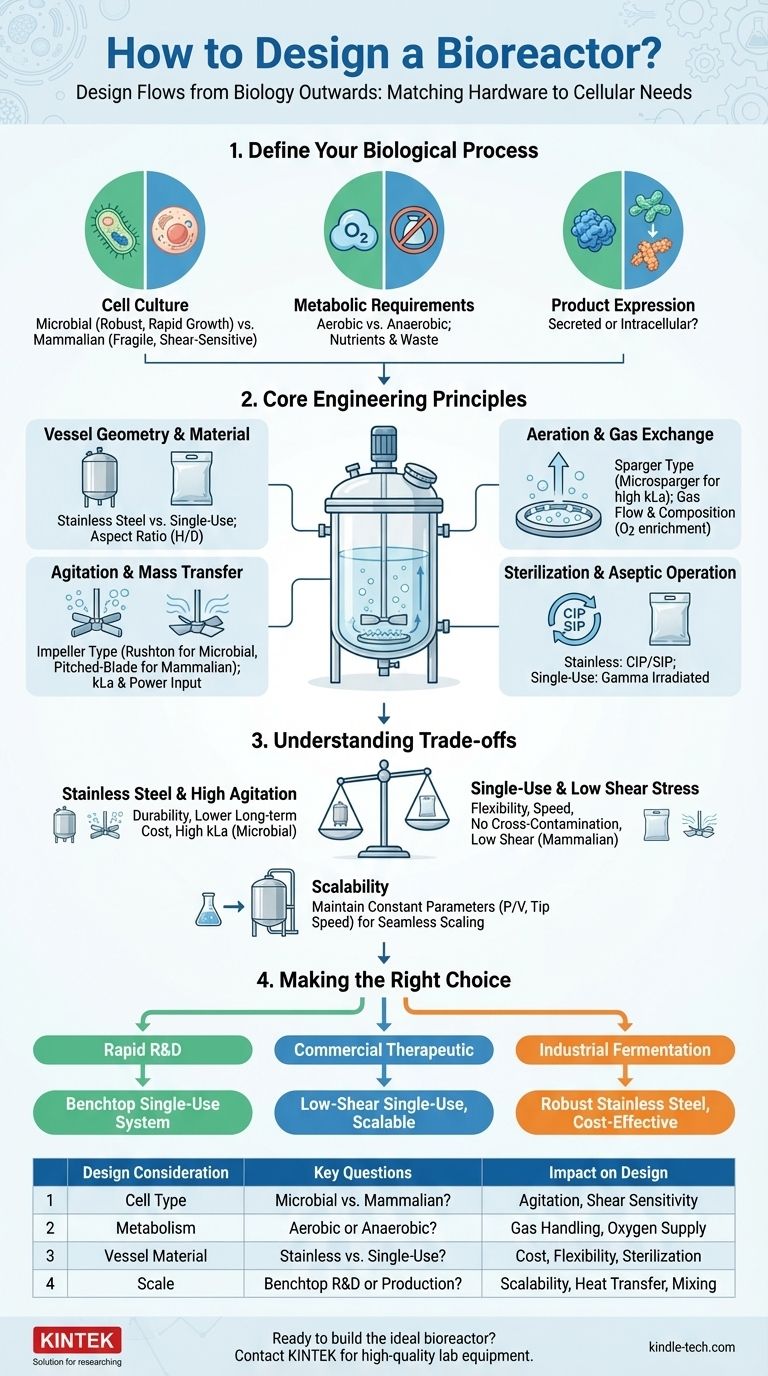
Die Grundlage: Definieren Sie Ihren biologischen Prozess
Bevor eine einzige Schraube gedreht wird, wird das gesamte Design vom lebenden Organismus im Mittelpunkt des Prozesses bestimmt. Ihre Hauptaufgabe ist es, seine Bedürfnisse zu definieren.
Charakterisieren Sie die Zellkultur
Der Zelltyp ist der wichtigste Faktor. Handelt es sich um eine robuste mikrobielle Kultur wie Bakterien oder Hefe oder um eine empfindliche und sensible Säugetierzelllinie?
Mikrobielle Zellen (z. B. E. coli, S. cerevisiae) können oft hoher Agitation standhalten und haben schnelle Wachstumsraten, was einen hohen Sauerstofftransfer und eine effiziente Wärmeabfuhr erfordert.
Säugetierzellen (z. B. CHO-Zellen) sind viel größer, haben keine Zellwand und sind sehr empfindlich gegenüber Scherkräften. Sie erfordern sanftes Mischen und eine präziser kontrollierte Umgebung.
Metabolische Anforderungen verstehen
Sie müssen quantifizieren, was Ihre Zellen verbrauchen und was sie produzieren. Wichtige Fragen sind:
- Aerob oder Anaerob? Dies bestimmt die gesamte Gasführung. Aerobe Prozesse benötigen eine effiziente Sauerstoffzufuhr, während anaerobe Prozesse diese ausschließen müssen.
- Was sind die wichtigsten Nährstoffe? Dies bestimmt die Formulierung des Kulturmediums und die Fütterungsstrategie (Batch, Fed-Batch oder Perfusion).
- Welche Abfallprodukte sammeln sich an? Nebenprodukte wie Laktat oder Ammoniak können toxisch werden und das Wachstum hemmen, was eine sorgfältige Überwachung und Kontrolle erfordert.
Produktexpression klären
Wo befindet sich Ihr Zielprodukt? Wird es in das Kulturmedium ausgeschieden, was die Ernte erleichtert?
Oder handelt es sich um ein intrazelluläres Produkt, was bedeutet, dass die Zellen geerntet und lysiert (aufgebrochen) werden müssen, um es zu gewinnen? Diese Entscheidung beeinflusst grundlegend die nachgeschalteten Verarbeitungsschritte.
Grundlegende technische Prinzipien
Sobald die biologischen Anforderungen definiert sind, können Sie diese in technische Spezifikationen für das Reaktorsystem übersetzen.
Gefäßgeometrie und Material
Das Gefäß selbst ist der primäre Behälter. Die beiden dominierenden Materialoptionen sind Edelstahl und Einwegkunststoff.
Das Aspektverhältnis (Höhe zu Durchmesser) des Gefäßes beeinflusst die Mischeffizienz und Schaumbildung. Ein höheres, dünneres Gefäß kann den Gastransfer verbessern, aber Mischzonen erzeugen, während ein kürzeres, breiteres Gefäß eine gleichmäßigere Mischung bietet.
Agitation und Massentransfer
Ziel der Agitation ist es, eine homogene Umgebung zu schaffen, die sicherstellt, dass die Zellen gleichmäßigen Zugang zu Nährstoffen und Sauerstoff haben und thermische Gradienten verhindert werden.
Der Rührer (der "Propeller") ist entscheidend. Eine Rushton-Turbine eignet sich hervorragend für die Gasdispersion und den hohen Massentransfer in robusten mikrobiellen Kulturen. Ein Schrägblatt- oder Schiffsrührer sorgt für eine sanftere axiale Strömung, die für scherempfindliche Säugetierzellen entscheidend ist.
Die Effektivität der Sauerstoffzufuhr wird durch den Massentransferkoeffizienten (kLa) gemessen. Ihr Design muss einen kLa erreichen, der dem Sauerstoffaufnahmerate (OUR) der Zellen entspricht.
Belüftung und Gasaustausch
Dieses System liefert Sauerstoff und entfernt überschüssiges CO2. Ein Sparger, typischerweise ein Ring oder eine poröse Fritte am Boden des Gefäßes, gibt Gasblasen in das Medium ab.
Die Größe der Blasen ist wichtig. Mikrosparger erzeugen sehr feine Blasen mit großer Oberfläche für einen besseren Sauerstofftransfer, können aber auch mehr Schaum erzeugen. Die Gasflussrate und -zusammensetzung (z. B. Anreicherung mit reinem O2) sind kritische Kontrollparameter.
Sterilisation und aseptischer Betrieb
Das System muss steril sein, um Kontaminationen zu verhindern. Edelstahlreaktoren verwenden Clean-in-Place (CIP) und Steam-in-Place (SIP) Verfahren.
Einweg-Bioreaktoren (SUBs) werden durch Gammabestrahlung vorsterilisiert, wodurch diese komplexen Versorgungsschritte entfallen und die Sterilität von vornherein gewährleistet ist. Das gesamte Design muss eine aseptische Barriere aufrechterhalten.
Die Kompromisse verstehen
Jede Designentscheidung beinhaltet einen Kompromiss. Das Verständnis dieser Kompromisse ist das Markenzeichen eines erfahrenen Ingenieurs.
Edelstahl vs. Einwegsysteme
Edelstahl bietet maximale Haltbarkeit und Anpassbarkeit. Er stellt eine hohe Kapitalinvestition dar, kann aber langfristig niedrigere Kosten pro Charge für die großtechnische, dedizierte Produktion haben. Er erfordert jedoch eine erhebliche Infrastruktur für Reinigung und Sterilisation, was zu längeren Durchlaufzeiten führt.
Einweg-Bioreaktoren (SUBs) bieten unübertroffene Flexibilität und Geschwindigkeit. Sie eliminieren die Reinigungsvalidierung und reduzieren das Risiko einer Kreuzkontamination drastisch. Dies macht sie ideal für Multi-Produkt-Anlagen und die klinische Fertigung, trotz höherer Kosten pro Charge aufgrund der Einwegkomponenten.
Hohe Agitation vs. geringe Scherkraft
Bei der industriellen Fermentation besteht das Ziel oft darin, die Agitation zu maximieren, um den höchstmöglichen kLa für eine dichte mikrobielle Kultur zu erreichen. Die Hardware ist für aggressives Mischen ausgelegt.
Für die therapeutische Proteinproduktion in Säugetierzellen ist dieser Ansatz destruktiv. Das Design muss Scherkräfte minimieren. Dies bedeutet die Verwendung von Rührern mit geringer Scherkraft, die Optimierung ihrer Position und die präzise Steuerung der Rotationsgeschwindigkeit (RPM), oft ergänzt durch Sauerstoffkontrolle über den Gasfluss anstatt durch Agitation.
Skalierbarkeit: Vom Labormaßstab zur Produktion
Ein Design, das bei 2 Litern funktioniert, funktioniert nicht automatisch bei 2.000 Litern. Mit zunehmendem Volumen nimmt das Verhältnis von Oberfläche zu Volumen ab, was die Wärmeabfuhr erheblich erschwert.
Um die Skalierbarkeit eines Prozesses zu gewährleisten, versuchen Designer oft, bestimmte Parameter konstant zu halten, wie z. B. die Leistung pro Volumeneinheit (P/V) oder die Rührerspitzengeschwindigkeit. Diese Modellierung muss während der anfänglichen Designphase berücksichtigt werden, um Prozessfehler bei größerem Maßstab zu vermeiden.
Die richtige Wahl für Ihr Ziel treffen
Ihr endgültiges Design ist ein direktes Spiegelbild Ihres primären Ziels.
- Wenn Ihr Hauptaugenmerk auf schneller Forschung und Prozessentwicklung liegt: Wählen Sie ein flexibles, vorsterilisiertes Einweg-Tischsystem, um den experimentellen Durchsatz zu maximieren und die Durchlaufzeit zu minimieren.
- Wenn Ihr Hauptaugenmerk auf der Produktion eines kommerziellen Therapeutikums mit Säugetierzellen liegt: Priorisieren Sie ein Einwegsystem mit geringer Scherkraft, umfassender Sensorintegration und einem gut dokumentierten, skalierbaren Designpfad.
- Wenn Ihr Hauptaugenmerk auf der großtechnischen industriellen Fermentation (z. B. Biokraftstoffe, Enzyme) liegt: Entwerfen Sie einen robusten, kostengünstigen Edelstahlreaktor, der für hohen Massentransfer, effiziente Kühlung und langfristige, dedizierte Produktion optimiert ist.
Ein gut konzipierter Bioreaktor ist nicht nur ein Gerät; er ist ein präzise konstruiertes Ökosystem, das auf das Leben, das er enthält, zugeschnitten ist.
Zusammenfassungstabelle:
| Designüberlegung | Schlüsselfragen | Auswirkung auf das Design |
|---|---|---|
| Zelltyp | Mikrobiell vs. Säugetier? | Agitationsintensität, Scherempfindlichkeit |
| Stoffwechsel | Aerob oder Anaerob? | Gasführung, Sauerstoffversorgung |
| Gefäßmaterial | Edelstahl vs. Einweg? | Investitionskosten, Flexibilität, Sterilisationsbedarf |
| Maßstab | Labormaßstab F&E oder Großproduktion? | Skalierbarkeit, Wärmeübertragung, Mischeffizienz |
Bereit, den idealen Bioreaktor für Ihre spezifische Anwendung zu bauen? Die richtige Laborausrüstung ist entscheidend für den Erfolg. KINTEK ist spezialisiert auf hochwertige Laborausrüstung und Verbrauchsmaterialien und bedient vielfältige Laborbedürfnisse. Unsere Experten können Ihnen helfen, das perfekte Bioreaktor-System auszuwählen, um sicherzustellen, dass Ihre Zellen gedeihen und Ihr Prozess effizient skaliert wird. Kontaktieren Sie unser Team noch heute, um Ihr Projekt zu besprechen und herauszufinden, wie wir Ihre Forschungs- und Produktionsziele unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- Anpassbare Labor-Hochtemperatur-Hochdruckreaktoren für vielfältige wissenschaftliche Anwendungen
- Schüttelinkubatoren für vielfältige Laboranwendungen
- Labor-Vortexmischer Orbitalschüttler Multifunktionaler Rotationsoszillationsmischer
- Labor Hybrid Tissue Grinder
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
Andere fragen auch
- Welche Rolle spielt ein Reaktor mit Heizung und Rühren bei der HSAC-Synthese? Erzielung einer präzisen Polymerkonsistenz
- Wie ermöglichen Hochdruck-Hydrothermalreaktoren die Synthese von mesoporösem Hydroxylapatit? Präzisionstechnik
- Welche spezifischen Reaktionsbedingungen bietet ein Hydrothermal-Carbonisierungsreaktor? Optimierung von Pilzabfällen zu Hydrokohle
- Was ist die Funktion eines Hochdruckreaktors bei 316L PEO? Ermöglichung fortschrittlicher Keramikbeschichtungen auf Edelstahl
- Was ist die Funktion eines Hochdruckreaktors bei der Ligninextraktion? Optimieren Sie Ihre biobasierten Klebstoffproduktionen
- Welche Bedeutung hat die genaue Berechnung des Innendrucks eines Hochdruckreaktors für die NiTi-Laugung?
- Welche Rolle spielt ein Hochdruckreaktor bei der hydrothermalen Synthese? Entwicklung von Lanthan-dotierten Katalysatoren.
- Was ist die Notwendigkeit der Verwendung eines Labor-Hochdruck-Edelstahlreaktors mit Druck- und Temperaturüberwachung für Veresterungsreaktionen?















