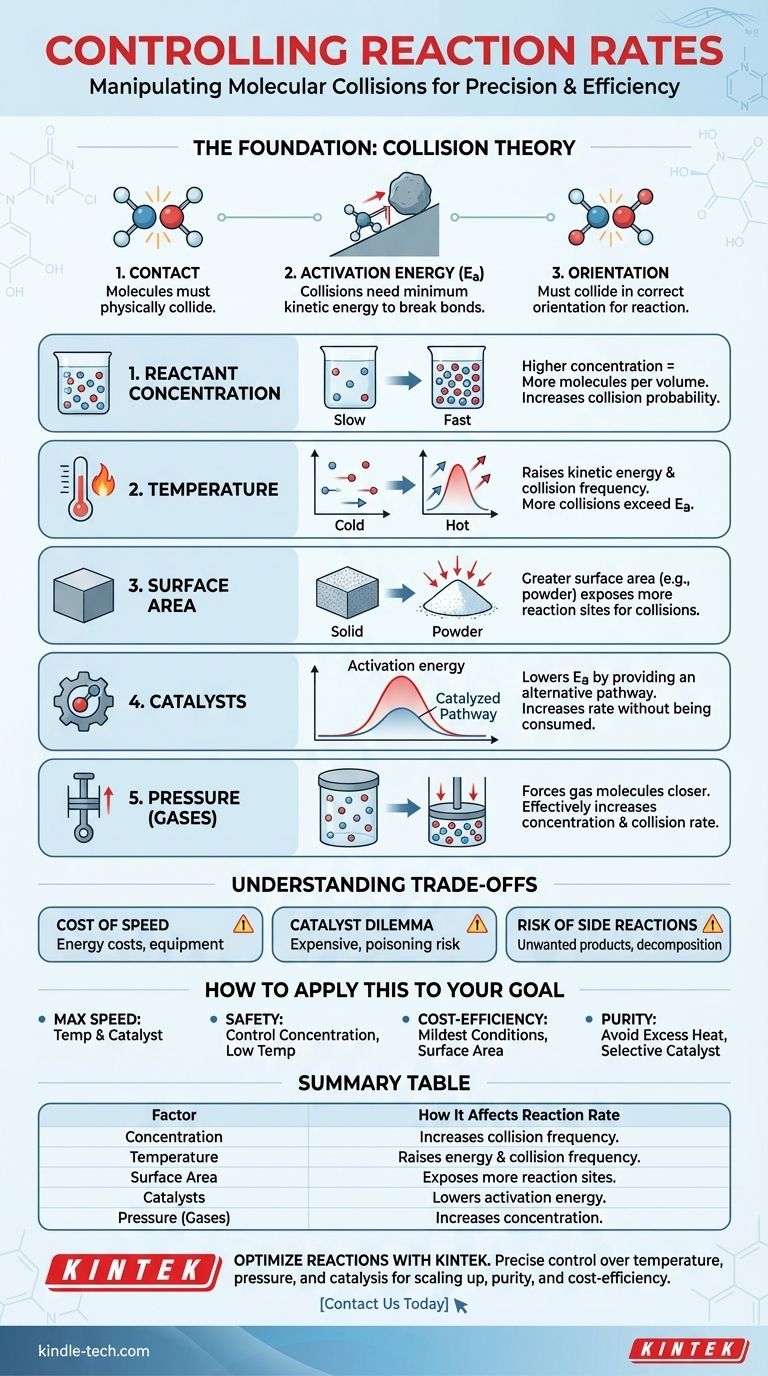
Im Wesentlichen steuern fünf Hauptfaktoren die Geschwindigkeit einer chemischen Reaktion: die Konzentration der Reaktanten, die Temperatur, der physikalische Zustand und die Oberfläche der Reaktanten, das Vorhandensein eines Katalysators und bei Gasen der Druck. Jeder dieser Faktoren beeinflusst die Häufigkeit und Energie molekularer Kollisionen, die der grundlegende Motor jeder chemischen Veränderung ist.
Die Geschwindigkeit jeder chemischen Reaktion wird davon bestimmt, wie oft Reaktantenmoleküle mit der richtigen Ausrichtung und mit genügend Energie kollidieren, um die Aktivierungsenergiebarriere der Reaktion zu überwinden. Alles, was die Reaktionsgeschwindigkeiten steuert, ist lediglich ein Hebel, um die Häufigkeit und Wirksamkeit dieser Kollisionen zu manipulieren.

Die Grundlage: Kollisionstheorie
Um eine Reaktion zu steuern, müssen Sie zunächst verstehen, dass Reaktionen keine sofortigen Ereignisse sind. Sie sind das Ergebnis physikalischer Wechselwirkungen zwischen Molekülen. Dies wird durch die Kollisionstheorie erklärt.
Die Notwendigkeit des Kontakts
Damit eine Reaktion stattfinden kann, müssen Reaktantenmoleküle physisch miteinander kollidieren. Befinden sie sich in getrennten Behältern, kann keine Reaktion stattfinden. Die Reaktionsgeschwindigkeit ist direkt an die Häufigkeit dieser Kollisionen gekoppelt.
Der Energiebedarf (Aktivierungsenergie)
Eine Kollision allein reicht nicht aus. Die kollidierenden Moleküle müssen eine bestimmte Mindestmenge an kinetischer Energie besitzen, die als Aktivierungsenergie (Ea) bekannt ist. Diese Energie ist erforderlich, um bestehende chemische Bindungen zu brechen, damit neue gebildet werden können.
Stellen Sie sich die Aktivierungsenergie wie einen Hügel vor, über den Sie einen Felsbrocken schieben müssen. Ein sanfter Stoß (eine energiearme Kollision) bewirkt nichts. Sie müssen genügend Schub (ausreichend Energie) aufbringen, um ihn auf die Spitze des Hügels zu bringen, wonach er auf der anderen Seite herunterrollen und Energie freisetzen kann.
Der Orientierungsfaktor
Schließlich müssen Moleküle in einer spezifischen Ausrichtung kollidieren, die es ermöglicht, die richtigen Bindungen zu brechen und neue zu bilden. Eine zufällige Kollision im falschen Winkel, selbst wenn sie energisch genug ist, führt nicht zu einer Reaktion.
Die fünf Hebel zur Steuerung der Reaktionsgeschwindigkeit
Das Verständnis der Kollisionstheorie gibt Ihnen fünf verschiedene Hebel in die Hand, um eine Reaktion zu beschleunigen oder zu verlangsamen. Jeder wirkt, indem er die Kollisionshäufigkeit, die Kollisionsenergie oder die Aktivierungsenergiebarriere selbst beeinflusst.
1. Reaktantenkonzentration
Eine Erhöhung der Konzentration der Reaktanten bedeutet, dass mehr Moleküle in einem gegebenen Volumen gepackt sind. Dies erhöht direkt die Wahrscheinlichkeit ihrer Kollision und damit die Reaktionsgeschwindigkeit.
2. Temperatur
Eine Erhöhung der Temperatur hat einen starken, zweifachen Effekt. Erstens erhöht sie die kinetische Energie der Moleküle, wodurch sie sich schneller bewegen und häufiger kollidieren. Zweitens, und noch wichtiger, erhöht sie die Energie dieser Kollisionen, was bedeutet, dass ein höherer Prozentsatz davon genügend Energie haben wird, um die Aktivierungsenergiebarriere zu überwinden.
3. Physikalischer Zustand und Oberfläche
Dies ist am relevantesten für Reaktionen, die verschiedene Phasen betreffen, wie z.B. ein Feststoff, der mit einer Flüssigkeit reagiert (heterogene Reaktionen). Ein fester Block hat eine begrenzte Oberfläche, an der Kollisionen stattfinden können. Das Zerkleinern desselben Blocks zu einem feinen Pulver erhöht seine Oberfläche dramatisch, wodurch mehr Moleküle exponiert werden und weitaus mehr Stellen für Reaktionen entstehen.
4. Katalysatoren
Ein Katalysator erhöht die Reaktionsgeschwindigkeit, ohne dabei verbraucht zu werden. Dies geschieht, indem er einen alternativen Reaktionsweg mit einer niedrigeren Aktivierungsenergie bereitstellt.
Um auf unsere Analogie zurückzukommen: Ein Katalysator ist wie der Bau eines Tunnels durch den Hügel. Sie müssen den Felsbrocken nicht mehr ganz nach oben schieben; Sie können ihn mit viel weniger Aufwand auf die andere Seite bringen. Dies ermöglicht es mehr Molekülen, erfolgreich zu reagieren, selbst bei niedrigeren Temperaturen.
5. Druck (für Gasreaktionen)
Bei Reaktionen, die Gase betreffen, zwingt eine Erhöhung des Drucks die Gasmoleküle näher zusammen. Dies ist im Wesentlichen dasselbe wie eine Erhöhung ihrer Konzentration, was zu häufigeren Kollisionen und einer schnelleren Reaktionsgeschwindigkeit führt.
Die Kompromisse verstehen
Die Manipulation von Reaktionsgeschwindigkeiten ist nicht ohne Folgen. Ein effektiver technischer Berater muss die praktischen und wirtschaftlichen Auswirkungen jeder Wahl berücksichtigen.
Die Kosten der Geschwindigkeit
Die Erhöhung von Temperatur und Druck erfordert Energie, was Geld kostet. Es kann auch spezialisierte Hochdruckreaktoren erfordern, die teuer in Bau und Wartung sind und Sicherheitsaspekte mit sich bringen.
Das Katalysator-Dilemma
Katalysatoren können hochwirksam sein, sind aber oft teuer (z.B. die Verwendung von Edelmetallen wie Platin oder Palladium). Sie können auch sehr spezifisch für eine Reaktion sein und durch Verunreinigungen inaktiv werden, ein Prozess, der als „Katalysatorvergiftung“ bekannt ist.
Risiko unerwünschter Nebenreaktionen
Eine zu starke Beschleunigung einer Reaktion, insbesondere mit übermäßiger Hitze, kann zu unerwünschten Ergebnissen führen. Reaktanten oder Produkte könnten sich zersetzen, oder die erhöhte Energie kann unerwünschte Nebenreaktionen ermöglichen, wodurch die Reinheit und Ausbeute Ihres gewünschten Produkts verringert wird.
Wie Sie dies auf Ihr Ziel anwenden können
Ihre Strategie zur Steuerung einer Reaktion hängt ganz davon ab, was Sie erreichen wollen.
- Wenn Ihr Hauptaugenmerk auf maximaler Geschwindigkeit liegt: Die wirkungsvollsten Hebel sind die Erhöhung der Temperatur und die Verwendung eines effektiven Katalysators, da beide die Anzahl der erfolgreichen, energischen Kollisionen dramatisch erhöhen.
- Wenn Ihr Hauptaugenmerk auf Sicherheit und Kontrolle liegt: Eine sorgfältige Steuerung der Reaktantenkonzentration (z.B. durch langsames Hinzufügen eines Reaktanten zu einem anderen) und die Verwendung der niedrigsten effektiven Temperatur sind die besten Ansätze.
- Wenn Ihr Hauptaugenmerk auf Kosteneffizienz liegt: Optimieren Sie für die mildesten Bedingungen. Dies kann die Suche nach einem erschwinglichen Katalysator oder die Erhöhung der Oberfläche beinhalten, um die hohen Energiekosten extremer Hitze und Druck zu vermeiden.
- Wenn Ihr Hauptaugenmerk auf Produktreinheit liegt: Vermeiden Sie übermäßig hohe Temperaturen, die zu Zersetzung oder Nebenreaktionen führen könnten, und stellen Sie sicher, dass Ihr Katalysator für die gewünschte Reaktion hochselektiv ist.
Letztendlich ist die Steuerung einer chemischen Reaktion die Kunst, die Bedingungen, die molekulare Kollisionen bestimmen, präzise zu managen.
Zusammenfassungstabelle:
| Faktor | Wie er die Reaktionsgeschwindigkeit beeinflusst |
|---|---|
| Konzentration | Höhere Konzentration erhöht die Kollisionshäufigkeit zwischen Reaktantenmolekülen. |
| Temperatur | Erhöht die molekulare Energie und Kollisionshäufigkeit; mehr Kollisionen überschreiten die Aktivierungsenergie. |
| Oberfläche | Größere Oberfläche (z.B. pulverisierter Feststoff) exponiert mehr Reaktionsstellen für Kollisionen. |
| Katalysatoren | Senkt die Aktivierungsenergie durch Bereitstellung eines alternativen Reaktionswegs. |
| Druck (Gase) | Erhöht die Konzentration der Gasmoleküle, was zu häufigeren Kollisionen führt. |
Optimieren Sie Ihre chemischen Reaktionen mit Präzisionsgeräten von KINTEK. Egal, ob Sie die Produktion hochfahren, die Produktreinheit sicherstellen oder die Kosteneffizienz maximieren möchten, unsere Laborgeräte und Verbrauchsmaterialien sind darauf ausgelegt, Ihnen eine präzise Kontrolle über die Reaktionsbedingungen zu ermöglichen. Lassen Sie sich von unseren Experten bei der Auswahl der richtigen Werkzeuge zur Steuerung von Temperatur, Druck und Katalyse für Ihre spezifischen Anforderungen unterstützen. Kontaktieren Sie uns noch heute, um zu besprechen, wie wir den Erfolg Ihres Labors unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- Mini-Hochdruck-Autoklavreaktor aus Edelstahl für Laboranwendungen
- Edelstahl-Hochdruck-Autoklav-Reaktor Labor-Druckreaktor
- Anpassbare Hochdruckreaktoren für fortschrittliche wissenschaftliche und industrielle Anwendungen
- Automatische beheizte hydraulische Pressmaschine mit beheizten Platten für Labor-Heißpresse 25T 30T 50T
Andere fragen auch
- Was ist die Hauptfunktion eines Hochdruckreaktors bei der Dehydrierung von Biomasse? Steigerung der Furan-Umwandlungsausbeuten
- Was ist der Unterschied zwischen GLR- und SSR-Reaktoren? Wählen Sie den richtigen Reaktor für Ihren chemischen Prozess
- Welche Funktionen erfüllen Hochdruckreaktoren bei der Xonolith-Synthese? Erzielen Sie eine schnelle, qualitativ hochwertige Materialproduktion
- Wie verbessern kontinuierliche Rohrreaktoren die Selektivität der Cellulosehydrolyse? Präzise Zeitsteuerung für maximale Ausbeute
- Welche Leistungsanforderungen hat ein Strömungsrohrreaktor (PFR) bei SCWG? Tipps zur hocheffizienten Wasserstoffproduktion
- Welche Funktion erfüllt ein Hochdruckreaktor bei der Synthese von Magnetholz? Ein Expertenleitfaden zur In-situ-Mineralisierung
- Warum sind hocheffiziente Rührsysteme in der Nassoxidationsreaktor unerlässlich? Überwindung von Stoffübergangshindernissen
- Was ist die Funktion eines Edelstahl-Festbettreaktors im Kokosnussschalen-Pyrolyseprozess? Steigerung der Laboreffizienz



