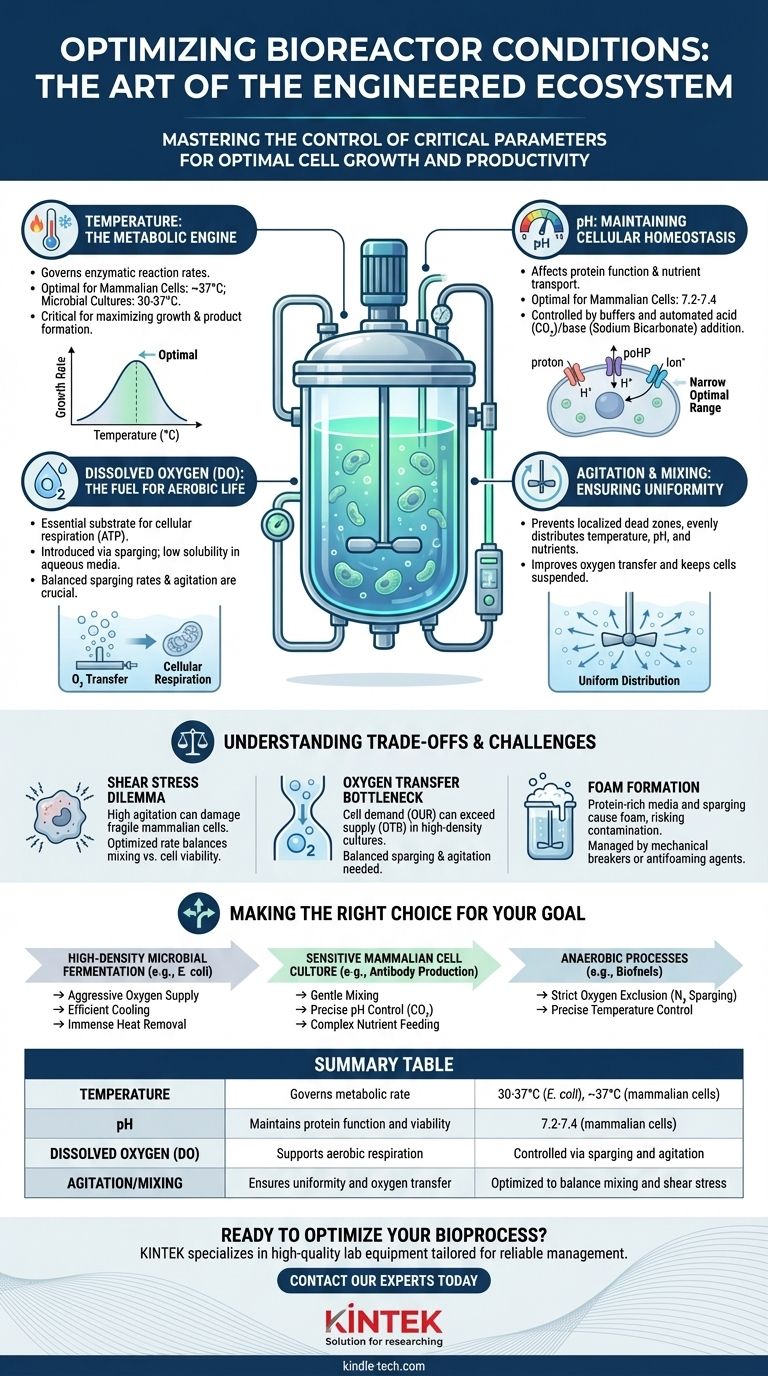
Kurz gesagt, ein Bioreaktor steuert sorgfältig eine Reihe kritischer Umgebungsbedingungen, um optimales Zellwachstum und Produktivität zu gewährleisten. Die grundlegendsten aufrechterhaltenen Parameter sind Temperatur, pH-Wert, gelöster Sauerstoff (DO) und Rührung zum Mischen. Diese werden durch eine kontrollierte Nährstoffzufuhr und die Entfernung von Stoffwechselabfallprodukten unterstützt.
Ein Bioreaktor ist nicht nur ein Behälter; er ist ein entwickeltes Ökosystem, das darauf ausgelegt ist, die ideale physiologische Umgebung für eine spezifische Population von Zellen oder Mikroorganismen zu replizieren und zu optimieren. Die Beherrschung der Kontrolle dieser Bedingungen ist der Unterschied zwischen einer fehlgeschlagenen Charge und einem Bioprozess mit hoher Ausbeute.

Die Kernsäulen der Bioreaktorsteuerung
Um eine erfolgreiche Kultur zu erzielen, muss ein Bioreaktor mehrere miteinander verbundene Variablen präzise verwalten. Jede dient einem bestimmten biologischen Zweck, und ein Fehler in einer kann sich auf das gesamte System auswirken.
Temperatur: Der Motor des Stoffwechsels
Die Temperatur steuert direkt die Geschwindigkeit aller enzymatischen Reaktionen innerhalb der Zellen und ist somit einer der kritischsten Parameter.
Eine optimale Temperatur maximiert die Stoffwechselrate für Wachstum und Produktbildung. Schon eine geringe Abweichung kann Prozesse verlangsamen oder in extremen Fällen irreversible Schäden und Zelltod verursachen. Zum Beispiel gedeihen Säugetierzellen (wie CHO-Zellen) bei etwa 37 °C, während viele mikrobielle Kulturen (wie E. coli) Temperaturen zwischen 30 und 37 °C bevorzugen.
pH-Wert: Aufrechterhaltung der zellulären Homöostase
Der pH-Wert des Kulturmediums beeinflusst die Funktion von Proteinen, den Nährstofftransport über die Zellmembran und die gesamte Zellviabilität.
Zellen haben einen sehr engen optimalen pH-Bereich. Für Säugetierzellen liegt dieser typischerweise zwischen 7,2 und 7,4. Bioreaktoren halten dies durch ein Puffersystem im Medium und durch automatische Zugabe von Säure (oft gasförmiges CO₂) oder einer Base (wie Natriumbicarbonat) aufrecht, um Abweichungen durch den Zellstoffwechsel zu korrigieren.
Gelöster Sauerstoff (DO): Der Treibstoff für aerobes Leben
Für aerobe Organismen ist Sauerstoff ein kritisches Substrat für die Zellatmung, den primären Prozess zur Energiegewinnung (ATP).
Die Konzentration von gelöstem Sauerstoff (DO) ist ein entscheidender limitierender Faktor, da Sauerstoff eine geringe Löslichkeit in wässrigen Medien aufweist. Bioreaktoren führen Sauerstoff durch einen Prozess namens Sparging ein, bei dem gefilterte Luft oder reiner Sauerstoff durch die Kultur geblasen wird. Der DO-Spiegel muss hoch genug sein, um den Stoffwechsel zu unterstützen, aber nicht so hoch, dass er durch die Bildung reaktiver Sauerstoffspezies toxisch wird.
Rühren und Mischen: Gewährleistung der Gleichmäßigkeit
Ein Bioreaktor ist keine statische Umgebung. Konstantes Mischen, angetrieben durch einen Impeller, ist aus mehreren Gründen unerlässlich.
Das Rühren sorgt dafür, dass Temperatur, pH-Wert und Nährstoffe gleichmäßig im Gefäß verteilt werden, wodurch lokalisierte Totzonen verhindert werden. Es hilft auch, gespargelte Gasblasen aufzubrechen, um den Sauerstofftransfer in die Flüssigkeit zu verbessern, und hält die Zellen gleichmäßig suspendiert, anstatt sich am Boden abzusetzen.
Verständnis der Kompromisse und Herausforderungen
Die Aufrechterhaltung dieser idealen Bedingungen ist ein ständiger Balanceakt mit mehreren inhärenten technischen Herausforderungen.
Das Scherspannungsdilemma
Während das Rühren zum Mischen notwendig ist, können hohe Impellergeschwindigkeiten starke hydrodynamische Kräfte erzeugen, die als Scherstress bekannt sind.
Mikrobielle Zellen sind im Allgemeinen robust, aber empfindliche Säugetierzellen können durch übermäßigen Scherstress leicht beschädigt oder abgetötet werden. Daher muss die Rührgeschwindigkeit sorgfältig optimiert werden, um eine ausreichende Mischung ohne Beeinträchtigung der Zellviabilität zu gewährleisten.
Der Engpass beim Sauerstofftransfer
Mit zunehmender Zelldichte kann der Sauerstoffbedarf der Kultur (Oxygen Uptake Rate, OUR) die Fähigkeit des Bioreaktors, diesen zu liefern (Oxygen Transfer Rate, OTR), übersteigen.
Dies ist ein häufiger Engpass in Kulturen mit hoher Dichte. Ingenieure müssen die Spargingraten und das Rühren ausbalancieren, um den Sauerstofftransfer zu maximieren, ohne übermäßige Schaumbildung oder Scherstress zu verursachen.
Schaumbildung
Das Einleiten von Gas in ein proteinreiches Kulturmedium ist ein perfektes Rezept für Schaum.
Übermäßiger Schaum kann Abluftfilter blockieren, was zu Druckaufbau und potenzieller Kontamination führen kann. Bioreaktoren steuern dies durch mechanische Schaumbrecher oder die automatische Zugabe von chemischen Antischaummitteln.
Die richtige Wahl für Ihr Ziel treffen
Die spezifischen Sollwerte und Kontrollstrategien für einen Bioreaktor hängen vollständig von den kultivierten Zellen und dem gewünschten Ergebnis ab.
- Wenn Ihr Hauptaugenmerk auf der mikrobiellen Fermentation mit hoher Dichte liegt (z. B. E. coli): Ihre Priorität wird eine aggressive Sauerstoffversorgung und ein effizientes Kühlsystem sein, um die immense Wärme abzuführen, die durch den schnellen Stoffwechsel erzeugt wird.
- Wenn Ihr Hauptaugenmerk auf empfindlichen Säugetierzellkulturen liegt (z. B. für die Antikörperproduktion): Sie werden sanftes Mischen zur Minimierung von Scherstress, präzise pH-Kontrolle mittels CO₂ und potenziell komplexe Nährstoffzufuhrstrategien priorisieren.
- Wenn Ihr Hauptaugenmerk auf einem anaeroben Prozess liegt (z. B. bestimmte Biokraftstoffproduktionen): Der Schlüssel ist der strikte Ausschluss von Sauerstoff durch Sparging mit einem Inertgas wie Stickstoff, zusammen mit präziser Temperaturkontrolle.
Letztendlich ist die Beherrschung des Zusammenspiels dieser Bedingungen die grundlegende Fähigkeit, einen biologischen Prozess erfolgreich vom Labor auf die industrielle Produktion zu übertragen.
Zusammenfassungstabelle:
| Bedingung | Zweck | Typischer Bereich/Beispiel |
|---|---|---|
| Temperatur | Steuert die Stoffwechselrate | 30-37°C (E. coli), ~37°C (Säugetierzellen) |
| pH-Wert | Erhält die Proteinfunktion und Viabilität | 7,2-7,4 (Säugetierzellen) |
| Gelöster Sauerstoff (DO) | Unterstützt die aerobe Atmung | Gesteuert durch Sparging und Rühren |
| Rühren/Mischen | Gewährleistet Gleichmäßigkeit und Sauerstofftransfer | Optimiert, um Mischen und Scherstress auszugleichen |
Bereit, Ihren Bioprozess mit präzisionsgesteuerten Bioreaktorbedingungen zu optimieren? KINTEK ist spezialisiert auf hochwertige Laborausrüstung und Verbrauchsmaterialien, die auf zuverlässiges Temperatur-, pH- und gelösten Sauerstoffmanagement zugeschnitten sind – egal ob Sie die mikrobielle Fermentation skalieren oder empfindliche Säugetierzellen kultivieren. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie unsere Lösungen die Produktivität und Ausbeute Ihres Labors steigern können.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Kundenspezifische vielseitige CVD-Rohröfen-Systemausrüstung für die chemische Gasphasenabscheidung
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- Chemische Gasphasenabscheidung CVD-Anlagenkammer-Schiebe-PECVD-Rohröfen mit Flüssiggasifikator PECVD-Maschine
- RF PECVD System Hochfrequenz-Plasma-unterstützte chemische Gasphasenabscheidung RF PECVD
Andere fragen auch
- Welche Rolle spielt ein Zwei-Elektroden-Elektrochemie-Reaktor beim Wachstum von TiO2? Erreichen Sie noch heute geordnete Nanostrukturen
- Welche Parameter müssen in einer Elektrolysezelle aus reinem PTFE streng kontrolliert werden? Präzision und Sicherheit gewährleisten
- Welche Vorsichtsmaßnahmen sind hinsichtlich der Temperatur bei der Verwendung einer Elektrolysezelle aus reinem PTFE zu treffen? Gewährleisten Sie sichere & genaue Experimente
- Was sind die Hauptfunktionen einer Hochleistungs-Elektrolysezelle im eCO2R-Prozess? Optimieren Sie Ihre Laborergebnisse
- Welche Funktionen erfüllen Elektrolysezellen bei der PEC-Wasserspaltung? Optimieren Sie Ihre photoelektrochemische Forschung


















