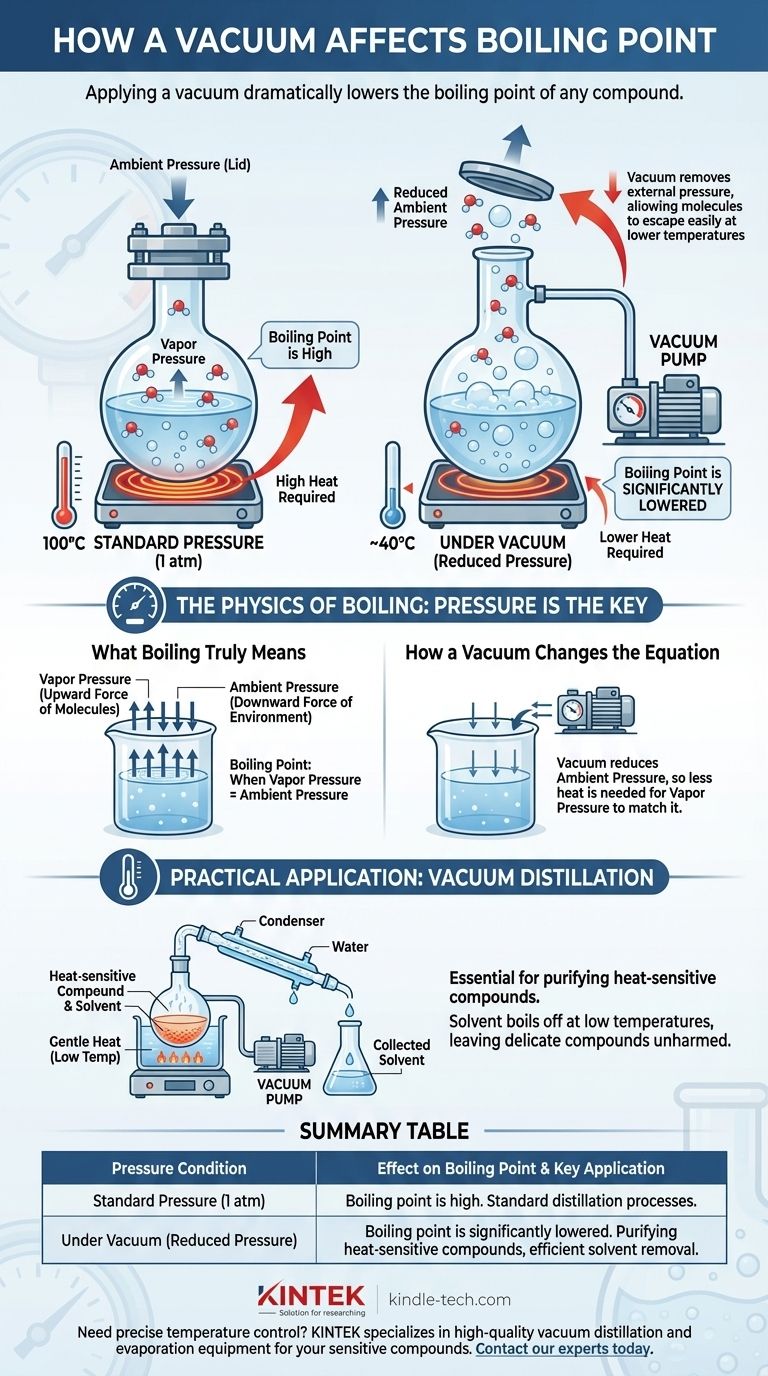
Kurz gesagt, das Anlegen eines Vakuums senkt den Siedepunkt jeder Verbindung dramatisch. Sieden ist keine feste Temperatur, sondern der Punkt, an dem der innere Dampfdruck einer Flüssigkeit dem äußeren Druck entspricht, der auf ihre Oberfläche drückt. Durch das Erzeugen eines Vakuums entfernen Sie diesen äußeren Druck, wodurch es für Moleküle viel einfacher wird, die flüssige Phase zu verlassen und bei einer viel niedrigeren Temperatur in ein Gas überzugehen.
Der Siedepunkt einer Flüssigkeit ist keine Konstante; er ist eine direkte Funktion des Umgebungsdrucks. Die Reduzierung dieses Drucks durch ein Vakuum senkt die Energie, die Moleküle benötigen, um in ein Gas überzugehen, wodurch die Substanz bei einer deutlich reduzierten Temperatur siedet.

Die Physik des Siedens: Der Druck ist der Schlüssel
Um zu verstehen, warum ein Vakuum eine so starke Wirkung hat, müssen wir zunächst neu definieren, was „Sieden“ eigentlich bedeutet. Es geht weniger um eine bestimmte Temperatur als vielmehr um einen Kampf der Drücke.
Was Sieden wirklich bedeutet
Sieden ist der spezifische physikalische Zustand, in dem der Dampfdruck einer Flüssigkeit gleich dem Umgebungsdruck ihrer Umgebung wird.
An diesem Gleichgewichtspunkt können Dampfblasen im Inneren der Flüssigkeit entstehen und an die Oberfläche aufsteigen. Dies unterscheidet sich grundlegend von der einfachen Verdunstung, die nur an der Flüssigkeitsoberfläche stattfindet.
Die Rolle des Dampfdrucks
Jede Flüssigkeit übt einen gewissen Dampfdruck aus, die inhärente Kraft ihrer Moleküle, die versuchen, in die gasförmige Phase zu entweichen.
Wenn Sie eine Flüssigkeit erhitzen, gewinnen ihre Moleküle kinetische Energie. Diese erhöhte Energie führt dazu, dass sie stärker gegen ihre Umgebung drücken, und somit nimmt der Dampfdruck mit der Temperatur zu.
Wie der Umgebungsdruck als „Deckel“ wirkt
Die Atmosphäre um uns herum übt einen konstanten Druck auf alles aus, einschließlich der Oberfläche von Flüssigkeiten. Sie können sich diesen Umgebungsdruck als einen physischen „Deckel“ vorstellen, der die Moleküle der Flüssigkeit an Ort und Stelle hält.
Damit eine Flüssigkeit siedet, muss ihr Dampfdruck stark genug werden, um „den Deckel anzuheben“. Auf Meereshöhe (1 Atmosphäre Druck) muss Wasser 100 °C (212 °F) erreichen, um genügend Dampfdruck zu erzeugen, um dies zu erreichen.
Wie ein Vakuum die Gleichung verändert
Eine Vakuumpumpe entfernt Gasmoleküle aus einem geschlossenen System und reduziert dadurch drastisch den Umgebungsdruck. Dies verändert die für das Sieden erforderlichen Bedingungen grundlegend.
Den „Deckel“ entfernen
Das Anlegen eines Vakuums ist gleichbedeutend mit dem Anheben dieses Druck „Deckels“. Da weniger Gasmoleküle auf die Oberfläche der Flüssigkeit drücken, können die Moleküle viel leichter entweichen.
Dies ist derselbe Grund, warum Wasser in großen Höhen bei niedrigerer Temperatur siedet. Der atmosphärische Druck ist auf einem Berg niedriger, sodass weniger Wärme erforderlich ist, damit der Dampfdruck des Wassers ihm entspricht.
Der neue, niedrigere Siedepunkt
Da der äußere Druck nun viel geringer ist, benötigt die Flüssigkeit weniger Wärmeenergie, um ihren Dampfdruck auf den Siedepunkt zu erhöhen.
Das Ergebnis ist, dass die Substanz bei einer Temperatur weit unter ihrem normalen Siedepunkt siedet. Unter einem ausreichend starken Vakuum kann Wasser beispielsweise bei Raumtemperatur zum Sieden gebracht werden.
Praktische Anwendung: Vakuumdestillation
Dieses Prinzip ist in der Chemie für die Reinigung wärmeempfindlicher Verbindungen unerlässlich. Ein Chemiker kann ein Gemisch unter Vakuum stellen und es sanft erhitzen.
Ein flüchtiges Lösungsmittel siedet bei sehr niedriger Temperatur ab und hinterlässt die gewünschte, empfindlichere Verbindung, die niemals potenziell schädlicher hoher Hitze ausgesetzt wird.
Abwägungen und Fallstricke verstehen
Obwohl die Senkung des Siedepunkts durch Vakuum sehr wirkungsvoll ist, ist sie nicht ohne Herausforderungen und erfordert sorgfältige Überlegungen.
Risiko des „Bumping“ (Aufschäumens)
Unter Vakuum können Flüssigkeiten explosionsartig in einem Phänomen namens Bumping (Aufschäumen) sieden. Ungleichmäßige Erwärmung kann dazu führen, dass ein Teil der Flüssigkeit überhitzt wird und plötzlich mit heftiger Kraft verdampft. Dies wird typischerweise durch Siedesteine oder ständiges Rühren verhindert.
Schwierigkeiten bei Substanzen mit geringer Flüchtigkeit
Bei Substanzen mit sehr schwachen intermolekularen Kräften und damit sehr niedrigen Dampfdrücken (wie Öle oder ionische Flüssigkeiten) kann selbst ein Hochvakuum den Siedepunkt möglicherweise nicht weit genug senken, um eine thermische Zersetzung zu verhindern. Es gibt eine praktische Grenze für den Nutzen dieser Technik.
Geräte- und Dichtheitsintegrität
Das Erreichen und Aufrechterhalten eines tiefen Vakuums erfordert spezielle Pumpen und perfekt abgedichtete Glasgeräte oder Behälter. Schon eine kleine Undichtigkeit kann den Druck im System beeinträchtigen und den Siedepunkt unerwartet ansteigen lassen.
Die richtige Wahl für Ihr Ziel treffen
Die Beeinflussung des Drucks ist ein Werkzeug, und seine Anwendung hängt vollständig von Ihrem Ziel ab.
- Wenn Ihr Hauptaugenmerk auf der Reinigung einer wärmeempfindlichen Verbindung liegt: Verwenden Sie Vakuumdestillation, um Komponenten bei Temperaturen zu trennen, die eine Zersetzung oder unerwünschte Nebenreaktionen verhindern.
- Wenn Ihr Hauptaugenmerk auf der effizienten Entfernung eines Lösungsmittels liegt: Legen Sie ein Vakuum an, oft mit Rotation (wie bei einem Rotationsverdampfer), um Lösungsmittel schnell zu verdampfen, ohne hohe Hitze zuzuführen.
- Wenn Ihr Hauptaugenmerk auf der Dehydratisierung eines empfindlichen Materials liegt: Verwenden Sie ein tiefes Vakuum, um den Siedepunkt/Sublimationspunkt von Wasser zu senken, was eine Dehydratisierung bei niedrigen Temperaturen (Gefriertrocknung) ermöglicht, die die Struktur des Materials erhält.
Letztendlich ermöglicht Ihnen das Verständnis der Beziehung zwischen Druck und Temperatur eine präzise Kontrolle über den physikalischen Zustand einer Substanz.
Zusammenfassungstabelle:
| Druckbedingung | Auswirkung auf den Siedepunkt | Hauptanwendung |
|---|---|---|
| Normaldruck (1 atm) | Der Siedepunkt liegt bei seiner normalen, hohen Temperatur. | Standard-Destillationsprozesse. |
| Unter Vakuum (Reduzierter Druck) | Der Siedepunkt wird signifikant gesenkt. | Reinigung wärmeempfindlicher Verbindungen, effiziente Lösungsmittelentfernung. |
Benötigen Sie eine präzise Temperaturkontrolle für Ihre empfindlichen Verbindungen? KINTEK ist spezialisiert auf hochwertige Vakuumdestillations- und Verdampfungsgeräte, einschließlich Rotationsverdampfern, die zum Schutz Ihrer empfindlichen Materialien durch Senkung der Siedepunkte entwickelt wurden. Unsere Laborgeräte gewährleisten eine effiziente und sichere Verarbeitung für Forscher und Laborfachleute. Kontaktieren Sie noch heute unsere Experten, um die perfekte Vakuumlösung für Ihre Anwendung zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Umlaufwasser-Vakuumpumpe für Labor und Industrie
- Labor-Drehschieber-Vakuumpumpe für Laboranwendungen
- Ölfreie Membran-Vakuumpumpe für Labor und Industrie
- Elektrische hydraulische Vakuum-Heizpresse für Laboratorien
- 304 316 Edelstahl Vakuum Kugelhahn Absperrventil für Hochvakuum-Systeme
Andere fragen auch
- Ist es sicher, einen Ofen zu saugen? Ein Leitfaden zur sicheren DIY-Wartung und wann man einen Profi rufen sollte
- Was ist der Unterschied zwischen Sintern und Schmelzen? Konsolidierung vs. Extraktion erklärt
- Welche Funktion erfüllt die Vakuumumgebung während der Verdichtung von Ag-SnO₂-Y₂O₃? Optimieren Sie die Materialdichte
- Wie hoch ist die Temperatur eines Industrieofens? Es hängt ganz von Ihrem Prozess und Material ab.
- Welche Materialien werden vakuumgehärtet? Erzielen Sie eine überlegene Oberflächenqualität bei hochlegierten Stählen und empfindlichen Metallen
- Was ist die Hauptfunktion eines Salzschmelzreaktionsofens? Oberflächenmodifizierung von Kohlenstoff-Kohlenstoff-Verbundwerkstoffen verbessern
- Warum wird ein Hochtemperatur-Anlassofen für die Nachbehandlung von Dünnschichten benötigt? Maximale Leistung freischalten
- Wie erleichtert ein Vakuumtrockenschrank im Labor die Prüfung des Gelgehalts von UV-gehärteten Silikonkautschukfolien?



















