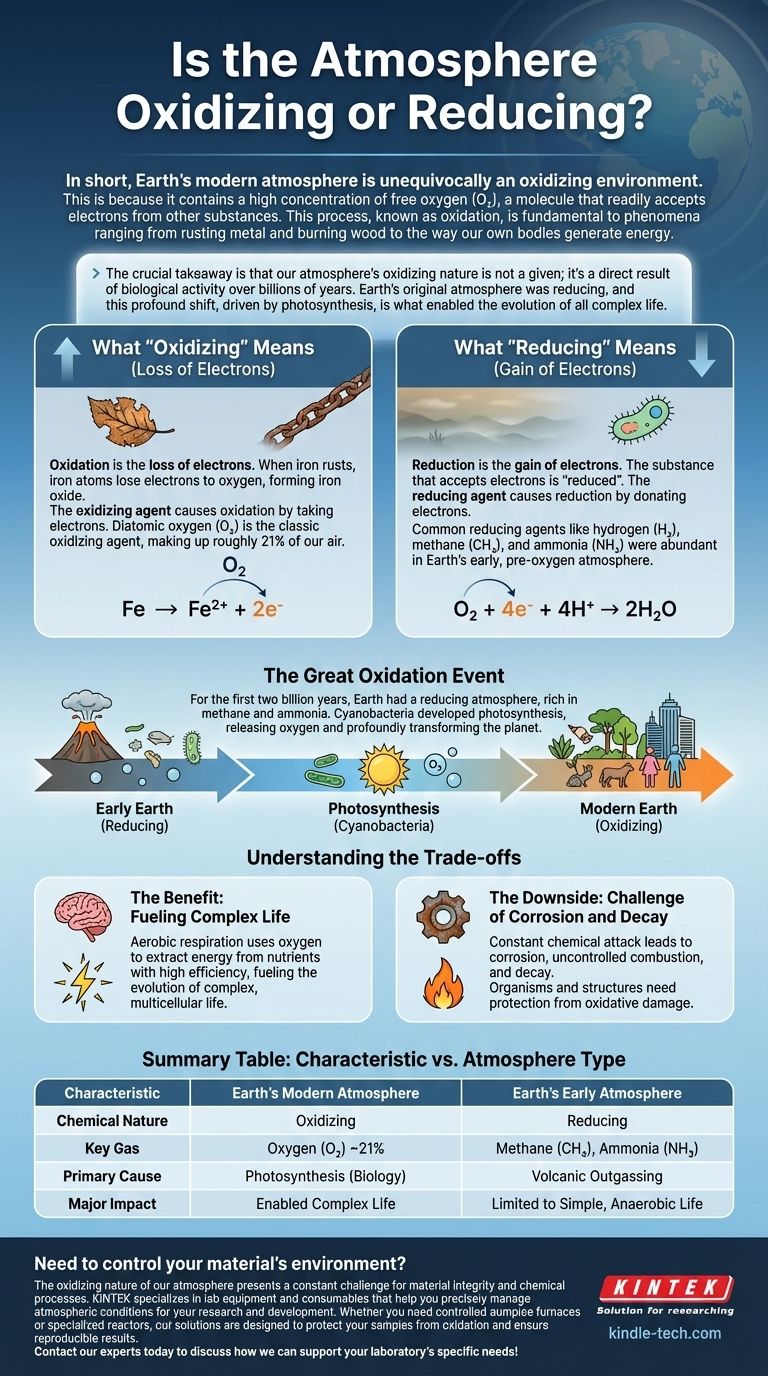
Kurz gesagt, die moderne Erdatmosphäre ist eindeutig eine oxidierende Umgebung. Dies liegt daran, dass sie eine hohe Konzentration an freiem Sauerstoff (O₂) enthält, einem Molekül, das leicht Elektronen von anderen Substanzen aufnimmt. Dieser Prozess, bekannt als Oxidation, ist grundlegend für Phänomene, die vom Rosten von Metall und dem Verbrennen von Holz bis hin zur Art und Weise reichen, wie unser eigener Körper Energie erzeugt.
Die entscheidende Erkenntnis ist, dass die oxidierende Natur unserer Atmosphäre keine Selbstverständlichkeit ist; sie ist ein direktes Ergebnis biologischer Aktivität über Milliarden von Jahren. Die ursprüngliche Erdatmosphäre war reduzierend, und diese tiefgreifende Verschiebung, angetrieben durch die Photosynthese, ermöglichte die Evolution allen komplexen Lebens.

Was "oxidierend" und "reduzierend" wirklich bedeuten
Um den Zustand unserer Atmosphäre zu verstehen, müssen wir zunächst die grundlegenden chemischen Prinzipien definieren, die im Spiel sind. Diese Begriffe beschreiben die Übertragung von Elektronen zwischen Molekülen.
Die Rolle der Elektronen
Oxidation ist der Verlust von Elektronen. Wenn Eisen rostet, verlieren Eisenatome Elektronen an Sauerstoff und bilden Eisenoxid.
Reduktion ist die Aufnahme von Elektronen. Die Substanz, die die Elektronen aufnimmt, wird als "reduziert" bezeichnet. Im Rostbeispiel nimmt Sauerstoff Elektronen vom Eisen auf, sodass der Sauerstoff reduziert wird.
Identifizierung eines Oxidationsmittels
Ein Oxidationsmittel (oder Oxidans) ist eine Substanz, die Oxidation verursacht, indem sie Elektronen von etwas anderem aufnimmt.
Aufgrund seiner starken Tendenz, Elektronen anzuziehen und aufzunehmen, ist zweiatomiger Sauerstoff (O₂) das klassische und bedeutendste Oxidationsmittel in unserer Umwelt.
Identifizierung eines Reduktionsmittels
Ein Reduktionsmittel (oder Reduktans) ist eine Substanz, die Reduktion verursacht, indem sie ihre Elektronen an etwas anderes abgibt.
Häufige Reduktionsmittel sind Wasserstoff (H₂), Methan (CH₄) und Ammoniak (NH₃). Diese waren in der frühen, sauerstofffreien Atmosphäre der Erde reichlich vorhanden.
Die dominierende Kraft: Warum unsere Atmosphäre oxidierend ist
Der chemische Charakter unserer Atmosphäre wird von einem dominanten Molekül bestimmt, das etwa 21 % der Luft ausmacht, die wir atmen.
Der Sauerstofffaktor
Das Vorhandensein von etwa 21 % freiem Sauerstoff ist der Hauptgrund, warum unsere Atmosphäre oxidierend ist. Sauerstoff ist stark elektronegativ, was bedeutet, dass seine Atome eine starke Anziehungskraft auf Elektronen ausüben. Dies macht O₂ chemisch aggressiv und bereit, mit einer Vielzahl anderer Elemente und Verbindungen zu reagieren – und diese zu oxidieren.
Das Große Oxidationsereignis
Unser Planet war nicht immer so. In den ersten zwei Milliarden Jahren seiner Geschichte hatte die Erde eine reduzierende Atmosphäre, praktisch frei von O₂ und reich an Gasen wie Methan und Ammoniak.
Dies änderte sich mit der Evolution der Cyanobakterien. Diese Mikroorganismen entwickelten die Photosynthese, einen Prozess, der Sonnenlicht zur Energiegewinnung nutzt und Sauerstoff als Abfallprodukt freisetzt. Über Hunderte von Millionen Jahren transformierte diese biologische Aktivität den gesamten Planeten langsam und tiefgreifend, indem sie enorme Mengen O₂ in die Luft pumpte und ihn in seinen modernen oxidierenden Zustand versetzte.
Die Kompromisse verstehen
Eine sauerstoffreiche, oxidierende Umgebung bietet sowohl einen großen Vorteil als auch eine anhaltende chemische Herausforderung.
Der Vorteil: Treibstoff für komplexes Leben
Der primäre Vorteil ist die aerobe Atmung. Dieser Stoffwechselprozess nutzt Sauerstoff, um Energie aus Nährstoffen mit unglaublicher Effizienz zu gewinnen – weit mehr als die anaeroben (sauerstofffreien) Prozesse, die ihm vorausgingen. Dieser massive Energieüberschuss befeuerte die Evolution komplexen, vielzelligen Lebens, einschließlich uns.
Die Kehrseite: Die Herausforderung von Korrosion und Verfall
Die "Kosten" einer oxidierenden Atmosphäre sind ständige chemische Angriffe. Dies ist die Kraft hinter Korrosion (wie Rost), unkontrollierter Verbrennung (Feuer) und dem Verfall organischer Materie.
Lebende Organismen müssen Energie in ausgeklügelte antioxidative Abwehrmechanismen investieren, um ihre Zellen vor oxidativen Schäden zu schützen, während jede von uns gebaute Struktur so konzipiert sein muss, dass sie den unerbittlichen Auswirkungen des atmosphärischen Sauerstoffs standhält.
Wichtige Erkenntnisse für verschiedene Kontexte
Ihre Herangehensweise an diese Tatsache hängt von Ihrem Fachgebiet und Ihren Zielen ab.
- Wenn Ihr Hauptaugenmerk auf Chemie oder Materialwissenschaft liegt: Erkennen Sie, dass jede Substanz, die unserer Luft ausgesetzt ist, in einem ständigen Kampf gegen Oxidation steht, ein kritischer Faktor, der die Materialauswahl, Konservierung und Haltbarkeit beeinflusst.
- Wenn Ihr Hauptaugenmerk auf Biologie oder Geologie liegt: Verstehen Sie, dass die Verschiebung von einer reduzierenden zu einer oxidierenden Atmosphäre wohl die bedeutendste Umweltveränderung in der Geschichte der Erde war, die den gesamten weiteren Verlauf der Evolution bestimmte.
- Wenn Ihr Hauptaugenmerk auf Astrobiologie liegt: Nutzen Sie das Vorhandensein von erheblichem freiem Sauerstoff in der Atmosphäre eines Exoplaneten als führende Biosignatur, da es schwierig ist, ihn ohne eine starke, planetenweite biologische Quelle aufrechtzuerhalten.
Die oxidierende Natur unserer Atmosphäre zu verstehen bedeutet, den grundlegenden chemischen Motor zu verstehen, der sowohl das Leben als auch den Verfall auf unserer Welt antreibt.
Zusammenfassungstabelle:
| Merkmal | Moderne Erdatmosphäre | Frühe Erdatmosphäre |
|---|---|---|
| Chemische Natur | Oxidierend | Reduzierend |
| Schlüsselgas | Sauerstoff (O₂) ~21% | Methan (CH₄), Ammoniak (NH₃) |
| Primäre Ursache | Photosynthese (Biologie) | Vulkanische Ausgasung |
| Hauptauswirkung | Ermöglichte komplexes Leben | Beschränkt auf einfaches, anaerobes Leben |
Müssen Sie die Umgebung Ihres Materials kontrollieren? Die oxidierende Natur unserer Atmosphäre stellt eine ständige Herausforderung für die Materialintegrität und chemische Prozesse dar. KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien, die Ihnen helfen, atmosphärische Bedingungen für Ihre Forschung und Entwicklung präzise zu steuern. Ob Sie Öfen mit kontrollierter Atmosphäre oder spezielle Reaktoren benötigen, unsere Lösungen wurden entwickelt, um Ihre Proben vor Oxidation zu schützen und reproduzierbare Ergebnisse zu gewährleisten. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir die spezifischen Anforderungen Ihres Labors unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1400℃ Kammerofen mit kontrollierter Atmosphäre und Stickstoff- und Inertgasatmosphäre
- Kontrollierter Hochtemperatur-Wasserstoff-Ofen
- 1700℃ Kontrollierte Atmosphäre Ofen Stickstoff Inertgas Ofen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Warum wird Stickstoff in Glühöfen verwendet? Um Oxidation und Entkohlung für eine überlegene Metallqualität zu verhindern
- Welche Gase werden in inerten Atmosphären verwendet? Wählen Sie das richtige Gas für nicht-reaktive Umgebungen
- Wie können wir eine inerte Atmosphäre für eine chemische Reaktion entwickeln? Präzise atmosphärische Kontrolle für Ihr Labor meistern
- Was sorgt für eine inerte Atmosphäre? Erreichen Sie Sicherheit und Reinheit mit Stickstoff, Argon oder CO2
- Was ist eine Wärmebehandlung unter inerter Atmosphäre? Schützen Sie Ihre Metalle vor Oxidation & Entkohlung



















