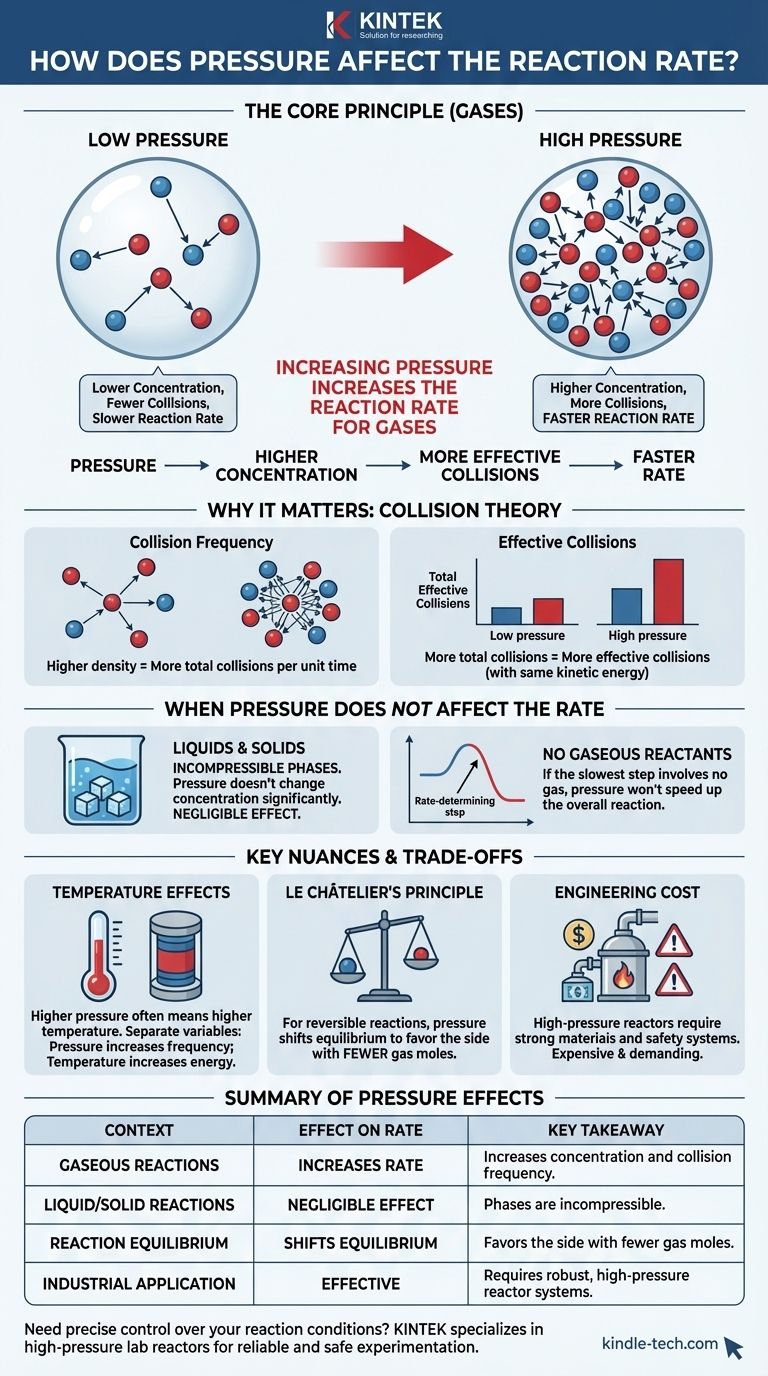
Kurz gesagt: Die Erhöhung des Drucks einer Reaktion, an der Gase beteiligt sind, erhöht die Reaktionsgeschwindigkeit. Dies geschieht, weil der Druck ein direktes Maß für die Konzentration bei Gasen ist. Durch das Komprimieren der Gasmoleküle in ein kleineres Volumen erhöhen Sie die Wahrscheinlichkeit, dass sie miteinander kollidieren und reagieren.
Das Kernprinzip ist, dass bei Gasreaktionen der Druck als direkter Hebel auf die Konzentration wirkt. Höherer Druck zwingt Gasmoleküle näher zusammen, was die Häufigkeit effektiver Kollisionen erhöht und dadurch die Reaktion beschleunigt. Dieser Effekt ist bei Reaktionen in flüssiger oder fester Phase vernachlässigbar.

Der grundlegende Mechanismus: Warum Druck wichtig ist
Um den Effekt des Drucks wirklich zu verstehen, müssen wir zu den ersten Prinzipien zurückkehren, wie chemische Reaktionen ablaufen. Alles dreht sich um das Konzept der Teilchenkollisionen.
Druck als Maß für die Konzentration
Bei Gasen ist Druck keine abstrakte Kraft; er ist das Ergebnis von Gasmolekülen, die mit den Wänden ihres Behälters kollidieren.
Das ideale Gasgesetz zeigt eine direkte Beziehung zwischen Druck (P) und der Stoffmenge (n) in einem gegebenen Volumen (V) bei konstanter Temperatur (T). Mehr Moleküle im gleichen Raum bedeuten mehr Druck. Daher ist die Erhöhung des Drucks funktional dasselbe wie die Erhöhung der Konzentration.
Die Rolle der Stoßtheorie
Chemische Reaktionen treten auf, wenn Reaktantenteilchen kollidieren und zwei Schlüsselbedingungen erfüllt sind:
- Sie müssen genügend kinetische Energie besitzen, um die Aktivierungsenergiebarriere zu überwinden.
- Sie müssen mit der korrekten räumlichen Ausrichtung kollidieren.
Eine Kollision, die beide Kriterien erfüllt, wird als effektive Kollision bezeichnet. Die Geschwindigkeit einer Reaktion wird durch die Häufigkeit dieser effektiven Kollisionen bestimmt.
Mehr Druck = Mehr Kollisionen
Wenn Sie den Druck eines Gasesystems erhöhen, zwingen Sie dieselbe Anzahl von Molekülen in ein kleineres Volumen.
Diese höhere Dichte bedeutet, dass der durchschnittliche Abstand zwischen den Molekülen abnimmt. Folglich nimmt die Gesamtzahl der Kollisionen zwischen den Reaktantmolekülen pro Zeiteinheit erheblich zu.
Die Auswirkung auf „effektive“ Kollisionen
Obwohl die Erhöhung des Drucks die Gesamtzahl der Kollisionen erhöht, ändert sie nicht die kinetische Energie der einzelnen Moleküle (vorausgesetzt, die Temperatur bleibt konstant).
Daher bleibt der Prozentsatz der Kollisionen, die effektiv sind, derselbe. Da jedoch die Gesamtzahl der Kollisionen gestiegen ist, nimmt auch die absolute Anzahl der effektiven Kollisionen pro Sekunde zu. Dies treibt die Reaktionsgeschwindigkeit in die Höhe.
Wann Druck die Geschwindigkeit nicht beeinflusst
Der Zusammenhang zwischen Druck und Reaktionsgeschwindigkeit ist stark, aber nicht universell. Es ist entscheidend zu wissen, wann er nicht zutrifft.
Reaktionen in flüssiger und fester Phase
Flüssigkeiten und Feststoffe gelten als inkompressible Phasen. Die Anwendung von äußerem Druck ändert ihr Volumen oder den Abstand zwischen ihren Bestandteilen nicht wesentlich.
Da Druckänderungen die Konzentration der Reaktanten in Flüssigkeiten und Feststoffen nicht verändern, hat Druck einen vernachlässigbaren Einfluss auf die Geschwindigkeit von Reaktionen, die ausschließlich in diesen Phasen ablaufen.
Reaktionen ohne gasförmige Reaktanten
Wenn ein Reaktionsmechanismus mehrere Schritte umfasst, wird die Gesamtgeschwindigkeit durch den langsamsten Schritt bestimmt, bekannt als der geschwindigkeitsbestimmende Schritt.
Wenn dieser geschwindigkeitsbestimmende Schritt keine gasförmigen Reaktanten beinhaltet, beeinflussen Änderungen des äußeren Drucks nicht die gesamte Reaktionsgeschwindigkeit.
Verständnis der Kompromisse und Nuancen
Die Kontrolle des Drucks ist eine gängige industrielle Strategie, bringt jedoch wichtige Überlegungen mit sich, die über einfache Geschwindigkeitsänderungen hinausgehen.
Unterscheidung von Temperatureffekten
In der Praxis erhöht die Kompression eines Gases dessen Temperatur. Sowohl höherer Druck als auch höhere Temperatur erhöhen die Reaktionsgeschwindigkeiten, jedoch aus unterschiedlichen Gründen.
Es ist entscheidend, die Variablen zu isolieren. Druck erhöht die Häufigkeit der Kollisionen, während Temperatur die Energie und Kraft dieser Kollisionen erhöht, wodurch ein höherer Prozentsatz davon effektiv wird.
Prinzip von Le Châtelier und Gleichgewicht
Bei reversiblen Reaktionen, die einen Gleichgewichtszustand erreichen, spielt der Druck eine Doppelrolle. Gemäß dem Prinzip von Le Châtelier verschiebt die Druckerhöhung die Gleichgewichtslage zugunsten der Seite der Reaktion mit weniger Gasmolekülen.
Dies ist ein separates Konzept von der Kinetik (Geschwindigkeit). Druck erhöht die Geschwindigkeit sowohl der Hin- als auch der Rückreaktion, kann aber das endgültige Gleichgewicht von Produkten und Reaktanten verschieben.
Die technischen Kosten von hohem Druck
Der Bau und die Wartung von Hochdruckreaktoren sind technologisch anspruchsvoll und teuer. Die Materialien müssen stark genug sein, um der Belastung standzuhalten, und es sind umfangreiche Sicherheitssysteme erforderlich, um katastrophale Ausfälle zu verhindern. Dieser wirtschaftliche und sicherheitstechnische Kompromiss ist ein wichtiger Faktor bei der Gestaltung industrieller Prozesse.
Anwendung auf Ihr Ziel
Ihr Ansatz zur Nutzung des Drucks hängt vollständig von dem chemischen System ab, mit dem Sie arbeiten, und davon, was Sie erreichen möchten.
- Wenn Ihr Hauptaugenmerk auf der Maximierung der Reaktionsgeschwindigkeit für einen gasförmigen Prozess liegt: Die Erhöhung des Drucks ist eine direkte und effektive Methode, vorausgesetzt, Sie können die damit verbundenen Temperaturänderungen und technischen Kosten bewältigen.
- Wenn Sie das chemische Gleichgewicht untersuchen: Denken Sie daran, dass der Druck sowohl die Reaktionsgeschwindigkeiten als auch die endgültige Gleichgewichtslage beeinflusst und die Seite mit weniger Gasmolekülen begünstigt.
- Wenn Ihre Reaktion nur Flüssigkeiten oder Feststoffe beinhaltet: Die Änderung des äußeren Drucks ist keine praktikable Strategie zur Steuerung der Reaktionsgeschwindigkeit; konzentrieren Sie sich stattdessen auf Temperatur, Konzentration oder Katalysatoren.
Indem Sie den direkten Zusammenhang zwischen Druck und Konzentration verstehen, erhalten Sie einen mächtigen Hebel zur Steuerung der Kinetik von Gasreaktionen.
Zusammenfassungstabelle:
| Auswirkung des Drucks auf die Reaktionsgeschwindigkeit | Wichtigste Erkenntnis |
|---|---|
| Gasförmige Reaktionen | Erhöht die Geschwindigkeit durch Erhöhung der Konzentration und Kollisionshäufigkeit. |
| Flüssige/feste Reaktionen | Vernachlässigbare Auswirkung; Phasen sind inkompressibel. |
| Reaktionsgleichgewicht | Verschiebt das Gleichgewicht zugunsten der Seite mit weniger Gas-Mol. |
| Industrielle Anwendung | Effektiv, erfordert jedoch robuste Hochdruckreaktorsysteme. |
Benötigen Sie präzise Kontrolle über Ihre Reaktionsbedingungen? KINTEK ist spezialisiert auf Hochdruck-Laborreaktoren und Geräte, die für zuverlässige und sichere Experimente entwickelt wurden. Egal, ob Sie die Reaktionsgeschwindigkeit einer Gasreaktion optimieren oder das chemische Gleichgewicht untersuchen, unsere Lösungen bieten die Leistung und Sicherheit, die Sie benötigen. Kontaktieren Sie noch heute unsere Experten, um das perfekte System für die einzigartigen Herausforderungen Ihres Labors zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Anpassbare Hochdruckreaktoren für fortschrittliche wissenschaftliche und industrielle Anwendungen
- Edelstahl-Hochdruck-Autoklav-Reaktor Labor-Druckreaktor
- Mini-Hochdruck-Autoklavreaktor aus Edelstahl für Laboranwendungen
- Hochdruck-Rohröfen für Laboratorien
- Hochdruck-Laborautoklav-Reaktor für Hydrothermalsynthese
Andere fragen auch
- Was sind die Vorteile eines geschlossenen Reaktorsystems für Iridiumpulver? Maximieren Sie die Rückgewinnung mit Hochdruckausbeuten
- Wie gehen Hochtemperatur-Reaktionssysteme mit Katalysatordeaktivierung bei DRM um? Optimieren Sie jetzt Ihre Methanreformierung
- Wie optimieren belüftete Laboreaktoren die FDCA-Synthese? Maximierung des Sauerstofftransfers und der Reaktionseffizienz
- Warum werden hochpräzise selektive Oxidationsreaktoren für die Wasserstoffreinigung in Protonenaustauschmembran-Brennstoffzellen (PEM-FCs) benötigt?
- Warum ist es notwendig, hochreinen Stickstoff in einen Hochdruckreaktor zu blasen? Gewährleistung der Genauigkeit von Korrosionstests
- Welche Art von Reaktionsumgebung bietet ein Labor-Hochdruckreaktor? Optimierung der Ethanol-Dehydrierung
- Wie trägt ein Hochdruckreaktor (Autoklav) zur Stabilität von Kern-Schale-Katalysatoren bei? Verbesserte Leistung
- Wie optimiert ein HTC-Reaktor Biokraftstoff aus Pilzsubstrat? Steigerung der Energiedichte und Verbrennungseffizienz



















