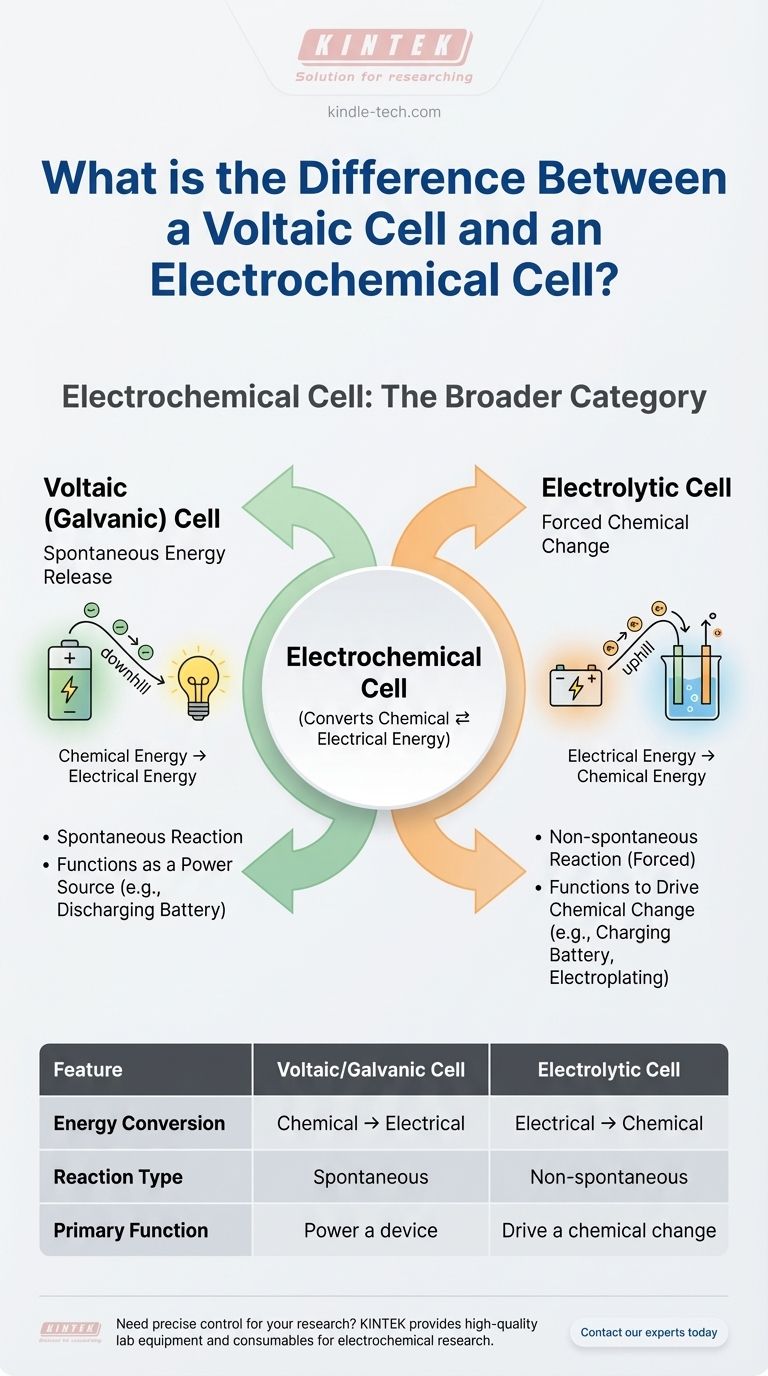
Um es direkt zu sagen: Eine galvanische Zelle unterscheidet sich nicht von einer elektrochemischen Zelle – sie ist eine Art elektrochemischer Zelle. Der Begriff „elektrochemische Zelle“ ist die Oberkategorie für jedes Gerät, das chemische Energie in elektrische Energie oder umgekehrt umwandelt. Eine galvanische Zelle, auch als Volta-Zelle bekannt, ist der spezifische Typ, der spontan Elektrizität aus einer chemischen Reaktion erzeugt.
Das grundlegende Missverständnis entsteht, wenn man diese Begriffe als parallele Optionen behandelt. Stellen Sie sich stattdessen eine Hierarchie vor: „Elektrochemische Zelle“ ist der Familienname, und sie hat zwei Kinder: die galvanische Zelle (die Strom erzeugt) und die Elektrolysezelle (die Strom verbraucht).

Die zwei Wege der Elektrochemie
Eine elektrochemische Zelle ist im Grunde eine Brücke zwischen der chemischen und der elektrischen Welt. Alle solchen Zellen teilen grundlegende Komponenten – zwei Elektroden (eine Anode und eine Kathode) und einen Elektrolyten, der den Ionen die Bewegung zwischen ihnen ermöglicht.
Der entscheidende Unterschied liegt in der Richtung der Energieumwandlung.
Typ 1: Die galvanische (Volta-)Zelle – Spontane Energiefreisetzung
Eine galvanische Zelle nutzt eine spontane chemische Reaktion, um elektrische Energie zu erzeugen.
Stellen Sie es sich wie eine kontrollierte Rutschpartie vor. Die Chemikalien sind energetisch von Natur aus „bergab“, und die galvanische Zelle bietet einen Weg, diese Energie als nützlichen elektrischen Strom freizusetzen.
Dies ist das Prinzip einer gewöhnlichen Batterie. Die chemischen Reaktionen in einer AA-Batterie wollen von selbst ablaufen, und wenn Sie den Stromkreis schließen, leitet die Zelle den resultierenden Elektronenfluss, um Ihr Gerät mit Strom zu versorgen.
Typ 2: Die Elektrolysezelle – Erzwingung chemischer Veränderungen
Eine Elektrolysezelle tut genau das Gegenteil. Sie verwendet eine externe elektrische Energiequelle, um eine chemische Reaktion zu erzwingen, die nicht von selbst ablaufen würde.
Dies ist der „bergauf“ führende Weg. Sie führen Energie in das System ein, um einen weniger stabilen chemischen Zustand zu erzeugen.
Klassische Beispiele sind die Verwendung von Elektrizität für die Elektrolyse (wie die Spaltung von Wasser in Wasserstoff und Sauerstoff) oder das Aufladen einer Batterie. Wenn Sie Ihr Telefon aufladen, betreiben Sie dessen Batterie als Elektrolysezelle und kehren die chemischen Reaktionen um, die stattfanden, als sie Ihr Gerät mit Strom versorgte.
Die kritischen Unterschiede verstehen
Die Unterscheidung zwischen diesen beiden Zelltypen ist das wichtigste Konzept in der grundlegenden Elektrochemie. Die Richtung des Energieflusses bestimmt die gesamte Funktion der Zelle.
Energieumwandlung
Eine galvanische Zelle wandelt chemische Energie in elektrische Energie um. Sie ist eine Energiequelle.
Eine Elektrolysezelle wandelt elektrische Energie in chemische Energie um. Sie ist ein Energieverbraucher.
Reaktionsspontanität
Die Redoxreaktion in einer galvanischen Zelle ist spontan. Sie läuft ohne äußeres Zutun ab, sobald der Stromkreis geschlossen ist.
Die Redoxreaktion in einer Elektrolysezelle ist nicht spontan. Sie erfordert eine externe Stromversorgung (wie eine Batterie oder eine Gleichstromquelle), um abzulaufen.
Praktische Funktion
Die Funktion einer galvanischen Zelle ist es, etwas mit Strom zu versorgen. Denken Sie an jede Standard-, nicht wiederaufladbare Batterie.
Die Funktion einer Elektrolysezelle ist es, eine chemische Veränderung hervorzurufen. Denken Sie an die Galvanisierung von Metall oder das Aufladen einer wiederaufladbaren Batterie.
So klassifizieren Sie Ihre Zelle richtig
Um dieses Wissen anzuwenden, fragen Sie einfach, ob die Zelle Strom erzeugt oder verbraucht, um eine Reaktion anzutreiben.
- Wenn Ihr Hauptaugenmerk darauf liegt, ein Gerät zu beschreiben, das chemische und elektrische Energie ineinander umwandelt: Verwenden Sie den Oberbegriff elektrochemische Zelle.
- Wenn Sie speziell eine Batterie beschreiben, die entladen wird, um ein Gerät mit Strom zu versorgen: Verwenden Sie die spezifischen Begriffe galvanische Zelle oder Volta-Zelle.
- Wenn Sie speziell einen Prozess beschreiben, der Elektrizität verwendet, um eine Reaktion zu erzwingen (wie das Aufladen einer Batterie oder Elektrolyse): Verwenden Sie den spezifischen Begriff Elektrolysezelle.
Durch das Verständnis dieser einfachen Klassifizierung können Sie jeden elektrochemischen Prozess präzise und klar beschreiben.
Zusammenfassungstabelle:
| Merkmal | Galvanische/Volta-Zelle | Elektrolysezelle |
|---|---|---|
| Energieumwandlung | Chemisch → Elektrisch | Elektrisch → Chemisch |
| Reaktionstyp | Spontan | Nicht-spontan (Erzwungen) |
| Hauptfunktion | Gerät mit Strom versorgen (z. B. Batterie) | Chemische Veränderung bewirken (z. B. Galvanisierung) |
Benötigen Sie präzise Kontrolle über Ihre elektrochemischen Prozesse? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien für all Ihre elektrochemischen Forschungs- und Entwicklungsbedürfnisse. Egal, ob Sie mit galvanischen Zellen, Elektrolysezellen oder anderen Laboranwendungen arbeiten, unsere Lösungen gewährleisten Genauigkeit und Zuverlässigkeit. Kontaktieren Sie noch heute unsere Experten, um die perfekte Ausrüstung für Ihr Labor zu finden!
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Warum ist es wichtig, Kurzschlüsse an den Elektroden in einer Elektrolysezelle zu vermeiden? Katastrophales Geräteversagen verhindern
- Wie erleichtert eine Leitfähigkeitsprüfzelle mit Kupferelektroden und PTFE-Ringen die Charakterisierung von fluorierten Kohlenstoffaerogelen?
- Aus welchen Materialien bestehen der H-Typ-Elektrolysezelle und ihr Deckel? Ein Leitfaden zur chemischen Inertheit & Stabilität
- Was sind die Anforderungen an Membranen für SO2-depolarisierte Elektrolyseure? Optimierung der Leistung in hybriden Schwefelkreisläufen
- Welche Rolle spielen poröse Zirkonoxidkeramiken in einer elektrochemischen Zelle mit überkritischem Fluid? Gewährleistung der Datenintegrität.
- Was sind die Hauptfunktionen einer spezialisierten Elektrogewinnungszelle? Optimierung der Goldrückgewinnung und -reinheit
- Warum ist der präzise galvanostatische Modus für Gleichstromversorgungen bei elektrochemischen Abwasserbehandlungsexperimenten erforderlich?
- Warum wird ein elektrochemisches Potentiostat für EQCMD benötigt? Erkenntnisse über Leitfähigkeit und Kristallisation gewinnen



















