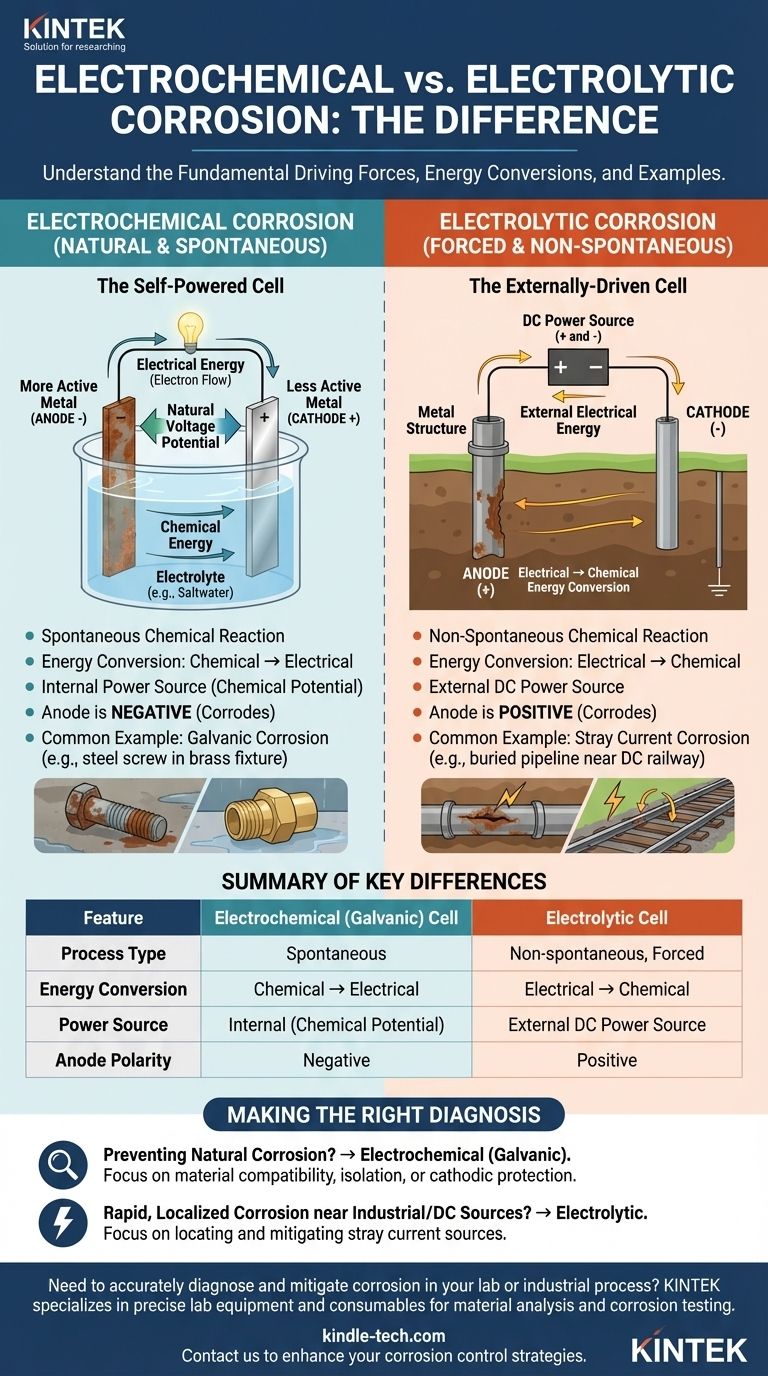
Auf einer fundamentalen Ebene liegt der Unterschied zwischen einer elektrolytischen und einer elektrochemischen Korrosionszelle in ihrer Energieumwandlung und treibenden Kraft. Eine elektrochemische Zelle ist ein spontaner Prozess, der gespeicherte chemische Energie in elektrische Energie umwandelt und so natürliche Korrosion verursacht. Im Gegensatz dazu ist eine elektrolytische Zelle ein nicht-spontaner Prozess, der externe elektrische Energie nutzt, um eine chemische Reaktion zu erzwingen und so induzierte Korrosion verursacht.
Die zentrale Unterscheidung ist die Spontaneität. Elektrochemische Korrosion tritt von selbst auf natürliche Weise auf, wie eine sich entladende Batterie. Elektrolytische Korrosion wird einem Material durch eine externe Stromquelle aufgezwungen, wie z.B. Streustrom von einem Gleichstrom-Schienensystem.

Die elektrochemische Zelle: Der natürliche Zustand der Korrosion
Eine elektrochemische Zelle, oft auch galvanische Zelle genannt, ist der Mechanismus hinter den häufigsten Korrosionsformen. Es ist ein in sich geschlossener, natürlich ablaufender Prozess.
Eine spontane chemische Reaktion
Dieser Zelltyp bildet sich, wenn zwei verschiedene Metalle in elektrischem Kontakt in Gegenwart eines Elektrolyten (wie Salzwasser) stehen. Zwischen ihnen besteht ein natürliches Spannungspotenzial.
Das chemisch aktivere Metall wird zur Anode (negative Elektrode) und korrodiert, wobei es Elektronen freisetzt. Das weniger aktive Metall wird zur Kathode (positive Elektrode) und nimmt diese Elektronen auf.
Energieumwandlung: Chemisch zu elektrisch
Die treibende Kraft ist die Freisetzung gespeicherter chemischer Energie innerhalb des aktiveren Metalls. Diese chemische Energie wird direkt in elektrische Energie in Form eines Elektronenflusses von der Anode zur Kathode umgewandelt. Dieser Prozess erfordert keine externe Stromversorgung.
Ein klassisches Beispiel ist die galvanische Korrosion, bei der eine Stahlschraube (Anode) schnell rostet, wenn sie in feuchter Umgebung mit einem Messingbeschlag (Kathode) verbunden ist.
Die elektrolytische Zelle: Korrosion durch Zwang
Eine elektrolytische Zelle treibt eine chemische Reaktion an, die normalerweise nicht ablaufen würde. Dies geschieht durch Anlegen einer externen elektrischen Stromquelle.
Eine nicht-spontane chemische Reaktion
Dieser Prozess überwindet die natürlichen Tendenzen der beteiligten Materialien. Die externe Stromquelle zwingt ein Metall, zu einer Anode zu werden und zu korrodieren, selbst wenn es sonst stabil wäre.
Korrosion tritt dort auf, wo dieser extern zugeführte Gleichstrom (DC) die Metallstruktur verlässt, um in einen Elektrolyten einzudringen.
Energieumwandlung: Elektrisch zu chemisch
Hier wird elektrische Energie aus einer externen Quelle in chemische Energie umgewandelt, die sich als Korrosionsreaktion manifestiert. Die Zelle verbraucht Strom, um zu funktionieren.
Ein häufiges reales Szenario ist die Streustromkorrosion. Eine vergrabene Rohrleitung, die in der Nähe einer Gleichstrom-betriebenen Eisenbahn verläuft, kann Leckstrom aufnehmen, wodurch der Abschnitt der Rohrleitung, an dem der Strom zurück in den Boden austritt, beschleunigt korrodiert.
Die wichtigsten Unterschiede verstehen
Obwohl beide Prozesse Anoden, Kathoden und einen Elektrolyten beinhalten, sind ihre fundamentalen Eigenschaften entgegengesetzt. Das Erkennen dieser Unterschiede ist entscheidend für eine korrekte Diagnose und Minderung.
Treibende Kraft und Stromquelle
Die wichtigste Unterscheidung ist die treibende Kraft. Eine elektrochemische Zelle ist selbstversorgend durch die chemische Potenzialdifferenz zwischen den Materialien. Eine elektrolytische Zelle wird extern versorgt durch eine externe Gleichstromquelle.
Polarität der Elektroden
Die Polarität von Anode und Kathode ist zwischen den beiden Zellen vertauscht, ein häufiger Punkt der Verwirrung.
- In einer elektrochemischen (galvanischen) Zelle ist die Anode (wo Korrosion auftritt) negativ, und die Kathode ist positiv.
- In einer elektrolytischen Zelle macht die externe Stromquelle die Anode (wo Korrosion auftritt) positiv, und die Kathode ist negativ.
Praktische Auswirkungen
Eine falsche Identifizierung des Korrosionszellentyps führt zu falschen Lösungen. Zum Beispiel könnte das Ändern von Materialpaaren ein Problem der galvanischen Korrosion lösen, aber nichts gegen Streustromkorrosion ausrichten.
Die richtige Diagnose stellen
Das Verständnis des zugrunde liegenden Mechanismus ist der erste Schritt zu einer effektiven Korrosionskontrolle. Ihr Diagnoseansatz sollte sich am vermuteten Zelltyp orientieren.
- Wenn Ihr Hauptaugenmerk auf der Verhinderung natürlicher Korrosion liegt: Sie haben es wahrscheinlich mit einer elektrochemischen (galvanischen) Zelle zu tun. Ihre Lösung umfasst die Auswahl kompatibler Materialien, deren elektrische Isolierung oder die Anwendung von kathodischem Schutz.
- Wenn Sie schnelle, lokalisierte Korrosion in der Nähe von Industrieanlagen oder Gleichstrom-Transitsystemen untersuchen: Sie haben es mit ziemlicher Sicherheit mit einer elektrolytischen Zelle zu tun. Ihre Priorität muss es sein, die Quelle des externen Streustroms zu lokalisieren und zu mindern.
Letztendlich bestimmt das Wissen, ob die Korrosion natürlich auftritt oder durch einen externen Einfluss erzwungen wird, Ihre gesamte Präventions- und Kontrollstrategie.
Zusammenfassungstabelle:
| Merkmal | Elektrochemische (galvanische) Zelle | Elektrolytische Zelle |
|---|---|---|
| Prozesstyp | Spontan | Nicht-spontan, erzwungen |
| Energieumwandlung | Chemisch → Elektrisch | Elektrisch → Chemisch |
| Stromquelle | Intern (Chemisches Potenzial) | Externe Gleichstromquelle |
| Anodenpolarität | Negativ | Positiv |
| Häufiges Beispiel | Galvanische Korrosion (z.B. Stahl/Messing) | Streustromkorrosion (z.B. von Eisenbahnen) |
Müssen Sie Korrosion in Ihrem Labor oder Industrieprozess genau diagnostizieren und mindern?
Das Verständnis des genauen Korrosionszellentyps ist der erste Schritt zu einer effektiven Lösung. Die Experten von KINTEK sind spezialisiert auf die Bereitstellung der präzisen Laborausrüstung und Verbrauchsmaterialien, die für die Materialanalyse und Korrosionsprüfung benötigt werden. Egal, ob Sie galvanische Reaktionen oder Streustromeffekte untersuchen, wir haben die Werkzeuge, um Ihre Forschung zu unterstützen und die Materialintegrität zu gewährleisten.
Kontaktieren Sie uns noch heute über unser Kontaktformular, um Ihre spezifischen Laboranforderungen zu besprechen und zu entdecken, wie KINTEKs Lösungen Ihre Korrosionsschutzstrategien verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Flache Korrosions-Elektrolysezelle
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Welche Vorsichtsmaßnahmen sollten bei der Temperaturregelung einer Fünf-Port-Wasserbad-Elektrolysezelle getroffen werden? Gewährleistung sicherer und präziser elektrochemischer Experimente
- Warum muss eine Elektrolysezelle mit einer Rührvorrichtung ausgestattet sein? Erzielung gleichmäßiger Verbundbeschichtungen auf Nickelbasis
- Welche Rolle spielt ein Glasreaktor bei der alkalischen Wasserelektrolyse? Gewährleistung von Sicherheit und visueller Präzision
- Warum müssen PEC-Reaktorfenster eine hohe mechanische Festigkeit aufweisen? Gewährleistung von Sicherheit und Integrität bei der Umwandlung von Solarenergie
- Wie sollten die experimentellen Parameter bei der Verwendung der H-Typ-Elektrolysezelle angepasst werden? Experte Präzisionsleitfaden
- Was ist die Funktion einer Zwei-Elektroden-Elektrolysezelle in EPD? Verbesserung der Präzision von Keramikbeschichtungen
- Wie lauten die standardmäßigen Öffnungsspezifikationen für eine austauschbare Membran-Elektrolysezelle vom H-Typ? Asymmetrische Anschlüsse für präzise Elektrochemie
- Wie lauten die Verfahren nach der Verwendung einer doppelschichtigen Wasserbad-Elektrolysezelle? Gewährleistung der Langlebigkeit der Geräte und der Daten-Genauigkeit



















