Historische Entdeckungen in der Elektrochemie
Galvanis Frosch-Experiment
Im Jahr 1791 führte der italienische Wissenschaftler Luigi Galvani ein bahnbrechendes Experiment durch, das Biologie und Elektrochemie für immer miteinander verbinden sollte. Bei der Sezierung eines Froschschenkels bemerkte Galvani, dass das Bein zuckte, wenn es mit zwei verschiedenen Metallen in Berührung kam. Diese scheinbar einfache Beobachtung führte zu einer tief greifenden Erkenntnis: Biologisches Gewebe kann elektrische Signale erzeugen und auf diese reagieren.
Diese Entdeckung war nicht nur eine akademische Kuriosität, sondern hatte auch praktische Auswirkungen. Das von Galvani beobachtete Phänomen wurde später "galvanische Wirkung" genannt und bildete die Grundlage für die Entwicklung von Geräten wie dem Galvanometer, einem Instrument zur Messung kleiner elektrischer Ströme. Darüber hinaus wurde der Prozess der Galvanisierung - die Beschichtung von Metallen zum Schutz vor Korrosion - nach ihm benannt, was die nachhaltige Wirkung seiner Arbeit unterstreicht.
Galvanis Experiment war ein entscheidender Moment in der Geschichte der Wissenschaft, da es die Kluft zwischen den Biowissenschaften und den physikalischen Wissenschaften überbrückte. Es zeigte, dass biologische Systeme durch die Brille elektrochemischer Prinzipien verstanden werden können, und ebnete den Weg für künftige Fortschritte in beiden Bereichen.
Voltas Erfindung der Voltaischen Säule
Im Jahr 1799 machte der italienische Physiker Alessandro Volta eine bahnbrechende Entdeckung, die den Grundstein für moderne elektrochemische Systeme legte. Er erfand die erste chemische Stromquelle, den so genannten Voltastapel, der im Wesentlichen aus einem Stapel von Kupfer- und Zinkscheiben bestand, die durch ein feuchtes, in Salzlake getränktes Tuch oder einen Karton voneinander getrennt waren. Dieses einfache, aber geniale Gerät konnte einen gleichmäßigen elektrischen Strom erzeugen und markierte den Beginn der praktischen Stromerzeugung.
Die Bedeutung von Voltas Erfindung wurde schnell erkannt und gab den Anstoß zu weiteren Forschungen über die möglichen Anwendungen dieser neu entdeckten Energiequelle. Nur ein Jahr später, im Jahr 1800, benutzten William Nicholson und Anthony Carlisle einen Voltaischen Pfahl, um die erste erfolgreiche Elektrolyse von Wasser durchzuführen. Bei diesem Experiment beobachteten sie die Ausscheidung von Gasen, insbesondere von Wasserstoff und Sauerstoff, was die Zersetzung von Wassermolekülen in ihre Bestandteile unter dem Einfluss von elektrischem Strom bestätigte.
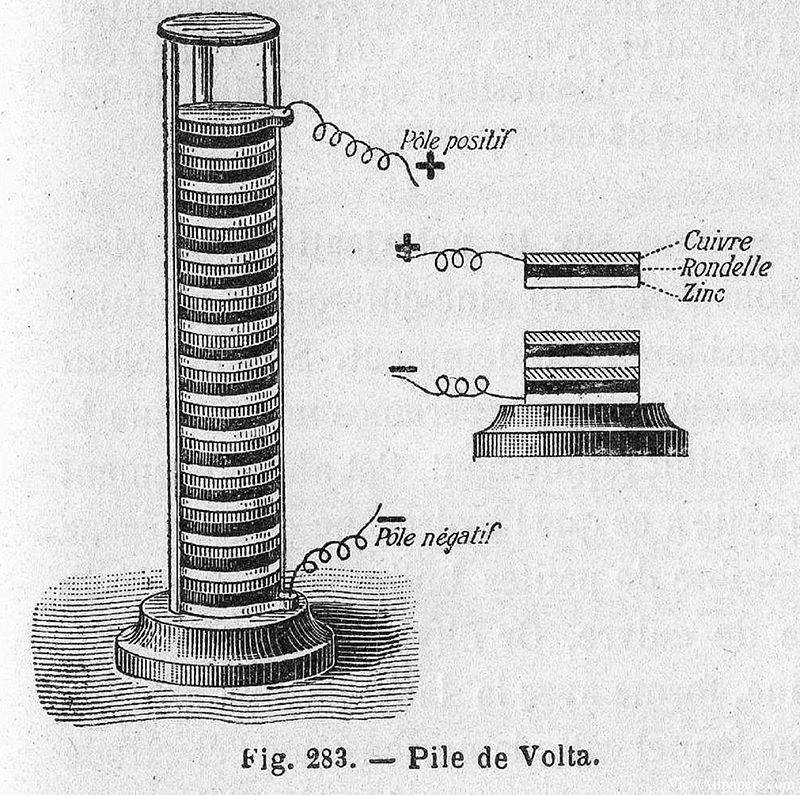
Diese Entdeckung bestätigte nicht nur das Konzept der Elektrolyse, sondern demonstrierte auch den praktischen Nutzen von Voltas Pfahl für wissenschaftliche Experimente. Die Fähigkeit, Verbindungen mit Hilfe von Elektrizität in ihre elementaren Bestandteile zu zerlegen, eröffnete neue Wege für die Forschung in Chemie und Physik und ebnete den Weg für künftige Fortschritte in der elektrochemischen Theorie und Anwendung.
Erfolge der Elektrolyse
Im Jahr 1803 gelang Humphry Davy ein bahnbrechender Erfolg auf dem Gebiet der Elektrochemie, indem er die Metalle Kalium und Natrium durch den Prozess der Elektrolyse erfolgreich isolierte. Diese monumentale Entdeckung demonstrierte nicht nur die Leistungsfähigkeit elektrochemischer Methoden, sondern ebnete auch den Weg für die Herstellung aktiver Metallmonomere, die für verschiedene industrielle Anwendungen unerlässlich sind.
Bei seinen Experimenten benutzte Davy einen Voltastapel, die erste von Alessandro Volta erfundene chemische Energiequelle. Indem er einen elektrischen Strom durch geschmolzene Salze leitete, konnte Davy diese Verbindungen zersetzen und reine Metalle gewinnen. Diese Technik bedeutete einen bedeutenden Fortschritt bei der Gewinnung reaktiver Metalle, die mit herkömmlichen chemischen Methoden nur schwer zu isolieren waren.
Die Auswirkungen von Davys Arbeit gingen über das Labor hinaus. Sein Erfolg bei der Elektrolyse legte den Grundstein für künftige Forschungen auf dem Gebiet der elektrochemischen Verfahren, die zur Entwicklung effizienterer Methoden zur Metallgewinnung und -reinigung führten. Diese Entdeckung verdeutlichte auch das Potenzial elektrochemischer Verfahren in verschiedenen Industriezweigen, von der Metallurgie bis zur chemischen Produktion.
Darüber hinaus trugen Davys Entdeckungen zu einem breiteren Verständnis der elektrochemischen Prinzipien bei und bildeten die Grundlage für spätere theoretische Fortschritte wie das Faradaysche Elektrolysegesetz und die Nernstsche Gleichung. Diese theoretischen Grundlagen wiederum ermöglichten präzisere quantitative Studien elektrochemischer Phänomene und brachten das Fachgebiet weiter voran.
Zusammenfassend lässt sich sagen, dass Davys erfolgreiche Elektrolyse von Kalium und Natrium im Jahr 1803 ein entscheidender Moment in der Geschichte der Elektrochemie war, der die praktische Anwendung elektrochemischer Methoden demonstrierte und den Grundstein für zukünftige Innovationen auf diesem Gebiet legte.
Theoretische Grundlagen der Elektrochemie
Das Faradaysche Gesetz der Elektrolyse
Im Jahr 1834 formulierte Michael Faraday, ein bahnbrechender Physiker und Chemiker, das Gesetz der Elektrolyse, einen Eckpfeiler der Elektrochemie. Dieses Gesetz lieferte einen quantitativen Rahmen für das Verständnis und die Analyse elektrochemischer Phänomene und brachte die theoretischen Grundlagen der Disziplin erheblich voran. Faradays Arbeit trug entscheidend dazu bei, die Kluft zwischen empirischen Beobachtungen und theoretischen Modellen zu überbrücken, und legte damit den Grundstein für zukünftige Entdeckungen und Anwendungen in der Elektrochemie.
Das Faraday'sche Elektrolysegesetz besteht aus zwei Grundprinzipien:
- Erstes Gesetz: Die Masse einer Substanz, die sich während der Elektrolyse an einer Elektrode ablagert oder freigesetzt wird, ist direkt proportional zu der Menge an Elektrizität, die durch den Elektrolyten fließt.
- Zweites Gesetz: Die Masse einer Substanz, die bei der Elektrolyse an einer Elektrode abgeschieden oder freigesetzt wird, ist direkt proportional zum chemischen Äquivalentgewicht der Substanz.
Diese Gesetze ermöglichten es den Wissenschaftlern, die Menge des während einer elektrochemischen Reaktion umgewandelten Materials genau zu messen, was die Entwicklung standardisierter Verfahren und Techniken in der Elektrochemie erleichterte. Durch die Quantifizierung der Beziehung zwischen elektrischem Strom, Zeit und den daraus resultierenden chemischen Veränderungen boten die Faradayschen Gesetze eine robuste Methode zur Untersuchung und Vorhersage elektrochemischer Prozesse.
Die Wirkung von Faradays Arbeit ging über die reine Quantifizierung hinaus. Seine Gesetze förderten ein tieferes Verständnis der der Elektrolyse zugrunde liegenden Mechanismen, was wiederum zu Fortschritten bei verschiedenen praktischen Anwendungen führte. Diese Anwendungen reichten von industriellen Prozessen wie der Metallraffination und der Galvanotechnik bis hin zur Entwicklung von Batterien und Brennstoffzellen, die für moderne Energiesysteme unverzichtbar sind.
Darüber hinaus schuf Faraday mit seinen Beiträgen die Grundlage für spätere theoretische Entwicklungen in der Elektrochemie. Seine Gesetze bildeten die Grundlage für die Arbeit späterer Wissenschaftler wie Walther Nernst, der die Nernst-Gleichung ableitete, und Julius Tafel, der die Tafel-Gleichung formulierte. Diese Fortschritte verfeinerten das Verständnis der Elektrodenpotentiale, der Reaktionskinetik und des Verhaltens von Ionen in Lösung, die allesamt entscheidende Aspekte der modernen elektrochemischen Forschung darstellen.
Zusammenfassend lässt sich sagen, dass Faradays Elektrolysegesetz nicht nur die quantitative Untersuchung elektrochemischer Phänomene revolutionierte, sondern auch eine solide theoretische Grundlage für das aufkeimende Gebiet der Elektrochemie schuf. Seine Arbeit beeinflusst und inspiriert auch heute noch die Forschung und Anwendungen und unterstreicht damit die bleibende Bedeutung seiner Beiträge zur Wissenschaft.
Nernsts Gleichung
1889 leistete der deutsche Chemiker Walther Nernst einen bahnbrechenden Beitrag zur Elektrochemie, indem er eine mathematische Beziehung herleitete, die das Elektrodenpotenzial mit der Konzentration der an der elektrochemischen Reaktion beteiligten Stoffe verknüpfte. Diese Beziehung, die heute als Nernst-Gleichung bekannt ist, hat sich zu einem Eckpfeiler bei der Untersuchung elektrochemischer Systeme entwickelt.
Die Nernst-Gleichung bietet ein quantitatives Mittel zur Vorhersage des Potenzials einer elektrochemischen Zelle unter nicht standardisierten Bedingungen, was für das Verständnis und die Kontrolle elektrochemischer Prozesse von entscheidender Bedeutung ist. Sie wird ausgedrückt als:
[ E = E^\circ - \frac{RT}{nF} \ln Q ]
wobei:
- ( E ) ist das Elektrodenpotential.
- ( E^\circ ) ist das Standardelektrodenpotential.
- ( R ) ist die universelle Gaskonstante.
- ( T ) ist die Temperatur in Kelvin.
- ( n ) ist die Anzahl der bei der Reaktion übertragenen Elektronenmoleküle.
- ( F ) ist die Faraday-Konstante.
- ( Q ) ist der Reaktionsquotient.
Die Gleichung veranschaulicht, wie Konzentrationsänderungen das Potenzial einer Elektrode beeinflussen können, was für Anwendungen von der Batterieentwicklung bis hin zu industriellen Elektrolyseprozessen von entscheidender Bedeutung ist. Da die Nernst-Gleichung es Wissenschaftlern ermöglicht, Elektrodenpotenziale vorherzusagen und zu manipulieren, hat sie unsere Möglichkeiten zur Entwicklung und Optimierung elektrochemischer Systeme erheblich verbessert.
Diese Entdeckung war nicht nur ein theoretischer, sondern auch ein praktischer Triumph, da sie Wissenschaftlern und Ingenieuren ein Werkzeug an die Hand gab, mit dem sie das Verhalten elektrochemischer Zellen unter verschiedenen Bedingungen besser verstehen und steuern können. Die Nernst-Gleichung ist nach wie vor ein unverzichtbarer Bestandteil der elektrochemischen Theorie und Praxis und verdeutlicht den tiefgreifenden Einfluss von Nernsts Arbeit auf das Fachgebiet.
Tafelsche Gleichung
Im Jahr 1905 stellte Julius Tafel eine bahnbrechende empirische Formel vor, die eine direkte Beziehung zwischen Stromdichte und Wasserstoffüberspannung herstellte. Diese Gleichung, die als Tafel-Gleichung bekannt ist, spielte eine entscheidende Rolle bei der Entwicklung unseres Verständnisses der elektrochemischen Kinetik. Tafels Arbeit trug entscheidend zur Aufklärung der Mechanismen bei, die der Geschwindigkeit elektrochemischer Reaktionen zugrunde liegen, insbesondere derjenigen, bei denen Wasserstoff entsteht.
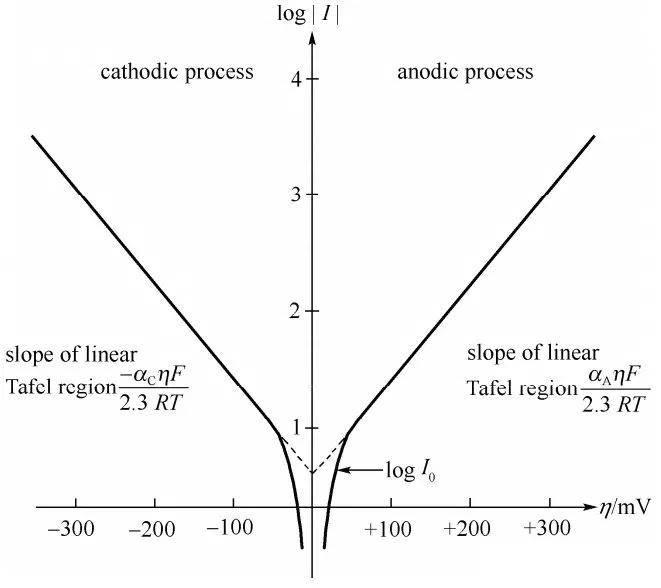
Die Tafel-Gleichung wird üblicherweise wie folgt ausgedrückt:
$$ \eta = a + b \log(i) $$
wobei:
- (\eta) die Überspannung ist,
- (i) die Stromdichte ist,
- (a) und (b) sind Konstanten, die für das Elektrodenmaterial und die Reaktionsbedingungen spezifisch sind.
Die Bedeutung der Tafelschen Gleichung liegt in ihrer Fähigkeit, die Geschwindigkeit elektrochemischer Prozesse quantitativ zu beschreiben, was für die Optimierung von Elektrodenmaterialien und Reaktionsbedingungen von entscheidender Bedeutung ist. Dieses empirische Gesetz wurde umfassend validiert und in verschiedenen elektrochemischen Systemen angewandt, von der Grundlagenforschung bis zu industriellen Anwendungen.
| Parameter | Beschreibung |
|---|---|
| (\eta) | Überspannung, die über das Gleichgewichtspotenzial hinaus erforderliche zusätzliche Spannung |
| (i) | Stromdichte, der Strom pro Flächeneinheit der Elektrodenoberfläche |
| (a) | Konstante, die mit der Austauschstromdichte und dem Symmetriefaktor zusammenhängt |
| (b) | Tafel-Steilheit, bezogen auf den Ladungstransferkoeffizienten |
Tafels Pionierarbeit legte den Grundstein für die nachfolgende Forschung im Bereich der elektrochemischen Kinetik und beeinflusste die Entwicklung anspruchsvollerer Theorien und Techniken. Seine Gleichung ist nach wie vor ein Eckpfeiler des Fachgebiets und verdeutlicht das komplizierte Zusammenspiel zwischen elektrischen und chemischen Prozessen in der Elektrochemie.
Elektrochemische Kinetik und Techniken
Ab 1940 wurden auf dem Gebiet der Grenzflächenelektrochemie bedeutende Fortschritte erzielt, insbesondere im Hinblick auf das Verständnis der Struktur der Doppelschicht und der Kinetik der Wasserstoffausscheidung. Diese Entwicklungen legten den Grundstein für anspruchsvollere Theorien und Techniken in der elektrochemischen Kinetik. Einer der bemerkenswertesten Beiträge dieser Periode war die Aufstellung der mikroskopischen Theorie des Elektronentransfers von Marcus. Diese Theorie lieferte einen detaillierten Rahmen für das Verständnis, wie sich Elektronen über Grenzflächen bewegen, was für viele elektrochemische Prozesse entscheidend ist.
Die Fortschritte in der elektrochemischen Kinetik beschränkten sich nicht auf theoretische Konstrukte. Es wurden auch experimentelle Techniken entwickelt, die es den Forschern ermöglichten, das Verhalten von Elektronen und Ionen an Grenzflächen mit größerer Präzision zu untersuchen. So ermöglichte die Entwicklung neuer spektroskopischer Methoden die Echtzeitbeobachtung chemischer Reaktionen, die an Elektrodenoberflächen ablaufen. Diese Techniken haben entscheidend dazu beigetragen, theoretische Modelle wie die Theorie von Marcus zu validieren und zu verfeinern, da sie empirische Daten liefern, die direkt mit theoretischen Vorhersagen verglichen werden können.
Darüber hinaus hat das Zusammenspiel von theoretischen und experimentellen Fortschritten zur Entwicklung effizienterer elektrochemischer Systeme geführt. So wurde beispielsweise das Verständnis der Kinetik der Wasserstoffausscheidung für die Entwicklung besserer Brennstoffzellen und Batterien genutzt, die für moderne Energiespeicher- und -umwandlungstechnologien unerlässlich sind. Diese Systeme profitieren von der verbesserten Kinetik, die zu einem höheren Wirkungsgrad und einer längeren Betriebsdauer führt.
Zusammenfassend lässt sich sagen, dass die Zeit ab 1940 eine transformative Ära in der elektrochemischen Kinetik und Technik darstellt. Die Synergie zwischen theoretischen Erkenntnissen und experimentellen Möglichkeiten hat nicht nur unser Verständnis grundlegender Prozesse vertieft, sondern auch den Weg für praktische Anwendungen in der Energie- und Materialwissenschaft geebnet.
Elektrochemische In-situ-Techniken
Seit ihren Anfängen in den 1970er Jahren haben elektrochemische In-situ-Techniken die Erforschung elektrochemischer Mechanismen revolutioniert. Diese Techniken ermöglichen es den Forschern, elektrochemische Prozesse direkt in ihrer Betriebsumgebung zu beobachten und zu analysieren, was einen unvergleichlichen Einblick in die Dynamik von Reaktionen an der Elektroden-Elektrolyt-Grenzfläche ermöglicht.
Einer der wichtigsten Fortschritte auf diesem Gebiet ist die Integration der elektrochemischen In-situ-Röntgenabsorptionsspektroskopie (XAS). Diese Methode ermöglicht die Echtzeitüberwachung von Änderungen der elektronischen Struktur und der Oxidationszustände von Materialien während elektrochemischer Reaktionen. Durch die Kombination von XAS mit elektrochemischen Techniken können Wissenschaftler strukturelle Veränderungen mit der elektrochemischen Leistung korrelieren und so unser Verständnis von katalytischen Prozessen und Elektrodenmaterialien vertiefen.
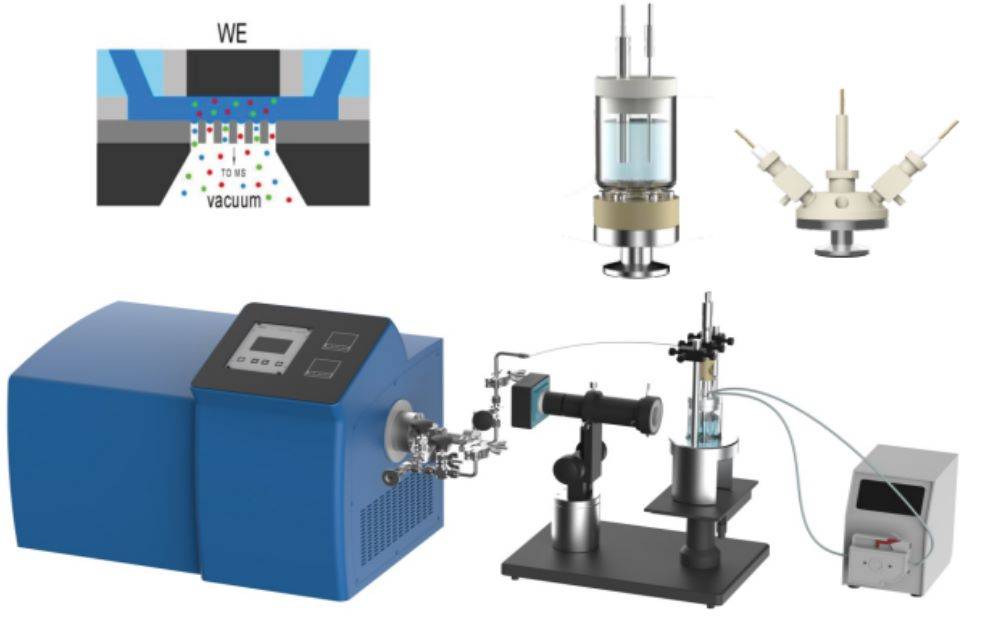
Neben der XAS haben auch andere In-situ-Techniken wie die elektrochemische Rastermikroskopie (SECM) und die In-situ-Raman-Spektroskopie an Bedeutung gewonnen. SECM ermöglicht die räumliche Auflösung elektrochemischer Prozesse im Mikrometerbereich, während die In-situ-Raman-Spektroskopie detaillierte Schwingungsinformationen über die an den Reaktionen beteiligten Spezies liefert.
Die Vielseitigkeit und Präzision der elektrochemischen In-situ-Techniken haben nicht nur die Grundlagenforschung verbessert, sondern auch die Entwicklung praktischer Anwendungen beschleunigt. So sind diese Techniken beispielsweise von entscheidender Bedeutung für die Optimierung der Leistung von Batterien, Brennstoffzellen und Elektrokatalysatoren. Durch die Bereitstellung von Echtzeitdaten über Reaktionszwischenprodukte und Oberflächenveränderungen helfen In-situ-Methoden bei der Entwicklung effizienterer und haltbarerer elektrochemischer Geräte.
Darüber hinaus erweitert die kontinuierliche Weiterentwicklung dieser Techniken ihre Anwendungsmöglichkeiten. Fortschritte bei der Instrumentierung und den Datenanalysemethoden ermöglichen eine höhere Auflösung, eine schnellere Datenerfassung und eine genauere Interpretation der Ergebnisse. Diese Fortschritte ebnen den Weg für die nächste Generation der elektrochemischen Forschung, in der In-situ-Techniken eine zentrale Rolle bei der Entschlüsselung der Komplexität elektrochemischer Systeme spielen werden.
Moderne Wege in der Elektrochemie
Mikroskopische elektrochemische Mechanismen
Die Erforschung elektrochemischer Prozesse auf atomarer und molekularer Ebene ist ein Schwerpunkt der heutigen Forschung. In diesem Bereich werden vor allem folgende Methoden angewandt in situ und Nicht-in-situ Techniken, um die komplizierten Mechanismen, die diese Prozesse steuern, zu entschlüsseln. Diese Techniken ermöglichen es den Forschern, elektrochemische Reaktionen zu beobachten und zu analysieren, während sie ablaufen, und geben so einen noch nie dagewesenen Einblick in die Dynamik der Prozesse.
Einer der wichtigsten Fortschritte in diesem Bereich ist die Verwendung von elektrochemische In-situ-Röntgenabsorptionsspektroskopie (XAS) . Diese Methode ermöglicht die Echtzeitüberwachung von Änderungen der elektronischen Struktur und der Oxidationszustände von Materialien während elektrochemischer Reaktionen. So kann die XAS beispielsweise aufzeigen, wie sich die Oberfläche eines Katalysators während der Katalyse einer bestimmten Reaktion verändert, was Hinweise auf die Optimierung des Katalysators für eine bessere Leistung liefert.
Zusätzlich, Rastertunnelmikroskopie (STM) und Atomkraftmikroskopie (AFM) dazu beigetragen, die Oberflächenmorphologie und die elektronischen Eigenschaften von Elektroden auf atomarer Ebene sichtbar zu machen. Diese Techniken haben entscheidend dazu beigetragen zu verstehen, wie Oberflächendefekte, Adsorbate und andere mikroskopische Merkmale das elektrochemische Verhalten von Materialien beeinflussen.
Um einen umfassenden und rationalen Reaktionsmechanismus zu konstruieren, kombinieren Forscher diese mikroskopischen Beobachtungen oft mit theoretischen Modellen. Zum Beispiel Dichtefunktionaltheorie (DFT) Berechnungen können beispielsweise die Energielandschaften potenzieller Reaktionswege vorhersagen, während Molekulardynamik (MD) Simulationen können das zeitabhängige Verhalten von Ionen und Molekülen im Elektrolyten modellieren.
Die Integration von experimentellen und theoretischen Ansätzen hat zu bedeutenden Durchbrüchen in diesem Bereich geführt. So wurde beispielsweise die rationelle Entwicklung von Elektrokatalysatoren für die Wasserspaltung und die CO₂-Reduktion durch Erkenntnisse aus diesen kombinierten Bemühungen geleitet. Solche Fortschritte verbessern nicht nur unser grundlegendes Verständnis elektrochemischer Prozesse, sondern ebnen auch den Weg für die Entwicklung effizienterer und nachhaltigerer Energietechnologien.
Zusammenfassend lässt sich sagen, dass der Einsatz fortschrittlicher In-situ- und Nicht-in-situ-Techniken in Verbindung mit theoretischer Modellierung die Untersuchung elektrochemischer Mechanismen auf mikroskopischer Ebene revolutioniert hat. Dieser interdisziplinäre Ansatz treibt die Innovation sowohl in der akademischen Forschung als auch bei industriellen Anwendungen weiter voran.
Fortschritte bei der elektrochemischen Prüfung
Herkömmliche elektrochemische Methoden unterliegen einem bedeutenden Wandel, um den heutigen Anforderungen gerecht zu werden. Diese Fortschritte werden durch die Notwendigkeit vorangetrieben, die Überwachungsempfindlichkeit zu verbessern, sich an extreme Umweltbedingungen anzupassen und anspruchsvolle mathematische Verfahren zu integrieren. Die Weiterentwicklung der elektrochemischen Prüfverfahren ist nicht nur eine schrittweise Verbesserung, sondern ein Paradigmenwechsel, der die Lücke zwischen theoretischem Verständnis und praktischer Anwendung schließt.
Einer der Schlüsselbereiche der Entwicklung ist die Integration fortschrittlicher mathematischer Modelle. Diese Modelle ermöglichen genauere Vorhersagen und Interpretationen elektrochemischer Phänomene, insbesondere bei komplexen Systemen, bei denen herkömmliche Methoden versagen. So hat die Einbeziehung von Algorithmen des maschinellen Lernens die Analyse und Optimierung elektrochemischer Prozesse in Echtzeit ermöglicht, wodurch der Zeit- und Ressourcenaufwand für Experimente erheblich reduziert werden konnte.

Außerdem hat die Anpassungsfähigkeit dieser Methoden an extreme Bedingungen neue Wege für Forschung und Anwendung eröffnet. Ob es sich um die hohen Temperaturen industrieller Prozesse oder die niedrigen Temperaturen der Weltraumforschung handelt, moderne elektrochemische Techniken werden so angepasst, dass sie zuverlässig und effizient arbeiten. Diese Anpassungsfähigkeit ist von entscheidender Bedeutung für Branchen, die von der Energieerzeugung bis zur Materialwissenschaft reichen und in denen die Bedingungen sehr unterschiedlich sein können.
Neben den mathematischen Fortschritten haben sich auch die Hardware-Komponenten der elektrochemischen Prüfung erheblich verbessert. Hochpräzise Sensoren und automatisierte Systeme sind heute gang und gäbe und ermöglichen eine kontinuierliche Überwachung und Datenerfassung. Diese Systeme sind nicht nur genauer, sondern auch benutzerfreundlicher und machen fortschrittliche elektrochemische Tests für ein breiteres Spektrum von Forschern und Unternehmen zugänglich.
Die Synergie zwischen diesen Fortschritten bei der mathematischen Modellierung, der Anpassungsfähigkeit an Umweltbedingungen und der Verbesserung der Hardware hat zu einer neuen Ära bei elektrochemischen Prüfungen geführt. Diese Ära zeichnet sich durch größere Präzision, Effizienz und Anwendbarkeit aus und ebnet den Weg für Durchbrüche sowohl in der Grundlagenforschung als auch bei praktischen Anwendungen.
Interdisziplinäre Anwendungen
Die Vielseitigkeit der Elektrochemie zeigt sich in ihren weitreichenden Anwendungen in verschiedenen wissenschaftlichen und industriellen Bereichen. Einer der wichtigsten Anwendungsbereiche ist Elektrosynthese die sich elektrochemische Prozesse zunutze macht, um komplexe organische und anorganische Verbindungen zu synthetisieren. Diese Methode ist besonders nützlich bei der Herstellung von Arzneimitteln, Agrochemikalien und Spezialchemikalien, da sie eine präzise Kontrolle der Reaktionsbedingungen ermöglicht und die Abfallmenge minimiert.
Elektrolyseverfahren sind ein weiterer Eckpfeiler der modernen Elektrochemie und spielen eine entscheidende Rolle bei der Herstellung von wichtigen Industriechemikalien wie Chlor und Natriumhydroxid in der Chloralkaliindustrie. Darüber hinaus ist die Elektrolyse von entscheidender Bedeutung bei der Gewinnung von Metallen wie Aluminium und bei der Erzeugung von Wasserstoff durch Wasserelektrolyse, die für nachhaltige Energielösungen von zentraler Bedeutung ist.
Korrosionsschutz ist eine wichtige Anwendung, bei der elektrochemische Prinzipien eingesetzt werden, um Metalle vor Zersetzung zu schützen. Techniken wie die Galvanisierung, der Schutz durch Opferanoden und der anodische Schutz sind weit verbreitet, um die Lebensdauer von Metallstrukturen in verschiedenen Umgebungen zu verlängern, von der Schifffahrt bis zu Industrieanlagen.
Elektrokatalyse ist ein hochmodernes Gebiet, in dem sich Elektrochemie und Katalyse überschneiden, um die Effizienz chemischer Reaktionen zu verbessern. Dies ist besonders wichtig für die Entwicklung von Brennstoffzellen, die chemische Energie mit hohem Wirkungsgrad und minimaler Umweltbelastung direkt in elektrische Energie umwandeln.
Im Bereich der neuen Energiequellen steht die Elektrochemie an vorderster Front bei der Erforschung fortschrittlicher Batterietechnologien, einschließlich Lithium-Ionen-Batterien und Festkörperbatterien. Diese Technologien sind für den Übergang zu erneuerbaren Energiesystemen unerlässlich, da sie im Vergleich zu herkömmlichen Batterien eine höhere Energiedichte und eine längere Lebensdauer bieten.
Photoelektrochemie verbindet die Photochemie mit der Elektrochemie und nutzt die Energie des Lichts als Antrieb für elektrochemische Reaktionen. Dieser Bereich ist entscheidend für die Entwicklung von Solarzellen und die photoelektrochemische Wasserspaltung, mit der Sonnenlicht direkt in Wasserstoff, einen sauberen und reichlich vorhandenen Brennstoff, umgewandelt werden kann.
Zum Schluss, Bioelektrochemie ist eine aufstrebende Disziplin, die elektrochemische Prinzipien auf biologische Systeme anwendet. Dazu gehören die Entwicklung von Biosensoren für die medizinische Diagnostik und die Bioelektrokatalyse für die Bioremediation und Bioenergieerzeugung. Diese Anwendungen verdeutlichen die tiefgreifenden Auswirkungen der Elektrochemie sowohl auf die menschliche Gesundheit als auch auf die ökologische Nachhaltigkeit.
Praktische Anwendungen der Elektrochemie
Elektrolyse und Elektrosynthese
Elektrolyse und Elektrosynthese spielen eine zentrale Rolle bei der Umwandlung von Rohstoffen in wertvolle Produkte und treiben verschiedene industrielle Prozesse voran. Die Chlor-Alkali-Industrie ist ein Eckpfeiler, der die Elektrolyse zur Herstellung von Chlor und Natriumhydroxid einsetzt, die für verschiedene chemische Prozesse und Fertigungsbereiche unerlässlich sind. Dieser Prozess gewährleistet nicht nur eine ständige Versorgung mit diesen Chemikalien, sondern unterstreicht auch die Effizienz und Skalierbarkeit elektrochemischer Verfahren.
Im Bereich der Aluminium-Elektrolyse ist das Hall-Héroult-Verfahren nach wie vor unverzichtbar. Dieses Verfahren, das die elektrolytische Reduktion von in geschmolzenem Kryolith gelöstem Aluminiumoxid beinhaltet, ist für die weltweite Aluminiumproduktion von entscheidender Bedeutung. Durch die ständige Weiterentwicklung und Optimierung dieses Verfahrens konnten der Energieverbrauch und die Umweltauswirkungen erheblich gesenkt werden, was es zu einem Vorbild für eine nachhaltige industrielle Praxis macht.

Die Wasserelektrolyse hat vor allem im Zusammenhang mit der Speicherung erneuerbarer Energien und der Wasserstofferzeugung große Aufmerksamkeit erregt. Durch die Aufspaltung von Wasser in Wasserstoff und Sauerstoff mit Hilfe von elektrischem Strom bietet dieses Verfahren eine saubere und skalierbare Lösung für die Erzeugung von Wasserstoff als Kraftstoff, der gespeichert und für verschiedene Anwendungen, vom Verkehr bis zu industriellen Prozessen, verwendet werden kann.
Die Elektrosynthese erweitert den Anwendungsbereich der Elektrochemie und ermöglicht die Synthese komplexer organischer Moleküle und pharmazeutischer Produkte. Diese Technik ermöglicht eine präzise Kontrolle der Reaktionsbedingungen, was zu einer höheren Ausbeute und Reinheit der Produkte führt. Die Vielseitigkeit der Elektrosynthese wird durch ihren Einsatz bei der Herstellung von Feinchemikalien, Agrochemikalien und Spezialmaterialien veranschaulicht, was ihre Bedeutung in der modernen chemischen Produktion unterstreicht.
Diese Anwendungen verdeutlichen das transformative Potenzial von Elektrolyse und Elektrosynthese, das Innovationen in zahlreichen Branchen vorantreibt und zu den Zielen der nachhaltigen Entwicklung beiträgt.
Metallkorrosion und Schutz
Metallkorrosion ist in verschiedenen Industriezweigen ein großes Problem, das zu erheblichen wirtschaftlichen Verlusten und Sicherheitsrisiken führt. Um diese Auswirkungen abzumildern, wurden mehrere fortschrittliche Methoden entwickelt und eingesetzt. Dazu gehören, Galvanisieren eine vielseitige Technik, die nicht nur das ästhetische Erscheinungsbild von Metallen verbessert, sondern auch ihre Korrosionsbeständigkeit erheblich erhöht. Durch das Aufbringen einer dünnen Schicht eines korrosionsbeständigeren Metalls auf die Oberfläche des Grundmetalls wirkt die Galvanisierung wie eine Schutzbarriere gegen Umwelteinflüsse.
Eine weitere wirksame Methode ist der Opferanodenschutz Dabei wird ein reaktiveres Metall auf die zu schützende Struktur aufgebracht. Dieses Opfermetall, das häufig aus Magnesium oder Zink besteht, korrodiert bevorzugt und schützt so das darunter liegende Metall vor Korrosion. Diese Technik wird häufig in Meeresumgebungen eingesetzt, wo die Korrosionsraten besonders hoch sind.
Anodischer Schutz ist ein weiteres ausgeklügeltes Verfahren, bei dem ein Metall auf ein Potenzial polarisiert wird, bei dem es passiv wird, was seine Korrosionsrate deutlich verringert. Diese Methode ist besonders wirksam bei Metallen, die eine stabile Oxidschicht bilden können, wie z. B. rostfreier Stahl. Durch die Steuerung des Potenzials kann der anodische Schutz die Lebensdauer kritischer Infrastrukturen in Branchen wie der chemischen Verarbeitung und der Ölraffination verlängern.
Diese Methoden, zusammen mit anderen wie kathodischer Schutz und Beschichtungstechnologien bilden zusammen ein robustes Arsenal gegen Metallkorrosion, das die Langlebigkeit und Zuverlässigkeit von Metallstrukturen in verschiedenen Anwendungen gewährleistet.
Bioelektrochemie
Die Bioelektrochemie stellt eine faszinierende Schnittstelle zwischen Biologie und Elektrochemie dar, mit Anwendungen, die von der medizinischen Diagnostik bis zur Umweltüberwachung reichen. Eine der wichtigsten Anwendungen ist die Entwicklung von Biosensoren die sich biologische Moleküle zunutze machen, um bestimmte Substanzen zu erkennen und zu quantifizieren. Diese Sensoren sind in der medizinischen Diagnostik von zentraler Bedeutung, da sie den schnellen und genauen Nachweis von Biomarkern, Hormonen und Krankheitserregern ermöglichen. Glukose-Biosensoren werden zum Beispiel häufig in der Diabetesbehandlung eingesetzt, um den Blutzuckerspiegel in Echtzeit zu überwachen.
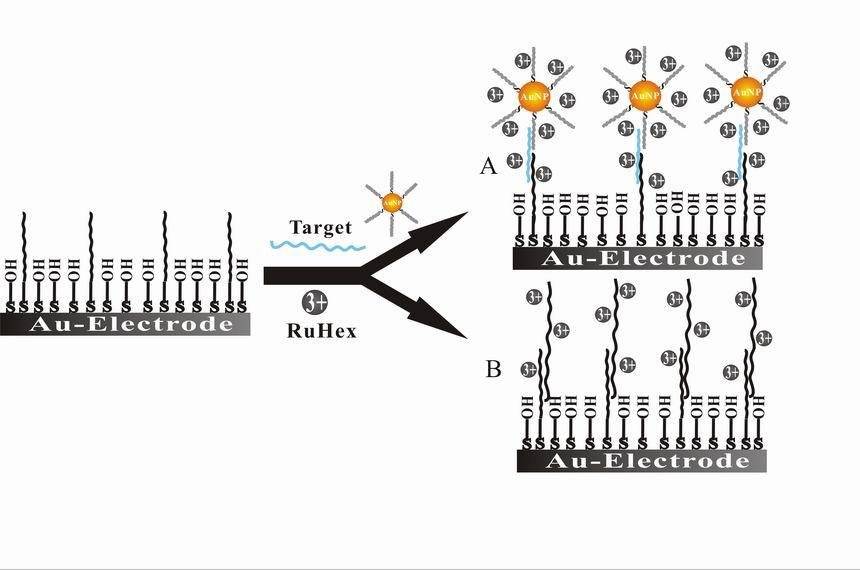
Zusätzlich zu den Biosensoren, Bioelektrokatalyse ein weiterer wichtiger Bereich innerhalb der Bioelektrochemie. In diesem Bereich geht es darum, Enzyme oder Mikroorganismen als Katalysatoren in elektrochemischen Reaktionen einzusetzen, um die Effizienz und Spezifität dieser Prozesse zu verbessern. Die Bioelektrokatalyse hat erhebliche Auswirkungen auf erneuerbare Energien, Abfallbehandlung und industrielle Prozesse. So nutzen beispielsweise mikrobielle Brennstoffzellen die Bioelektrokatalyse, um organische Abfälle direkt in Elektrizität umzuwandeln, was eine nachhaltige Lösung für die Energieerzeugung und die Abfallwirtschaft darstellt.
| Anwendung | Beschreibung | Beispiel |
|---|---|---|
| Biosensoren | Nutzung biologischer Moleküle zur Erkennung und Quantifizierung | Glukose-Biosensoren für das Diabetes-Management |
| Bioelektrokatalyse | Verwendung von Enzymen oder Mikroorganismen als Katalysatoren in elektrochemischen Reaktionen | Mikrobielle Brennstoffzellen für die Energiegewinnung aus organischen Abfällen |
Die Synergie zwischen biologischen und elektrochemischen Prinzipien in der Bioelektrochemie treibt die Innovation weiter voran und verspricht neue Instrumente und Methoden sowohl für die wissenschaftliche Forschung als auch für praktische Anwendungen.
Chemische Stromversorgungen
Chemische Stromversorgungen umfassen ein breites Spektrum an Technologien mit jeweils einzigartigen Eigenschaften und Anwendungen. Zu den wichtigsten Kategorien gehören Primärbatterien, Sekundärbatterien, Lithium-Ionen-Batterien und Brennstoffzellen. Primärbatterien, wie z. B. Alkali- und Zink-Kohle-Batterien, sind für den einmaligen Gebrauch bestimmt und finden sich häufig in alltäglichen Geräten wie Fernbedienungen und Taschenlampen. Zu den Sekundärbatterien oder wiederaufladbaren Batterien gehören Blei-Säure- und Nickel-Metallhydrid-Batterien, die mehrfach aufgeladen werden können und sich daher ideal für Anwendungen eignen, die über einen längeren Zeitraum hinweg mit Strom versorgt werden müssen.
Lithium-Ionen-Batterien haben die tragbare Elektronik und Elektrofahrzeuge aufgrund ihrer hohen Energiedichte, langen Lebensdauer und geringen Selbstentladung revolutioniert. Diese Batterien bestehen aus Lithiumverbindungen als Elektroden und einem nichtwässrigen Elektrolyten und bieten ein ausgewogenes Verhältnis zwischen Kosten, Leistung und Umweltbelastung.
Brennstoffzellen hingegen stellen einen bedeutenden Fortschritt in der nachhaltigen Energietechnologie dar. Im Gegensatz zu Batterien, die Energie chemisch speichern, erzeugen Brennstoffzellen Strom durch die elektrochemische Reaktion eines Brennstoffs, in der Regel Wasserstoff, mit einem Oxidationsmittel, meist Sauerstoff. Dieser Prozess führt zu einem hohen Wirkungsgrad, geringer Umweltverschmutzung und der Möglichkeit, die Stromerzeugung an den Bedarf anzupassen. Brennstoffzellen sind besonders vielversprechend für Anwendungen wie Elektrofahrzeuge, Notstromsysteme und sogar die Erforschung des Weltraums, wo zuverlässige und saubere Energie von größter Bedeutung ist.
| Typ der Batterie | Primäre Anwendungsfälle | Wichtigste Vorteile |
|---|---|---|
| Primärbatterien | Geräte für den einmaligen Gebrauch (Fernbedienungen, Taschenlampen) | Kostengünstig, weithin verfügbar |
| Sekundär-Batterien | Wiederaufladbare Geräte (Telefone, Laptops) | Wiederverwendbar, lange Lebensdauer |
| Lithium-Ionen-Batterien | Tragbare Elektronik, Elektrofahrzeuge | Hohe Energiedichte, geringe Selbstentladung |
| Brennstoffzellen | Elektrofahrzeuge, Notstromversorgung, Raumfahrt | Hoher Wirkungsgrad, geringe Umweltbelastung, skalierbar |
Ähnliche Produkte
- Elektrochemisches Laborarbeitsplatz-Potentiostat für Laboranwendungen
- Goldplattierte Elektrode
- Gold-Elektrodenblech Gold-Elektrode
- Elektrodenhalterung für elektrochemische Experimente
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
Ähnliche Artikel
- Umfassender Leitfaden für tragbare Lithium-Batterie-Analysatoren: Merkmale, Anwendungen und Wartung
- Gesättigte Kalomel-Referenzelektroden verstehen: Zusammensetzung, Einsatzmöglichkeiten und Überlegungen
- Erforschung des multifunktionalen Elektrolysezellen-Wasserbads: Anwendungen und Vorteile
- Revolutionierung der Qualitätskontrolle: Der ultimative Leitfaden für tragbare Lithium-Batterie-Analysatoren
- Umfassender Leitfaden für tragbare Bodenanalysegeräte: Merkmale, Vorteile und Anwendungen













