Einführung in elektrolytische Zellen und Korrosion
Elektrolysezellen spielen eine zentrale Rolle in verschiedenen industriellen Prozessen, sind jedoch nicht ohne Probleme, insbesondere im Hinblick auf Korrosion. Dieser Artikel befasst sich mit der komplizierten Funktionsweise von Elektrolysezellen mit flacher Korrosion und untersucht ihre grundlegenden Komponenten wie Elektrolyt, Anode und Kathode sowie die Prozesse, die zu Korrosion führen. Das Verständnis dieser Mechanismen ist von entscheidender Bedeutung für die Entwicklung wirksamer Strategien zur Eindämmung der Korrosion, um die Langlebigkeit und Effizienz von Elektrolysezellen in Anwendungen von der Metallreinigung bis zur Galvanisierung zu gewährleisten. Begleiten Sie uns, wenn wir die Komplexität von Elektrolysezellen und die kritischen Maßnahmen zum Schutz dieser wichtigen industriellen Werkzeuge entschlüsseln.
Mechanismen der Korrosion in elektrolytischen Zellen
Korrosion in elektrolytischen Zellen ist ein komplexer Prozess, bei dem verschiedene Faktoren zusammenwirken, darunter schwankende Potenziale und die Ungleichheit zwischen den Metallelektroden. Das Verständnis dieser Mechanismen ist entscheidend für die Entwicklung wirksamer Strategien zur Eindämmung der Korrosion, die die Effizienz und Lebensdauer von Elektrolysezellen erheblich beeinträchtigen kann.
Die Rolle schwankender Potentiale
Schwankende Potenziale in Elektrolysezellen können verschiedene Ursachen haben, darunter Schwankungen der angelegten Spannung, Änderungen der Elektrolytzusammensetzung und thermische Schwankungen. Diese Schwankungen können zu örtlicher Korrosion führen, bei der bestimmte Bereiche der Elektrode höhere Oxidations- oder Reduktionsraten aufweisen als andere. Diese ungleichmäßige Korrosion kann zu Lochfraß, Spaltkorrosion und anderen Formen lokaler Schäden führen.
In einer typischen Elektrolysezelle wird die Anode oxidiert und gibt Elektronen ab, während die Kathode reduziert wird und Elektronen aufnimmt. Wenn das Potenzial an der Anode schwankt, kann dies zu ungleichmäßigen Oxidationsraten führen, wodurch einige Bereiche schneller korrodieren als andere. In ähnlicher Weise können Potenzialschwankungen an der Kathode den Reduktionsprozess beeinflussen, was zu ungleichmäßigen Korrosionsmustern führt.
Wechselwirkung zwischen verschiedenen Metallelektroden
Die Verwendung ungleicher Metallelektroden in einer Elektrolysezelle kann ebenfalls zur Korrosion beitragen. Wenn zwei verschiedene Metalle in einer Elektrolytlösung miteinander in Kontakt sind, können sie eine galvanische Zelle bilden, in der ein Metall als Anode und das andere als Kathode fungiert. Das Metall mit dem höheren Oxidationspotenzial korrodiert schneller und fungiert als Opferanode.
Wird beispielsweise eine Kupferelektrode zusammen mit einer Zinkelektrode in einem sauren Elektrolyten verwendet, korrodiert das Zink aufgrund seines höheren Oxidationspotenzials schneller. Diese galvanische Korrosion kann durch Schwankungen des pH-Werts, der Temperatur und der Ionenkonzentration des Elektrolyten noch verstärkt werden, was zu einer beschleunigten Zersetzung der Opferanode führt.
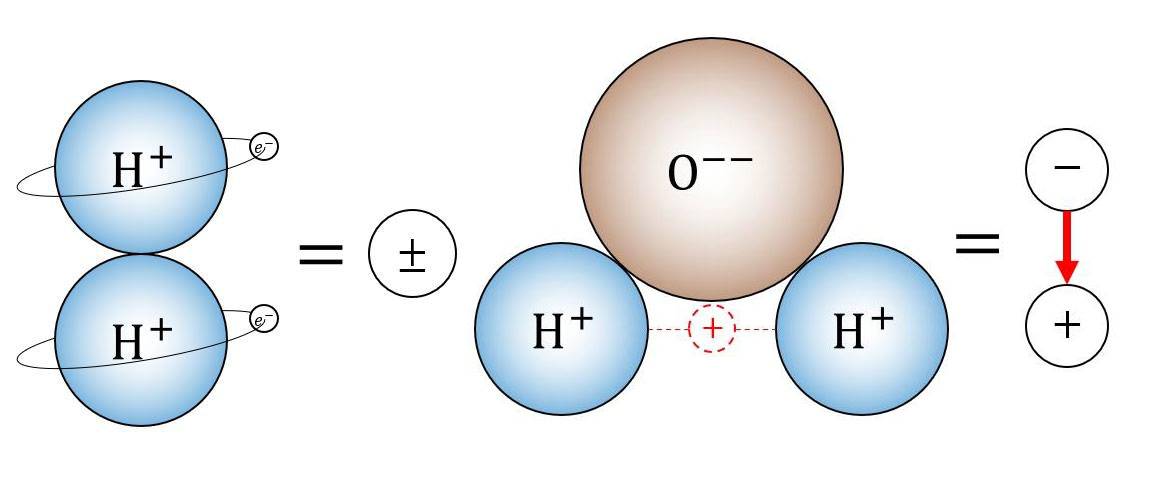
Strategien zur Abschwächung
Um die Korrosion in elektrolytischen Zellen zu verringern, können verschiedene Strategien angewandt werden:
-
Kathodischer Schutz: Hierbei wird ein reaktiveres Metall als Opferanode verwendet, um die Primärelektrode vor Korrosion zu schützen. Die Opferanode korrodiert anstelle der Primärelektrode und verlängert so deren Lebensdauer.
-
Inhibitoren: Dem Elektrolyt können chemische Inhibitoren zugesetzt werden, um die Korrosionsrate zu verringern. Diese Inhibitoren bilden eine Schutzschicht auf der Elektrodenoberfläche, die den direkten Kontakt mit korrosiven Stoffen verhindert. Übliche Inhibitoren sind organische Verbindungen, die Stickstoff-, Schwefel- oder Sauerstoffatome enthalten.
-
Auswahl des Materials: Die Wahl korrosionsbeständiger Materialien für die Elektroden kann die Korrosionsraten erheblich reduzieren. Platin und Gold zum Beispiel sind sehr korrosionsbeständig und werden häufig für anspruchsvolle elektrolytische Anwendungen verwendet.
-
Elektrodenkonstruktion: Auch die Optimierung des Elektrodendesigns kann zur Verringerung der Korrosion beitragen. So kann beispielsweise die Verwendung bipolarer Elektroden, die in verschiedenen Zellen sowohl als Anode als auch als Kathode fungieren, den Potenzialunterschied zwischen den Elektroden minimieren und die galvanische Korrosion verringern.
-
Wartung und Überwachung: Eine regelmäßige Überwachung der Leistung der Elektrolysezelle kann helfen, frühe Anzeichen von Korrosion zu erkennen. Regelmäßige Wartungsarbeiten, wie die Reinigung der Elektroden und der Austausch des Elektrolyten, können den Aufbau von korrosiven Nebenprodukten verhindern und eine optimale Leistung gewährleisten.
Schlussfolgerung
Die Korrosion in Elektrolysezellen ist ein vielschichtiges Problem, das mit dem Zusammenspiel schwankender Potenziale und der Wechselwirkung zwischen verschiedenen Metallelektroden zusammenhängt. Wenn man diese Mechanismen versteht, ist es möglich, wirksame Strategien zur Eindämmung der Korrosion zu entwickeln und so die Effizienz und Langlebigkeit von Elektrolysezellen zu verbessern. Durch sorgfältige Materialauswahl, Konstruktionsoptimierung und den Einsatz von Schutzmaßnahmen wie Inhibitoren und kathodischem Schutz lassen sich die Auswirkungen von Korrosion auf elektrolytische Systeme deutlich verringern.
Industrielle Anwendungen von elektrolytischen Zellen
Elektrolysezellen spielen in verschiedenen industriellen Prozessen, von der Metallreinigung bis zur chemischen Produktion, eine entscheidende Rolle. Diese Zellen nutzen das Prinzip der Elektrolyse, bei der ein elektrischer Strom durch eine ionenhaltige Flüssigkeit oder Lösung geleitet wird, um nicht-spontane chemische Reaktionen auszulösen. Dieser Abschnitt befasst sich mit den spezifischen industriellen Anwendungen von Elektrolysezellen und konzentriert sich dabei auf die Kupferreinigung, die Galvanisierung und die Herstellung von Natronlauge, wobei auch die Bedeutung des Korrosionsschutzes hervorgehoben wird.
Kupferreinigung
Eine der wichtigsten Anwendungen von elektrolytischen Zellen ist die Reinigung von Kupfer. Bei diesem Verfahren wird eine Elektrolysezelle verwendet, bei der die Anode aus unreinem Kupfer und die Kathode aus einem dünnen Blech aus reinem Kupfer besteht. Der Elektrolyt ist eine Lösung aus Kupfersulfat (CuSO4) und Schwefelsäure (H2SO4). Wenn elektrischer Strom angelegt wird, lösen sich Kupferionen (Cu2+) von der Anode im Elektrolyten und wandern dann zur Kathode, wo sie sich als reines Kupfer abscheiden. Dieser Prozess führt zu einem Kupferreinheitsgrad von über 99,9 %.
Der Energieverbrauch für die Kupferraffination durch elektrolytische Verfahren liegt zwischen 150 und 300 Kilowattstunden pro Tonne raffinierten Kupfers. Dieses Verfahren ist hocheffizient und gewährleistet, dass Verunreinigungen wie Eisen und Zink im Elektrolyten verbleiben, während sich wertvolle Metalle wie Gold und Silber am Boden der Zelle als Anodenschlamm sammeln, der zurückgewonnen werden kann.

Galvanisierung
Eine weitere wichtige Anwendung von Elektrolysezellen ist die Galvanisierung, bei der eine dünne Schicht eines Metalls auf die Oberfläche eines anderen Metalls aufgebracht wird, um dessen Aussehen und Haltbarkeit zu verbessern oder es korrosionsbeständig zu machen. Zu den gängigen Metallen, die für die Galvanisierung verwendet werden, gehören Chrom, Nickel und Gold. Bei diesem Verfahren werden das zu beschichtende Objekt (Kathode) und ein Stab des Beschichtungsmetalls (Anode) in eine Elektrolytlösung getaucht, die die Metallionen enthält. Wenn ein elektrischer Strom angelegt wird, werden die Metallionen aus dem Elektrolyten an der Kathode reduziert, wodurch eine gleichmäßige Beschichtung entsteht.
Die Galvanotechnik ist in der Automobil-, Luft- und Raumfahrt- sowie in der Elektronikindustrie weit verbreitet. Die Verchromung wird z. B. verwendet, um Automobilteilen eine harte, glänzende Oberfläche zu verleihen, während die Vergoldung für elektronische Bauteile unerlässlich ist, um eine gute elektrische Leitfähigkeit und Korrosionsbeständigkeit zu gewährleisten.
Herstellung von Ätznatron (Caustic Soda)
Die Herstellung von Ätznatron (Natriumhydroxid, NaOH) ist eine weitere wichtige industrielle Anwendung von Elektrolysezellen. Ätznatron ist eine wichtige Chemikalie in verschiedenen Industriezweigen, darunter die Papierherstellung, die Seifen- und Waschmittelproduktion und die Wasseraufbereitung. Das Verfahren umfasst die Elektrolyse einer Natriumchloridlösung (NaCl), die gemeinhin als Sole bezeichnet wird.
In der Elektrolysezelle wird an der Anode Chlorgas (Cl2) und an der Kathode Natriumhydroxid erzeugt. Die Gesamtreaktion lässt sich wie folgt zusammenfassen:
[ 2NaCl + 2H2O \rightarrow 2NaOH + Cl2 + H2 ]
Das Chlorgas wird häufig bei der Herstellung anderer Chemikalien wie PVC (Polyvinylchlorid) verwendet, während die Natronlauge in zahlreichen industriellen Prozessen eingesetzt wird. Diese Produktionsmethode ist äußerst effizient und wird in großem Maßstab durchgeführt, wobei jährlich weltweit Millionen Tonnen Natronlauge hergestellt werden.
Verhinderung von Korrosion
Die Vermeidung von Korrosion ist ein entscheidender Aspekt vieler industrieller Anwendungen, bei denen elektrolytische Zellen zum Einsatz kommen. Korrosion tritt auf, wenn ein Metall mit seiner Umgebung reagiert, was zu einer Verschlechterung und einem Verlust der Materialeigenschaften führt. Elektrolysezellen können dazu verwendet werden, Schutzschichten auf Metalle wie Zink oder Kadmium aufzutragen, die eine Barriere gegen Umwelteinflüsse bilden.
Außerdem werden elektrolytische Zellen beim kathodischen Schutz eingesetzt, bei dem eine Opferanode an die zu schützende Metallstruktur angeschlossen wird. Die Opferanode korrodiert anstelle der zu schützenden Struktur und verlängert so deren Lebensdauer. Diese Methode wird häufig für den Schutz von Pipelines, Offshore-Strukturen und Lagertanks eingesetzt.
Zusammenfassend lässt sich sagen, dass elektrolytische Zellen in verschiedenen industriellen Prozessen unverzichtbar sind, von der Metallreinigung und Galvanisierung bis hin zur chemischen Produktion und zum Korrosionsschutz. Diese Anwendungen verdeutlichen die Vielseitigkeit und Bedeutung von Elektrolysezellen in der modernen Industrie, da sie die Herstellung hochwertiger Materialien und den effizienten Betrieb industrieller Prozesse gewährleisten.
Vorbeugende Maßnahmen gegen Korrosion
Korrosion in Elektrolysezellen ist ein großes Problem, da sie die Leistung und Lebensdauer der Anlagen beeinträchtigen kann. Es wurden verschiedene Techniken entwickelt, um Korrosion zu verhindern oder abzuschwächen, darunter der Einsatz von Inhibitoren, kathodischer Schutz und die Bildung von Passivierungsschichten. Diese Methoden sind entscheidend für die Aufrechterhaltung der Integrität und Effizienz von elektrolytischen Prozessen, die in Branchen wie der Galvanotechnik, der Metallveredelung und der Wasseraufbereitung weit verbreitet sind.
Verwendung von Inhibitoren
Inhibitoren sind Chemikalien, die, wenn sie dem Elektrolyten zugesetzt werden, die Korrosionsrate der Elektroden erheblich verringern können. Diese Stoffe bilden eine Schutzschicht auf der Metalloberfläche, die als Barriere gegen die korrosive Umgebung wirkt. Die Wirksamkeit der Inhibitoren hängt von mehreren Faktoren ab, unter anderem von ihrer Konzentration, der Art des Metalls und der Zusammensetzung des Elektrolyts. Bestimmte organische Verbindungen, die Stickstoff-, Schwefel- oder Sauerstoffatome enthalten, können beispielsweise als Inhibitoren sehr wirksam sein, da sie an der Metalloberfläche adsorbieren und die aktiven Stellen blockieren, an denen Korrosion normalerweise auftritt.
Kathodischer Schutz
Der kathodische Schutz ist eine weitere wirksame Methode zur Verhinderung von Korrosion in Elektrolysezellen. Bei dieser Technik wird die Metalloberfläche zur Kathode einer elektrochemischen Zelle und damit vor Oxidation geschützt. Es gibt zwei Hauptarten des kathodischen Schutzes: Opferanoden und Fremdstrom. Bei Opferanodensystemen wird ein reaktiveres Metall (z. B. Zink oder Magnesium) mit dem zu schützenden Metall verbunden. Die Opferanode korrodiert anstelle des zu schützenden Metalls. Bei Systemen mit eingeprägtem Strom wird eine externe Stromquelle verwendet, um die Kathode mit einem kontinuierlichen Strom zu versorgen, der verhindert, dass sie oxidiert wird.
Bildung von Passivierungsschichten
Die Bildung von Passivierungsschichten ist ein natürlicher Prozess, bei dem sich eine dünne Schutzschicht aus Oxid oder anderen Verbindungen auf der Oberfläche des Metalls bildet. Diese Schicht wirkt wie eine Barriere, die weitere Korrosion verhindert, indem sie den Zugang zum darunter liegenden Metall versperrt. Die Passivierung kann durch spezielle Behandlungen verbessert werden, z. B. durch Eloxieren bei Aluminium oder Chromatieren bei Stahl. Diese Behandlungen erzeugen nicht nur eine Schutzschicht, sondern verbessern auch die mechanischen Eigenschaften des Metalls, so dass es widerstandsfähiger gegen Abnutzung und Verschleiß wird.
Galvanische Beschichtung
Bei der Galvanisierung wird eine dünne Metallschicht auf eine andere Metalloberfläche aufgebracht, um diese vor Korrosion zu schützen. Bei diesem Verfahren wird das Metallteil in eine Lösung getaucht, die das abzuscheidende Metall enthält, und ein elektrischer Strom angelegt. Die Metallionen in der Lösung werden an der Kathode (dem Metallteil) reduziert und bilden eine Schutzschicht. Zu den gängigen Metallen, die für die Galvanotechnik verwendet werden, gehören Chrom, Nickel und Zink. Die Galvanisierung bietet nicht nur Korrosionsschutz, sondern verbessert auch das Aussehen und die Verschleißfestigkeit der Metallteile.
Elektrolytische Zellen in der Industrie
Elektrolysezellen werden in verschiedenen industriellen Prozessen eingesetzt, u. a. bei der Herstellung von hochreinen Metallen wie Aluminium, Kupfer, Zink und Blei. Diese Zellen werden auch bei der Elektroraffination und der elektrolytischen Gewinnung von Metallen eingesetzt, bei denen die Reinheit des Endprodukts entscheidend ist. Außerdem werden elektrolytische Zellen in Wasseraufbereitungsprozessen eingesetzt, z. B. bei der Zersetzung von Wasser in Wasserstoff und Sauerstoff. Die Verhinderung von Korrosion in diesen Zellen ist für den kontinuierlichen und effizienten Betrieb dieser Prozesse unerlässlich.
Schlussfolgerung
Die Verhinderung von Korrosion in Elektrolysezellen ist für die Langlebigkeit und Leistungsfähigkeit von Industrieanlagen von entscheidender Bedeutung. Techniken wie der Einsatz von Inhibitoren, kathodischer Schutz und die Bildung von Passivierungsschichten sind wirksame Strategien zur Eindämmung von Korrosion. Diese Methoden schützen nicht nur die Elektroden, sondern gewährleisten auch den effizienten Betrieb von elektrolytischen Prozessen, die für verschiedene industrielle Anwendungen unerlässlich sind. Durch die Umsetzung dieser vorbeugenden Maßnahmen kann die Industrie die Wartungskosten senken, die Lebensdauer ihrer Anlagen verlängern und die hohen Produktionsstandards aufrechterhalten.
Konstruktion und Materialien von Elektrolysezellen
Elektrolysezellen sind in verschiedenen industriellen Prozessen von grundlegender Bedeutung, insbesondere bei der Elektroraffination und Elektrogewinnung von Nichteisenmetallen wie Aluminium, Kupfer, Zink und Blei. Diese Zellen sind so konzipiert, dass sie die Zersetzung chemischer Verbindungen durch die Zufuhr von elektrischer Energie erleichtern, ein Prozess, der unter normalen Bedingungen nicht spontan ablaufen würde. Die Effizienz und Wirksamkeit einer Elektrolysezelle hängt stark von ihrer Konstruktion und den verwendeten Materialien ab, insbesondere von der Auswahl inerter Elektroden und der Art des Elektrolyten.
Bestandteile von Elektrolysezellen
Eine Elektrolysezelle besteht aus drei Hauptkomponenten: dem Elektrolyten, der Kathode und der Anode.
-
Elektrolyt: Dabei handelt es sich in der Regel um eine Lösung aus Wasser oder anderen Lösungsmitteln, in der Ionen aufgelöst sind. Auch geschmolzene Salze, wie Natriumchlorid, können als Elektrolyt dienen. Die Rolle des Elektrolyten ist von entscheidender Bedeutung, da er die Ionen enthält, die bei Anlegen einer externen Spannung an den Redoxreaktionen teilnehmen. Die Ionen im Elektrolyten bewegen sich in Richtung der Elektroden mit entgegengesetzter Ladung, wodurch die Ladungsübertragungsreaktionen erleichtert werden.
-
Kathode und Anode: Die Kathode ist die negative Elektrode, an der die Reduktion stattfindet, während die Anode die positive Elektrode ist, an der die Oxidation stattfindet. In elektrolytischen Zellen werden inerte Elektroden bevorzugt, um chemische Reaktionen zu vermeiden, die die Elektroden selbst verändern könnten. Übliche Materialien für diese Elektroden sind Graphit und Platin, die für ihre Stabilität und Leitfähigkeit bekannt sind.

Überlegungen zur Konstruktion
Bei der Konstruktion einer Elektrolysezelle müssen mehrere Faktoren berücksichtigt werden, um ihre Leistung zu optimieren:
-
Auswahl des Elektrodenmaterials: Die Wahl des Elektrodenmaterials ist entscheidend. Anoden sollten effiziente Reduktionsmittel mit hoher coulombischer Leistung, guter Leitfähigkeit, Stabilität, einfacher Herstellung und geringen Kosten sein. Zu den gängigen Anodenmaterialien gehören Zink und Lithium. Kathoden hingegen sollten effiziente Oxidationsmittel sein, die im Kontakt mit dem Elektrolyten stabil sind und eine brauchbare Arbeitsspannung aufweisen. Zu diesem Zweck werden häufig Metalloxide verwendet.
-
Elektrolyt-Zusammensetzung: Der Elektrolyt muss sorgfältig ausgewählt werden, um sicherzustellen, dass er die gewünschten chemischen Reaktionen unterstützt, ohne unerwünschte Nebeneffekte wie Korrosion oder Zersetzung der Elektroden zu verursachen. Die Leitfähigkeit des Elektrolyten ist ebenfalls ein Schlüsselfaktor, da sie die Effizienz der Zelle direkt beeinflusst.
-
Geometrie der Zelle: Die physikalische Anordnung der Elektroden und des Elektrolyten kann den Ionenfluss und die Stromverteilung innerhalb der Zelle erheblich beeinflussen. Die Optimierung der Zellgeometrie kann dazu beitragen, Energieverluste zu minimieren und den Gesamtwirkungsgrad des elektrolytischen Prozesses zu verbessern.
Anwendungen und Auswirkungen
Das Design und die Werkstoffe von Elektrolysezellen haben einen großen Einfluss auf ihre Anwendungen in der Industrie. So hängt beispielsweise die Produktion von hochreinen Metallen wie Aluminium und Kupfer stark von der Effizienz dieser Zellen ab. Darüber hinaus werden Elektrolysezellen in Prozessen wie der Wasseraufbereitung und der Erzeugung von Wasserstoffgas eingesetzt, was ihre Vielseitigkeit und Bedeutung in der modernen Technologie unterstreicht.
Zusammenfassend lässt sich sagen, dass das Design und die Materialien von Elektrolysezellen für ihre Funktion und Effizienz entscheidend sind. Durch die sorgfältige Auswahl inerter Elektroden und die Optimierung des Elektrolyten und der Zellgeometrie kann die Leistung dieser Zellen verbessert werden, so dass sie in einer Vielzahl von industriellen Anwendungen effektiver eingesetzt werden können.
Elektrolytische vs. Galvanische Zellen
Elektrolytische und galvanische Zellen sind grundlegende Komponenten im Bereich der Elektrochemie, die jeweils unterschiedlichen Zwecken dienen und nach unterschiedlichen Prinzipien arbeiten. Das Verständnis der Unterschiede und Anwendungen dieser Zellen ist für verschiedene wissenschaftliche und industrielle Prozesse von entscheidender Bedeutung.

Unterschiede in der Funktionsweise
Elektrolytische Zellen: Elektrolytische Zellen werden verwendet, um nicht spontane chemische Reaktionen durch die Zufuhr von elektrischer Energie anzuregen. Sie bestehen aus zwei Elektroden (Anode und Kathode), die in eine Elektrolytlösung eingetaucht sind. In diesen Zellen drückt die externe Stromquelle Elektronen in die Kathode, wodurch diese negativ wird, und zieht Elektronen aus der Anode, wodurch diese positiv wird. Diese Anordnung kehrt den natürlichen Elektronenfluss um und ermöglicht das Auftreten von nicht spontanen Reaktionen.
Galvanische Zellen: Im Gegensatz dazu erzeugen galvanische Zellen elektrische Energie aus spontanen chemischen Reaktionen. Sie bestehen ebenfalls aus zwei Elektroden, die in einen Elektrolyten eingetaucht sind, benötigen aber im Gegensatz zu elektrolytischen Zellen keine externe Stromquelle. Die Anode, an der die Oxidation stattfindet, ist negativ geladen, die Kathode, an der die Reduktion stattfindet, ist positiv geladen. Der Fluss der Elektronen von der Anode zur Kathode durch einen externen Stromkreis erzeugt einen elektrischen Strom.
Anwendungen
Elektrolytische Zellen: Elektrolysezellen werden in großem Umfang in industriellen Prozessen wie der Elektrolyse von Wasser zur Erzeugung von Wasserstoff und Sauerstoff, der Galvanisierung von Metallen und der Raffination von Kupfer eingesetzt. Sie sind auch für die Herstellung von Chemikalien wie Natronlauge und Chlor von entscheidender Bedeutung. Die Fähigkeit, nicht spontane Reaktionen auszulösen, macht sie für verschiedene chemische Synthese- und Reinigungsverfahren unverzichtbar.
Galvanische Zellen: Galvanische Zellen sind die Grundlage von Batterien, bei denen die Energie aus spontanen Redoxreaktionen genutzt wird, um elektrischen Strom zu erzeugen. Gängige Beispiele sind Primärzellen wie Alkali- und Zink-Kohle-Batterien sowie Sekundärzellen wie Bleisäure- und Lithium-Ionen-Batterien. Diese Zellen sind für die Stromversorgung von tragbaren elektronischen Geräten, Fahrzeugen und Notstromsystemen unerlässlich.
Auswirkungen auf Korrosionsraten und Präventionsstrategien
Die Betriebsunterschiede zwischen elektrolytischen und galvanischen Zellen haben erhebliche Auswirkungen auf die Korrosionsraten und die Präventionsstrategien. Bei der galvanischen Korrosion bilden zwei ungleiche Metalle, die miteinander und mit einem Elektrolyten in Kontakt stehen, eine galvanische Zelle, die zu einer beschleunigten Korrosion des unedleren Metalls führt. Dieses Phänomen wird in Opferanodensystemen ausgenutzt, mit denen Bauwerke wie Schiffe und Pipelines vor Korrosion geschützt werden.
Elektrolytische Zellen können dagegen bei kathodischen Schutzverfahren eingesetzt werden, bei denen eine Metallstruktur mit einem reaktiveren Metall (Opferanode) verbunden und in einen Elektrolyten getaucht wird. Das reaktivere Metall korrodiert anstelle der geschützten Struktur und verhindert so wirksam die Korrosion.

Schlussfolgerung
Zusammenfassend lässt sich sagen, dass sowohl elektrolytische als auch galvanische Zellen zwar Redoxreaktionen beinhalten und über Elektroden verfügen, an denen Oxidation und Reduktion stattfinden, dass sie aber auf entgegengesetzte Weise funktionieren. Elektrolytische Zellen nutzen externe elektrische Energie, um nicht-spontane Reaktionen anzutreiben, während galvanische Zellen elektrische Energie aus spontanen Reaktionen erzeugen. Das Verständnis dieser Unterschiede ist für eine effektive Anwendung in verschiedenen wissenschaftlichen, industriellen und technischen Kontexten von entscheidender Bedeutung, insbesondere für den Umgang mit Korrosion und deren Vermeidung.
Zukünftige Trends und Innovationen in der Elektrolysezellentechnologie
Der Bereich der Elektrolysezellentechnologie steht vor bedeutenden Fortschritten, angetrieben durch den Bedarf an haltbareren und effizienteren Systemen, insbesondere im Zusammenhang mit der Entwicklung von Batterien und Metallveredelungsverfahren. Diese Innovationen zielen darauf ab, kritische Herausforderungen wie Korrosion, Energieeffizienz und die Skalierbarkeit elektrolytischer Prozesse anzugehen.
Verbesserte Haltbarkeit durch Materialwissenschaft
Korrosion ist nach wie vor ein großes Problem bei elektrolytischen Zellen, insbesondere in Umgebungen mit schwankenden Potenzialen und ungleichen Metallen. Forscher erforschen verschiedene Methoden, um die Korrosion einzudämmen, darunter den Einsatz von Inhibitoren und die Entwicklung neuer Materialien, die von Natur aus korrosionsbeständiger sind. Die kathodische Inhibition beispielsweise ist eine Technik, bei der sich eine Schutzschicht auf der Kathode bildet, die die Korrosionsgeschwindigkeit verringert. Mit dieser Methode wird nicht nur die kathodische Reaktion verlangsamt, sondern es kommt auch zu einer Ausfällung in diesen Bereichen, wodurch die Elektrode vor weiteren Schäden geschützt wird.
Innovationen bei der Konstruktion von Elektrolysezellen
Auch bei der Konstruktion von Elektrolysezellen gibt es erhebliche Veränderungen. Traditionelle Konstruktionen beruhen auf einem vollständigen Kreislauf mit stabilen Elektroden und einer flüssigen Elektrolytlösung. Neuere Konstruktionen erforschen jedoch die Verwendung von Festelektrolyten, die unter extremen Temperaturen arbeiten können und Stabilität und verbesserte Leistung bieten. Diese Festelektrolyte könnten Batterien mit hoher Energiedichte eine wesentlich längere Lebensdauer ermöglichen, so dass sie sich für eine Vielzahl von Anwendungen eignen, von Elektrofahrzeugen bis hin zur Netzspeicherung.
Energieeffizienz und Nachhaltigkeit
Die Verbesserung der Energieeffizienz von Elektrolysezellen ist ein weiterer wichtiger Schwerpunktbereich. Dazu gehört die Optimierung der elektrischen und chemischen Prozesse innerhalb der Zelle, um Energieverluste zu verringern und die Gesamtleistung zu verbessern. Die Forscher befassen sich auch mit nachhaltigeren Materialien und Verfahren, um die Umweltauswirkungen von Elektrolysezellen zu verringern. Die Entwicklung von Elektrolyten auf Biobasis und das Recycling von Materialien, die in Elektrolysezellen verwendet werden, gewinnen als nachhaltige Alternativen an Zugkraft.
Schlussfolgerung
Die Zukunft der elektrolytische Zelltechnologie Die Zukunft der Elektrolysezellentechnologie ist vielversprechend, denn es zeichnen sich zahlreiche Innovationen ab, die die Haltbarkeit, Effizienz und Nachhaltigkeit verbessern werden. Fortschritte in der Elektrolytentwicklung, der Materialwissenschaft, dem Zelldesign und der Energieeffizienz ebnen den Weg für robustere und vielseitigere elektrolytische Zellen. Diese Entwicklungen dienen nicht nur der Bewältigung der technischen Herausforderungen, sondern tragen auch zu umfassenderen Umweltzielen bei, indem sie sauberere und nachhaltigere Energielösungen fördern. Da sich die Forschung weiter entwickelt, werden die Auswirkungen dieser Innovationen in verschiedenen Branchen spürbar sein, von der Energiespeicherung bis zur Metallraffination, und den Fortschritt in Richtung einer nachhaltigeren Zukunft vorantreiben.
Ähnliche Produkte
- Flache Korrosions-Elektrolysezelle
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Dünnschicht-Spektroelektrochemische Zelle
- Doppelte Wasserbad-Elektrolysezelle
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
Ähnliche Artikel
- Fortgeschrittene Techniken zur Bewertung von Beschichtungen mit elektrolytischen Zellen
- Elektroden und elektrochemische Zellen verstehen
- So stellen Sie Ihre eigene Ag/AgCl-Referenzelektrode für elektrochemische Experimente her
- Erforschung des multifunktionalen Elektrolysezellen-Wasserbads: Anwendungen und Vorteile
- Gesättigte Kalomel-Referenzelektroden verstehen: Zusammensetzung, Einsatzmöglichkeiten und Überlegungen
















