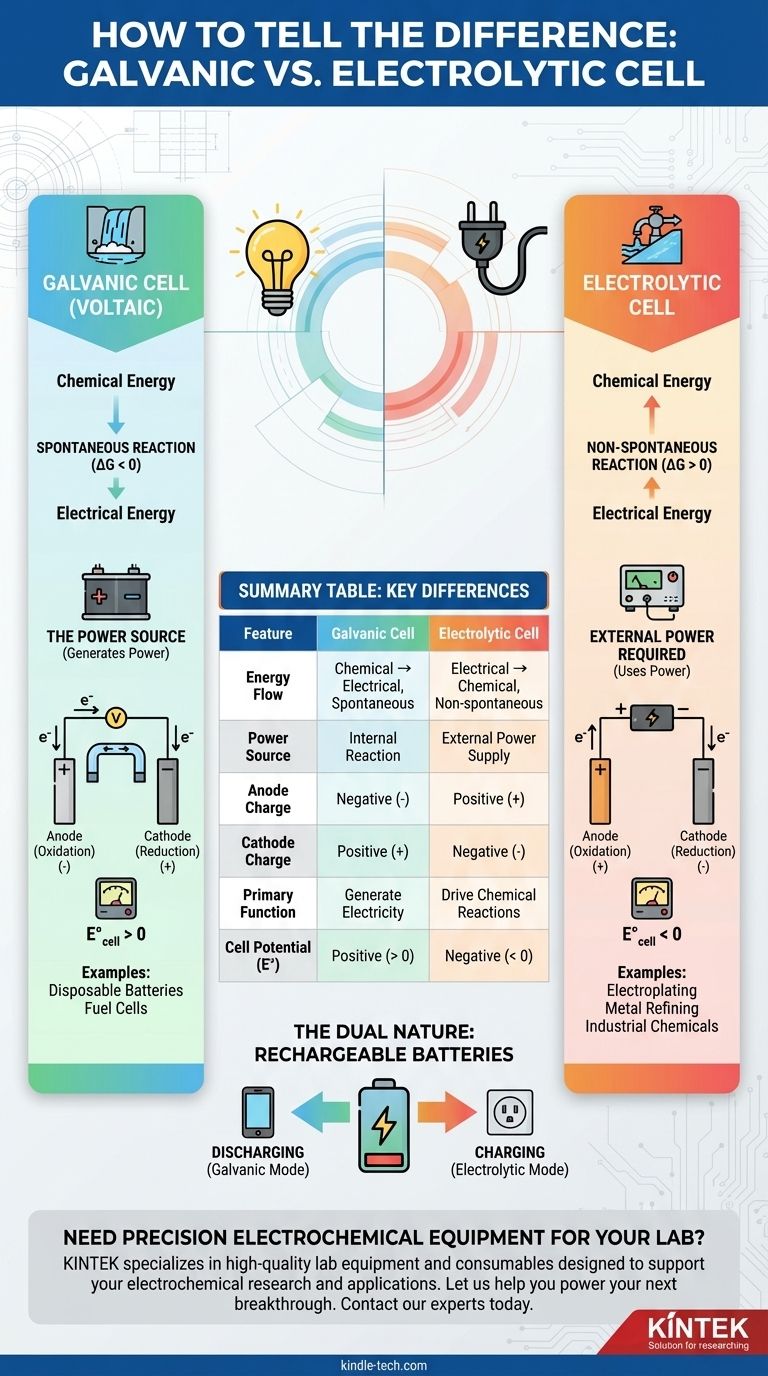
Der grundlegende Unterschied zwischen einer galvanischen und einer elektrolytischen Zelle liegt im Energiefluss. Eine galvanische Zelle, auch Voltasche Säule genannt, nutzt eine spontane chemische Reaktion, um elektrische Energie zu erzeugen. Im Gegensatz dazu wird eine elektrolytische Zelle mit externer elektrischer Energie betrieben, um eine nicht-spontane chemische Reaktion zu erzwingen.
Stellen Sie es sich so vor: Eine galvanische Zelle ist wie ein Wasserfall, der Strom erzeugt, während er natürlich bergab fließt. Eine elektrolytische Zelle ist wie eine Pumpe, die externe Energie nutzt, um Wasser gegen die Schwerkraft wieder bergauf zu befördern.

Das Kernprinzip: Spontaneität und Energieumwandlung
Das Verhalten jeder elektrochemischen Zelle wird dadurch bestimmt, ob ihre innere Reaktion von selbst abläuft oder externe Eingriffe erfordert.
Galvanische Zellen: Freisetzung chemischer Energie
Eine galvanische Zelle ist durch eine spontane Redoxreaktion gekennzeichnet. Das bedeutet, die Reaktion findet von selbst statt und setzt dabei Energie frei.
Dieser Prozess wandelt gespeicherte chemische Energie direkt in elektrische Energie um. Die Zelle selbst ist die Energiequelle.
Thermodynamisch entspricht dies einer negativen freien Enthalpie (ΔG < 0) und einem positiven Zellpotenzial (E°_cell > 0).
Elektrolytische Zellen: Zufuhr elektrischer Energie
Eine elektrolytische Zelle beinhaltet eine nicht-spontane Reaktion. Ohne einen äußeren Anstoß würde diese Reaktion nicht ablaufen.
Sie benötigt eine externe Energiequelle, wie eine Batterie oder eine Gleichstromversorgung, um die Reaktion voranzutreiben. Dieser Prozess wandelt elektrische Energie in chemische Energie um.
Dies entspricht einer positiven freien Enthalpie (ΔG > 0) und einem negativen Zellpotenzial (E°_cell < 0). Die externe Spannung muss größer sein als dieses negative Potenzial, um die Reaktion zu erzwingen.
So identifizieren Sie jede Zelle: Schlüsselindikatoren
Abgesehen von der Richtung des Energieflusses können Sie die beiden Zellen anhand der Elektrodenpolarität und des gesamten Stromkreises unterscheiden.
Die Energiequelle
Dies ist der einfachste Indikator. Wenn die elektrochemische Zelle die Batterie ist, die ein Gerät mit Strom versorgt, handelt es sich um eine galvanische Zelle.
Wenn die Zelle an eine externe Batterie oder Stromversorgung angeschlossen ist, handelt es sich um eine elektrolytische Zelle. Die externe Quelle liefert die Energie, um den Prozess anzutreiben.
Elektrodenpolarität (Häufiger Verwechslungspunkt)
Die Definitionen von Anode und Kathode sind für beide Zelltypen konstant:
- Anode: Die Elektrode, an der die Oxidation stattfindet.
- Kathode: Die Elektrode, an der die Reduktion stattfindet.
Allerdings ändert sich ihre positive/negative Ladung (Polarität):
In einer galvanischen Zelle setzt die spontane Reaktion an der Anode Elektronen frei, wodurch sie zum negativen (-) Pol wird. Die Kathode, die Elektronen aufnimmt, ist der positive (+) Pol.
In einer elektrolytischen Zelle bestimmt die externe Stromquelle die Polarität. Sie zieht Elektronen von der Anode weg, wodurch diese zum positiven (+) Pol wird, und drückt Elektronen zur Kathode, wodurch diese zum negativen (-) Pol wird.
Häufige Anwendungen und Fallstricke
Der Zweck der Zelle ist ihr praktischster Unterscheidungsfaktor. Die eine erzeugt Strom, während die andere Strom nutzt, um eine Substanz oder Veränderung zu erzeugen.
Der Zweck einer galvanischen Zelle
Die einzige Funktion einer galvanischen Zelle besteht darin, als Quelle für elektrische Energie zu dienen.
Häufige Beispiele sind Einwegbatterien (AA, AAA), Brennstoffzellen und die Hauptfunktion einer Autobatterie beim Starten des Motors.
Der Zweck einer elektrolytischen Zelle
Das Ziel einer elektrolytischen Zelle ist es, eine nützliche chemische Umwandlung zu erzwingen, die sonst nicht stattfinden würde.
Typische Anwendungen sind die galvanische Beschichtung einer dünnen Metallschicht auf einer Oberfläche, die Raffination von Metallen wie Kupfer und Aluminium sowie die Herstellung von Industriechemikalien wie Chlorgas.
Die Doppelrolle wiederaufladbarer Batterien
Eine wiederaufladbare Batterie ist das perfekte Beispiel für beide Zelltypen in einem Gerät.
- Beim Entladen (Betrieb Ihres Telefons): Sie fungiert als galvanische Zelle, bei der eine spontane Reaktion Elektrizität erzeugt.
- Beim Laden (an die Steckdose angeschlossen): Sie fungiert als elektrolytische Zelle, bei der externe Energie die nicht-spontane Rückreaktion erzwingt, um Energie zu speichern.
Die richtige Unterscheidung für Ihr Ziel treffen
Um schnell festzustellen, mit welcher Zelle Sie es zu tun haben, konzentrieren Sie sich auf den Energiefluss und das Gesamtziel des Systems.
- Wenn Ihr Hauptaugenmerk auf der Stromerzeugung liegt: Sie haben es mit einer galvanischen Zelle zu tun, bei der eine spontane Reaktion Energie freisetzt.
- Wenn Ihr Hauptaugenmerk auf der Erzeugung einer Substanz oder der Umkehrung einer Reaktion liegt: Sie verwenden eine elektrolytische Zelle, die eine externe Stromquelle benötigt, um einen nicht-spontanen Prozess anzutreiben.
- Wenn Sie die Vorzeichen der Elektroden analysieren: Denken Sie daran, dass bei einer galvanischen Zelle die Anode negativ ist, während sie bei einer elektrolytischen Zelle positiv ist, da die Energiequelle entweder intern oder extern ist.
Letztendlich ist das Verständnis, ob Energie ein Produkt oder eine Voraussetzung ist, der Schlüssel zur Unterscheidung dieser beiden grundlegenden elektrochemischen Zellen.
Zusammenfassungstabelle:
| Merkmal | Galvanische Zelle | Elektrolytische Zelle |
|---|---|---|
| Energiefluss | Chemisch → Elektrisch (Spontan) | Elektrisch → Chemisch (Nicht-spontan) |
| Energiequelle | Interne Reaktion | Externe Stromversorgung |
| Anodenladung | Negativ (-) | Positiv (+) |
| Kathodenladung | Positiv (+) | Negativ (-) |
| Hauptfunktion | Stromerzeugung | Antrieb chemischer Reaktionen (z. B. Galvanik) |
| Zellpotenzial (E°) | Positiv (> 0) | Negativ (< 0) |
Präzise elektrochemische Geräte für Ihr Labor benötigt?
Das Verständnis der Feinheiten von galvanischen und elektrolytischen Zellen ist entscheidend für fortgeschrittene Laborarbeiten. Ob Sie neue Batterietechnologien entwickeln, Galvanisierungen durchführen oder Materialanalysen durchführen – die richtige Ausrüstung ist unerlässlich.
KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, die Ihre elektrochemische Forschung und Anwendungen unterstützen. Wir bieten zuverlässige Lösungen, die genaue Ergebnisse gewährleisten und die Effizienz Ihres Labors steigern.
Lassen Sie uns Ihnen helfen, Ihren nächsten Durchbruch voranzutreiben. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Laboranforderungen zu besprechen und herauszufinden, wie unsere Produkte Ihren Erfolg fördern können.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Ausrüstung für Batterielabore Batterietestgerät für Kapazität und umfassende Tests
- Hydrophiles Kohlepapier TGPH060 für Batterie-Laboranwendungen
Andere fragen auch
- Wie sollten die Glaskomponenten einer Elektrolysezelle gehandhabt werden? Ein Leitfaden zur sicheren und effektiven Nutzung
- Welche Arten von Ionenaustauschmembranen können mit der H-Typ-Elektrolysezelle verwendet werden? Wählen Sie die beste Ionensperre aus
- Welche Verfahren und Beobachtungen sind bei einem Experiment mit einer Flachplatten-Korrosionselektrolysezelle notwendig? Meistern Sie die 3-Phasen-Methode
- Was ist der Unterschied zwischen Elektrolyt- und Elektrodenzelle? Beherrschen Sie die Grundlagen elektrochemischer Systeme
- Wie sollte die H-Typ-Elektrolysezelle angeschlossen werden? Experteinrichtungsanleitung für präzise elektrochemische Experimente
- Wie kann die elektrochemische Reaktion bei Verwendung dieser Elektrolysezelle gesteuert werden? Spannung, Strom & Elektrolyt meistern
- Wie wird eine Elektrolysezelle auch genannt? Elektrolytische vs. galvanische Zellen verstehen
- Wie ist das korrekte Vorgehen beim Trennen einer H-Typ-Elektrolysezelle nach einem Experiment? Sicherheit und Langlebigkeit der Ausrüstung gewährleisten




