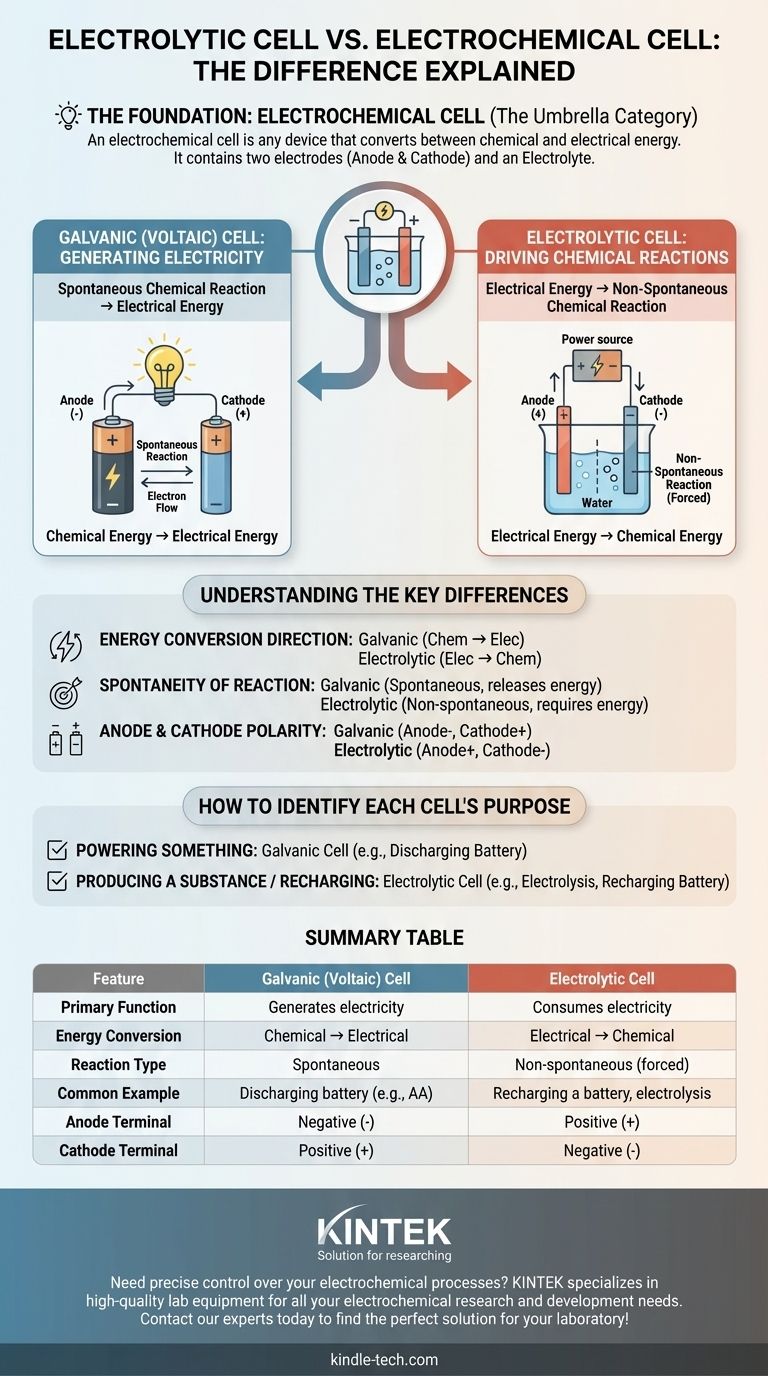
Die Hauptursache für Verwirrung ist, dass eine Elektrolysezelle kein separates Konzept von einer elektrochemischen Zelle ist – sie ist eine der beiden Haupt-Typen elektrochemischer Zellen. Eine elektrochemische Zelle ist die übergeordnete Kategorie für jedes Gerät, das chemische und elektrische Energie ineinander umwandelt. Der eigentliche Unterschied liegt zwischen galvanischen (voltaischen) Zellen, die Strom aus chemischen Reaktionen erzeugen, und Elektrolysezellen, die Strom nutzen, um chemische Reaktionen hervorzurufen.
Der Begriff elektrochemische Zelle ist die übergeordnete Kategorie. Die beiden spezifischen Typen unter diesem Oberbegriff sind galvanische Zellen (die Elektrizität erzeugen) und Elektrolysezellen (die Elektrizität verbrauchen). Ihr grundlegender Unterschied ist die Richtung der Energieumwandlung.

Die Grundlage: Was ist eine elektrochemische Zelle?
Kernkomponenten
Eine elektrochemische Zelle ist jedes Gerät, das zwei Elektroden (eine Anode und eine Kathode) und einen Elektrolyten enthält. Diese Komponenten arbeiten zusammen, um den Elektronentransfer zu ermöglichen, entweder einen elektrischen Strom zu erzeugen oder zu verbrauchen.
Der übergeordnete Zweck
Der einzige Zweck einer elektrochemischen Zelle ist es, als Brücke zwischen chemischer Energie und elektrischer Energie zu dienen. Die Richtung dieser Energieumwandlung bestimmt den spezifischen Zelltyp.
Die zwei grundlegenden Umwandlungsarten
Galvanische (voltaische) Zellen: Stromerzeugung
Eine galvanische Zelle, auch als voltaische Zelle bekannt, nutzt eine spontane chemische Reaktion, um elektrische Energie zu erzeugen.
Denken Sie an eine Standard-AA-Batterie. Die chemischen Materialien darin reagieren auf natürliche Weise und setzen Energie in Form eines elektrischen Stroms frei, der ein Gerät antreiben kann. Dies ist eine galvanische Zelle in Aktion.
Elektrolysezellen: Antreiben chemischer Reaktionen
Eine Elektrolysezelle tut genau das Gegenteil. Sie nutzt eine externe elektrische Energiequelle (wie ein Netzteil), um eine nicht-spontane chemische Reaktion zu erzwingen.
Ein häufiges Beispiel ist die Elektrolyse, wie die Spaltung von Wasser in Wasserstoff und Sauerstoff. Diese Reaktion findet nicht von selbst statt; sie erfordert eine konstante Zufuhr von Elektrizität, was die Funktion der Elektrolysezelle ist. Das Aufladen einer Batterie ist ein weiteres Beispiel für diesen Prozess.
Die wichtigsten Unterschiede verstehen
Richtung der Energieumwandlung
Dies ist der wichtigste Unterschied. Eine galvanische Zelle wandelt gespeicherte chemische Energie in elektrische Energie um. Eine Elektrolysezelle wandelt zugeführte elektrische Energie in chemische Energie um.
Spontanität der Reaktion
Die chemische Reaktion in einer galvanischen Zelle ist spontan – sie läuft natürlich ab und setzt Energie frei.
Die Reaktion in einer Elektrolysezelle ist nicht-spontan – sie erfordert eine konstante Zufuhr externer Energie, um abzulaufen.
Polarität von Anode und Kathode
Dies ist ein häufiger Punkt der Verwirrung, ergibt sich aber logisch aus dem Energiefluss.
In einer galvanischen Zelle (entladende Batterie) ist die Anode die Quelle der Elektronen, was sie zum negativen Pol macht, während die Kathode der positive Pol ist.
In einer Elektrolysezelle (aufladende Batterie) kehrt eine externe Stromquelle den Fluss um. Die Anode ist immer noch der Ort, an dem Oxidation stattfindet, wird aber gezwungen, der positive Pol zu sein, und die Kathode ist der negative Pol.
Wie man den Zweck jeder Zelle identifiziert
Nutzen Sie die primäre Funktion der Zelle als Leitfaden, um die beiden Typen leicht zu unterscheiden.
- Wenn das Hauptziel darin besteht, etwas zu betreiben: Sie verwenden eine galvanische (voltaische) Zelle, da eine spontane chemische Reaktion Elektrizität erzeugt.
- Wenn das Hauptziel darin besteht, eine Substanz zu produzieren oder eine Batterie aufzuladen: Sie verwenden eine Elektrolysezelle, da Elektrizität verbraucht wird, um eine chemische Reaktion zu erzwingen.
Letztendlich sind beide einfach zwei Seiten derselben elektrochemischen Medaille, definiert dadurch, ob sie elektrische Energie erzeugen oder verbrauchen.
Zusammenfassungstabelle:
| Merkmal | Galvanische (voltaische) Zelle | Elektrolysezelle |
|---|---|---|
| Primäre Funktion | Erzeugt Elektrizität | Verbraucht Elektrizität |
| Energieumwandlung | Chemisch → Elektrisch | Elektrisch → Chemisch |
| Reaktionstyp | Spontan | Nicht-spontan (erzwungen) |
| Häufiges Beispiel | Entladende Batterie (z.B. AA) | Aufladen einer Batterie, Elektrolyse |
| Anodenpol | Negativ (-) | Positiv (+) |
| Kathodenpol | Positiv (+) | Negativ (-) |
Benötigen Sie präzise Kontrolle über Ihre elektrochemischen Prozesse? KINTEK ist spezialisiert auf hochwertige Laborausrüstung für all Ihre elektrochemischen Forschungs- und Entwicklungsanforderungen. Ob Sie neue Batterietechnologien entwickeln oder Materialien mittels Elektrolyse synthetisieren, unsere zuverlässigen Instrumente gewährleisten genaue und reproduzierbare Ergebnisse. Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für Ihr Labor zu finden!
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Welche optischen Merkmale weist die H-Typ-Elektrolysezelle auf? Präzisions-Quarzglasfenster für die Photoelektrochemie
- Wie lauten die standardmäßigen Öffnungsspezifikationen für eine austauschbare Membran-Elektrolysezelle vom H-Typ? Asymmetrische Anschlüsse für präzise Elektrochemie
- Wie ist die Gesamtstruktur der optischen H-Typ-Doppelschicht-Wasserbad-Elektrolysezelle aufgebaut? Präzisionsdesign für kontrollierte Experimente
- Was sind die typischen Volumina und Öffnungskonfigurationen für eine doppelwandige Wasserbad-Elektrolysezelle? Optimieren Sie Ihr elektrochemisches Setup
- Was ist eine H-Zelle? Ein Leitfaden für geteilte elektrochemische Zellen für präzise Experimente



















