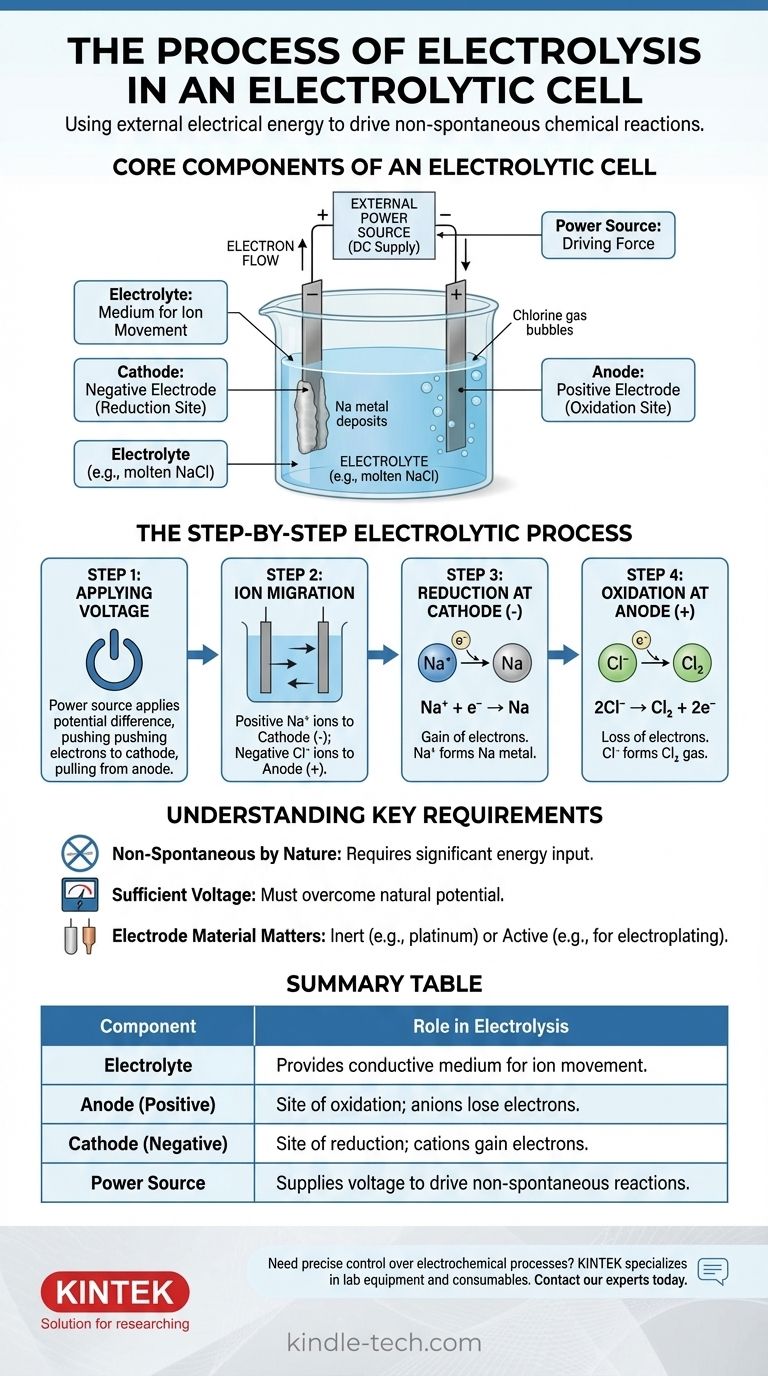
Im Wesentlichen ist die Elektrolyse der Prozess, bei dem elektrische Energie genutzt wird, um eine chemische Reaktion zu erzwingen, die von selbst nicht ablaufen würde. Eine externe Stromquelle legt eine Spannung an zwei Elektroden an, die in eine leitfähige Lösung oder ein geschmolzenes Salz, den Elektrolyten, eingetaucht sind. Diese zugeführte Energie zwingt Ionen zu den entgegengesetzt geladenen Elektroden zu wandern, wo sie durch Oxidations- und Reduktionsreaktionen zersetzt werden.
Eine galvanische Zelle ist ein Motor zur Umkehrung chemischer Reaktionen. Durch Anlegen einer externen Spannung wird der Elektronenfluss gegen ihre natürliche Tendenz erzwungen, wodurch stabile chemische Verbindungen gezwungen werden, in ihre Bestandteile zu zerfallen.

Die Kernkomponenten einer galvanischen Zelle
Um den Prozess zu verstehen, müssen Sie zunächst die Funktion jedes Teils kennen. Das System ist ein sorgfältig orchestriertes Zusammenspiel zwischen drei Schlüsselkomponenten.
Der Elektrolyt: Ein Medium für die Ionenbewegung
Der Elektrolyt ist eine Substanz, die frei bewegliche Ionen enthält und sie dadurch elektrisch leitfähig macht. Es handelt sich typischerweise um eine geschmolzene Ionenverbindung, wie Natriumchlorid (NaCl), oder eine wässrige Lösung, die gelöste Ionen enthält.
Der einzige Zweck des Elektrolyten ist es, ein Medium bereitzustellen, durch das geladene Ionen zwischen den Elektroden wandern können.
Die Elektroden: Anode und Kathode
Die Elektroden sind leitfähige Materialien (oft Metalle oder Graphit), die in den Elektrolyten eingetaucht sind. Sie dienen als physikalische Schnittstelle, an der der elektrische Stromkreis auf die chemische Lösung trifft.
In einer galvanischen Zelle wird die Polarität durch die externe Stromquelle definiert:
- Die Anode ist die positive Elektrode.
- Die Kathode ist die negative Elektrode.
Die externe Stromquelle: Die treibende Kraft
Dies ist typischerweise eine Batterie oder eine Gleichstromquelle. Ihre Aufgabe ist es, eine Potentialdifferenz zwischen den Elektroden zu erzeugen und Elektronen in eine Richtung zu zwingen, in die sie nicht spontan fließen würden.
Diese externe Spannung ist die „Pumpe“, die die gesamte nicht-spontane Reaktion antreibt und die natürliche chemische Stabilität des Elektrolyten überwindet.
Der Schritt-für-Schritt-Elektrolyseprozess
Der Prozess entfaltet sich in einer präzisen Abfolge, sobald die Stromquelle aktiviert wird. Wir können dies am Beispiel von geschmolzenem Natriumchlorid (NaCl) veranschaulichen.
Schritt 1: Anlegen der Spannung
Eine externe Spannung wird angelegt. Die Stromquelle drückt Elektronen zu einer Elektrode, wodurch diese negativ geladen wird (die Kathode), und zieht Elektronen von der anderen weg, wodurch diese positiv geladen wird (die Anode).
Schritt 2: Ionenwanderung
Innerhalb des geschmolzenen NaCl-Elektrolyten liegt Natrium als positive Ionen (Kationen, Na⁺) und Chlor als negative Ionen (Anionen, Cl⁻) vor.
Gegensätze ziehen sich an: Die positiven Na⁺-Kationen werden zur negativen Kathode gezogen, während die negativen Cl⁻-Anionen zur positiven Anode gezogen werden.
Schritt 3: Reduktion an der Kathode (der negativen Elektrode)
Wenn die Na⁺-Kationen die negativ geladene Kathode erreichen, nehmen sie jeweils ein von der Stromquelle geliefertes Elektron auf. Diese Elektronenaufnahme ist eine Reduktionsreaktion.
Die Na⁺-Ionen werden reduziert, um neutrales Natriummetall (Na) zu bilden, das sich an der Kathode abscheidet.
Schritt 4: Oxidation an der Anode (der positiven Elektrode)
Gleichzeitig geben die Cl⁻-Anionen, wenn sie die positiv geladene Anode erreichen, jeweils ein Elektron an die Elektrode ab. Dieser Elektronenverlust ist eine Oxidationsreaktion.
Die Cl⁻-Ionen werden oxidiert, um neutrale Chloratome zu bilden, die sich zu Chlorgas (Cl₂) verbinden, welches von der Anode wegperlt. Die freigesetzten Elektronen wandern durch den externen Stromkreis zurück zur Stromquelle und schließen den Stromkreis.
Verständnis der Schlüsselanforderungen
Die Elektrolyse ist zwar wirkungsvoll, unterliegt aber bestimmten Einschränkungen. Werden diese ignoriert, kann dies zu fehlgeschlagenen Experimenten oder einem Missverständnis der Ergebnisse führen.
Von Natur aus nicht-spontan
Das Kernprinzip besteht darin, dass die Elektrolyse eine nicht-spontane Reaktion erzwingt. Die Zersetzung von Salz in Natriummetall und Chlorgas erfordert beispielsweise einen erheblichen Energieaufwand. Ohne die externe Spannung würde nichts passieren.
Die Notwendigkeit einer ausreichenden Spannung
Die externe Stromquelle muss eine Spannung liefern, die hoch genug ist, um das natürliche Potenzial der chemischen Reaktion zu überwinden. Ist die Spannung zu niedrig, reicht sie nicht aus, um die Ionenwanderung und den Elektronentransfer zu erzwingen, und die Reaktion läuft nicht ab.
Das Elektrodenmaterial ist wichtig
Für die einfache Zersetzung werden inerte Elektroden (wie Platin oder Kohlenstoff) verwendet. Diese Materialien erleichtern den Elektronentransfer, ohne selbst an der Reaktion teilzunehmen. Bei anderen Anwendungen, wie der Galvanisierung, kann die Anode eine „aktive“ Elektrode sein, die dazu bestimmt ist, oxidiert und in den Elektrolyten aufgelöst zu werden.
Anwendung auf gängige Beispiele
Die Prinzipien der Elektrolyse sind universell, aber die spezifischen Produkte hängen vollständig vom verwendeten Elektrolyten ab.
- Wenn Ihr Ziel die Herstellung reiner Metalle ist: Verwenden Sie ein geschmolzenes Salz dieses Metalls als Elektrolyten. Das reine Metall wird an der Kathode reduziert und abgeschieden, wie bei der industriellen Herstellung von Natrium und Aluminium.
- Wenn Ihr Ziel die Zersetzung von Wasser ist: Verwenden Sie Wasser mit einer kleinen Menge Säure oder Salz, um die Leitfähigkeit zu verbessern. Dieser Prozess erzeugt Wasserstoffgas (H₂) an der Kathode und Sauerstoffgas (O₂) an der Anode.
- Wenn Ihr Ziel die Galvanisierung eines Objekts ist: Das zu beschichtende Objekt wird als Kathode eingestellt. Metallionen aus der Elektrolytlösung werden auf der Oberfläche des Objekts reduziert und bilden eine dünne, gleichmäßige Metallbeschichtung.
Durch die Steuerung des Elektronenflusses können wir chemische Prozesse direkt steuern und umkehren, eine grundlegende Fähigkeit, die einen Großteil der modernen Industrie untermauert.
Zusammenfassungstabelle:
| Komponente | Rolle bei der Elektrolyse |
|---|---|
| Elektrolyt | Bietet leitfähiges Medium für die Ionenbewegung (z. B. geschmolzenes NaCl). |
| Anode (Positiv) | Ort der Oxidation; Anionen verlieren Elektronen (z. B. Cl⁻ → Cl₂ Gas). |
| Kathode (Negativ) | Ort der Reduktion; Kationen nehmen Elektronen auf (z. B. Na⁺ → Na Metall). |
| Stromquelle | Liefert Spannung, um nicht-spontane Reaktionen anzutreiben. |
Benötigen Sie präzise Kontrolle über elektrochemische Prozesse? KINTEK ist spezialisiert auf Laborgeräte und Verbrauchsmaterialien für Elektrolyse, Galvanisierung und Materialsynthese. Unsere zuverlässigen Netzteile, Elektroden und Elektrolytlösungen helfen Ihnen, konsistente Ergebnisse zu erzielen – sei es bei der Zersetzung von Verbindungen, der Raffination von Metallen oder der Beschichtung von Oberflächen. Kontaktieren Sie noch heute unsere Experten, um die spezifischen Anforderungen Ihres Labors zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Anpassbare CO2-Reduktions-Flowzelle für NRR-, ORR- und CO2RR-Forschung
- Li-Luft-Batteriegehäuse für Batterie-Laboranwendungen
Andere fragen auch
- Welche Volumina und Abmessungen sind für die Elektrolysezelle aus Quarz erhältlich? Finden Sie die perfekte Lösung für Ihr Labor
- Wie sollte eine Elektrolysezelle aus reinem Quarz und ihre Komponenten für eine langfristige Nutzung gewartet werden? Ein Leitfaden zur Maximierung der Lebensdauer der Ausrüstung
- Warum wird eine Quarz-Elektrolysezelle für Abwasser aus Acrylsäure verwendet? Gewährleistung chemischer Stabilität & Datenintegrität
- Welche Vorsichtsmaßnahmen sollten beim Handhaben und Verwenden einer Elektrolysezelle aus Quarzglas getroffen werden? Gewährleistung einer sicheren, genauen und dauerhaften Leistung
- Wie ist das korrekte Verfahren für die Nachbereitung und Lagerung einer Elektrolysezelle aus Quarzglas nach dem Experiment? Langlebigkeit und Reproduzierbarkeit gewährleisten



















