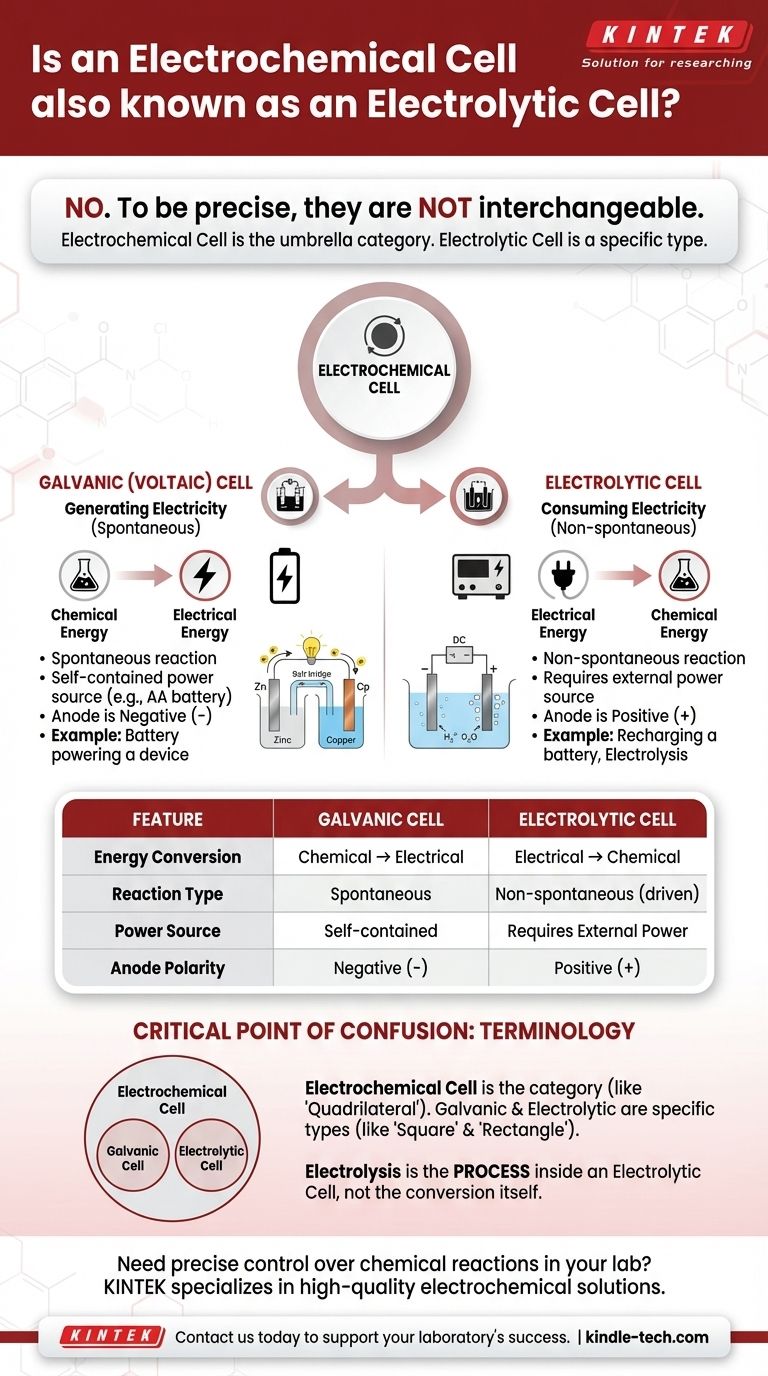
Genau genommen, nein. Eine galvanische Zelle ist ein spezifischer Typ der elektrochemischen Zelle, aber die beiden Begriffe sind nicht austauschbar. „Elektrochemische Zelle“ ist die allgemeine Oberkategorie für jedes Gerät, das chemische Energie in elektrische Energie umwandelt oder umgekehrt. Galvanische Zellen sind die Art, die spontan chemische Energie nutzt, um Elektrizität zu erzeugen.
Der Kernunterschied liegt in der Richtung der Energieumwandlung. Eine galvanische (oder voltaische) Zelle setzt spontan Energie aus einer chemischen Reaktion frei, um Elektrizität zu erzeugen. Eine elektrolytische Zelle verbraucht Elektrizität aus einer externen Quelle, um eine chemische Reaktion zu erzwingen.

Der grundlegende Unterschied: Energiefluss
Der Zweck einer elektrochemischen Zelle bestimmt ihre Klassifizierung. Die Hauptfrage, die man stellen muss, ist, ob die Zelle Energie erzeugt oder verbraucht.
Galvanische (voltaische) Zellen: Stromerzeugung
Eine galvanische Zelle, auch bekannt als voltaische Zelle, nutzt eine spontane chemische Reaktion.
Die Reaktanten in der Zelle haben eine natürliche Tendenz zu reagieren und setzen dabei Energie frei. Diese Energie wird als elektrischer Strom erfasst.
Stellen Sie sich eine handelsübliche AA-Batterie in einer Fernbedienung vor. Sie ist eine galvanische Zelle, die ihre interne chemische Energie in die elektrische Energie umwandelt, die zur Stromversorgung der Fernbedienung erforderlich ist.
Elektrolytische Zellen: Stromverbrauch
Eine elektrolytische Zelle verwendet eine externe Quelle elektrischer Energie (wie ein Netzteil), um eine nicht-spontane chemische Reaktion anzutreiben.
Ohne diese externe Stromversorgung würde die chemische Reaktion nicht von selbst ablaufen. Der Strom zwingt die Reaktion, sich gegen ihre natürliche Tendenz durchzusetzen.
Ein häufiges Beispiel ist die Elektrolyse, wie die Spaltung von Wasser in Wasserstoff- und Sauerstoffgas. Ein weiteres ist das Aufladen einer Lithium-Ionen-Batterie; dabei wird Elektrizität verwendet, um die Entladungsreaktion umzukehren und ihr chemisches Potenzial wiederherzustellen.
Wichtige Kennzeichen für jeden Zelltyp
Über die Richtung des Energieflusses hinaus helfen einige technische Merkmale, die beiden Zelltypen zu unterscheiden.
Die Rolle einer externen Stromquelle
Dies ist der einfachste Indikator. Wenn ein Gerät in sich geschlossen ist und als Energiequelle fungiert, handelt es sich um eine galvanische Zelle.
Wenn das Gerät an eine externe Stromquelle angeschlossen werden muss, um zu funktionieren, handelt es sich um eine elektrolytische Zelle.
Anoden- und Kathodenpolarität
Obwohl die Definitionen von Anode (wo Oxidation stattfindet) und Kathode (wo Reduktion stattfindet) konstant bleiben, kehrt sich ihre elektrische Ladung (Polarität) zwischen den beiden Zelltypen um.
In einer galvanischen Zelle ist die Anode der negative (-) Pol und die Kathode der positive (+) Pol.
In einer elektrolytischen Zelle kehrt die externe Stromquelle dies um. Die Anode wird zum positiven (+) Pol und die Kathode zum negativen (-) Pol.
Der kritische Punkt der Verwirrung: Terminologie
Die Hauptursache für die Verwirrung liegt in der Überschneidung, aber unterschiedlichen Natur der Begriffe. Die Nichtbeachtung der Unterscheidung führt zu grundlegenden Missverständnissen.
„Elektrochemische Zelle“ ist der Oberbegriff
Betrachten Sie „elektrochemische Zelle“ als die allgemeine Kategorie, ähnlich wie „Viereck“.
Galvanische Zellen und elektrolytische Zellen sind die spezifischen Typen innerhalb dieser Kategorie, ähnlich wie „Quadrat“ und „Rechteck“ spezifische Arten von Vierecken sind. Eine elektrolytische Zelle ist immer eine elektrochemische Zelle, aber nicht alle elektrochemischen Zellen sind elektrolytisch.
Die falsche Verwendung von „Elektrolyse“
Elektrolyse ist der Prozess der Verwendung von Elektrizität zur Durchführung einer chemischen Reaktion. Dieser Prozess findet in einer elektrolytischen Zelle statt.
Einige Definitionen besagen fälschlicherweise, dass Elektrolyse die Umwandlung von chemischer in elektrische Energie ist. Das ist das Gegenteil der Wahrheit. Bei der Elektrolyse geht es im Grunde darum, Elektrizität zu nutzen, um eine chemische Veränderung herbeizuführen.
Die richtige Unterscheidung für Ihr Ziel treffen
Um dieses Wissen korrekt anzuwenden, identifizieren Sie einfach die Hauptfunktion des Geräts, das Sie analysieren.
- Wenn Ihr Fokus auf einem Gerät liegt, das etwas mit Strom versorgt (eine Fernbedienung, ein Telefon, eine Uhr): Sie haben es mit einer galvanischen (voltaischen) Zelle zu tun, die gespeicherte chemische Energie in Elektrizität umwandelt.
- Wenn Ihr Fokus auf einem Prozess liegt, der Elektrizität nutzt, um eine Substanz zu erzeugen (Aufladen einer Batterie, Plattieren von Metall, Erzeugen von Chlorgas): Sie haben es mit einer elektrolytischen Zelle zu tun, die elektrische Energie nutzt, um eine chemische Veränderung zu erzwingen.
- Wenn Sie das allgemeine Feld oder ein Gerät mit doppelter Funktionalität beschreiben (wie eine wiederaufladbare Batterie): Der Begriff „elektrochemische Zelle“ ist die korrekte und umfassendste Wahl.
Das Verständnis der Richtung der Energieumwandlung ist der Schlüssel zur Beherrschung dieses grundlegenden Konzepts in Chemie und Ingenieurwesen.
Zusammenfassungstabelle:
| Merkmal | Galvanische (voltaische) Zelle | Elektrolytische Zelle |
|---|---|---|
| Energieumwandlung | Chemisch → Elektrisch | Elektrisch → Chemisch |
| Reaktionstyp | Spontan | Nicht-spontan (erzwungen) |
| Stromquelle | Eigenständig (z. B. Batterie) | Benötigt externe Stromversorgung |
| Anodenpolarität | Negativer (-) Pol | Positiver (+) Pol |
| Häufiges Beispiel | AA-Batterie in einer Fernbedienung | Aufladen einer Lithium-Ionen-Batterie |
Benötigen Sie eine präzise Kontrolle über chemische Reaktionen in Ihrem Labor? Das Verständnis der richtigen Art von elektrochemischer Zelle ist entscheidend für Ihre Forschung und Prozesse. Bei KINTEK sind wir spezialisiert auf die Bereitstellung hochwertiger Laborausrüstung und Verbrauchsmaterialien, die auf Ihre spezifischen elektrochemischen Bedürfnisse zugeschnitten sind. Ob Sie mit galvanischen Zellen zur Energieerzeugung oder mit elektrolytischen Zellen zur Synthese arbeiten, unsere Lösungen gewährleisten Genauigkeit und Zuverlässigkeit. Kontaktieren Sie uns noch heute, um zu besprechen, wie wir den Erfolg Ihres Labors unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Was ist der Zweck der Doppelglasschichtstruktur in der H-Typ-Elektrolysezelle? Präzise Temperaturregelung erreichen
- Wie lauten die standardmäßigen Öffnungsspezifikationen für eine austauschbare Membran-Elektrolysezelle vom H-Typ? Asymmetrische Anschlüsse für präzise Elektrochemie
- Wie ist die Gesamtstruktur der optischen H-Typ-Doppelschicht-Wasserbad-Elektrolysezelle aufgebaut? Präzisionsdesign für kontrollierte Experimente
- Welche optischen Merkmale weist die H-Typ-Elektrolysezelle auf? Präzisions-Quarzglasfenster für die Photoelektrochemie
- Was ist eine H-Zelle? Ein Leitfaden für geteilte elektrochemische Zellen für präzise Experimente



















