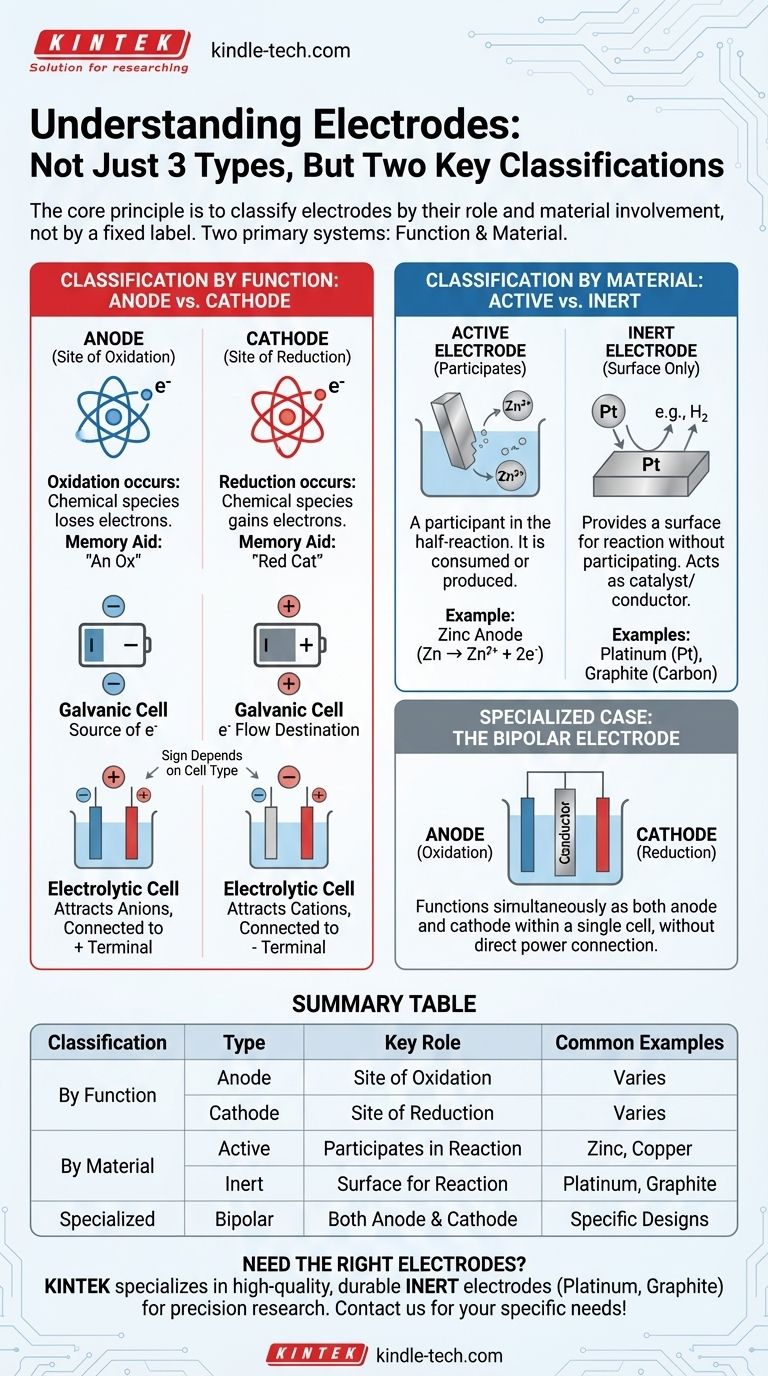
In der Elektrochemie versteht man Elektroden am besten nicht als drei unterschiedliche Typen, sondern anhand von zwei primären Klassifizierungssystemen. Das grundlegendste System definiert eine Elektrode nach ihrer Funktion: entweder als Anode, an der die Oxidation stattfindet, oder als Kathode, an der die Reduktion stattfindet. Ein zweites, ebenso wichtiges System klassifiziert sie nach ihrer Materialzusammensetzung und Rolle in der Reaktion: entweder als aktiv (an der Reaktion beteiligt) oder als inert (Oberfläche für die Reaktion bereitstellend).
Das Kernprinzip besteht darin, Elektroden nach ihrer Rolle zu klassifizieren, nicht nach einem festen Etikett. Die beiden wichtigsten Klassifizierungen basieren auf der Funktion (Anode vs. Kathode) und der Materialbeteiligung (Aktiv vs. Inert). Das Verständnis dieser beiden Paare ist der Schlüssel zur Analyse jeder elektrochemischen Zelle.

Klassifizierung nach Funktion: Anode vs. Kathode
Die grundlegendste Art, eine Elektrode zu definieren, ist der chemische Prozess, der an ihrer Oberfläche stattfindet. Diese Rolle kann sich je nach elektrischem Stromfluss ändern.
Die Anode: Ort der Oxidation
Die Anode ist als die Elektrode definiert, an der die Oxidation stattfindet. Dies ist ein Prozess, bei dem eine chemische Spezies Elektronen verliert.
Eine einfache Eselsbrücke ist „An Ox“ (Anode ist Oxidation).
Die Kathode: Ort der Reduktion
Die Kathode ist die Elektrode, an der die Reduktion stattfindet. Dies ist ein Prozess, bei dem eine chemische Spezies Elektronen aufnimmt.
Eine entsprechende Eselsbrücke ist „Red Cat“ (Reduktion an der Kathode).
Der kritische Unterschied: Vorzeichen vs. Funktion
Ein häufiger Verwirrungspunkt ist, ob Anode und Kathode positiv oder negativ sind. Dies hängt vollständig von der Art der elektrochemischen Zelle ab.
In einer galvanischen Zelle (wie einer Batterie)
Eine galvanische Zelle erzeugt Strom aus einer spontanen Reaktion.
- Die Anode ist der negative (-) Pol. Sie ist die Quelle der Elektronen aus der Oxidationsreaktion.
- Die Kathode ist der positive (+) Pol. Hierhin fließen die Elektronen, um die Reduktionsreaktion zu bewirken.
In einer Elektrolysezelle (z. B. beim Beschichten)
Eine Elektrolysezelle nutzt externen Strom, um eine nicht-spontane Reaktion anzutreiben.
- Die Anode ist der positive (+) Pol. Sie ist mit dem positiven Ende der Stromquelle verbunden und zieht Anionen an, die oxidiert werden sollen.
- Die Kathode ist der negative (-) Pol. Sie ist mit dem negativen Ende der Stromquelle verbunden und zieht Kationen an, die reduziert werden sollen.
Klassifizierung nach Material: Aktiv vs. Inert
Die zweite Hauptklassifizierung beschreibt, ob das Elektrodenmaterial selbst Teil der chemischen Reaktion ist.
Aktive Elektroden
Eine aktive Elektrode (oder reaktive Elektrode) ist ein Teilnehmer an der Halbreaktion. Sie besteht aus einem Material, das entweder oxidiert wird oder das Produkt einer Reduktion ist.
Zum Beispiel löst sich bei einer Zink-Kupfer-Batterie die Zinkanode physikalisch (oxidiert) zu Zinkionen auf (Zn → Zn²⁺ + 2e⁻). Die Elektrode selbst wird verbraucht.
Inerte Elektroden
Eine inerte Elektrode stellt lediglich eine Oberfläche bereit, an der Oxidation oder Reduktion stattfinden kann, ohne selbst an der Reaktion teilzunehmen. Sie fungiert als Katalysator und elektrischer Leiter.
Häufige inerte Elektroden sind Platin (Pt) und Graphit (Kohlenstoff). Sie werden verwendet, wenn die zu oxidierenden oder zu reduzierenden Spezies Ionen oder Gase in der Lösung sind.
Spezialfall: Die Bipolare Elektrode
Eine bipolare Elektrode ist ein spezialisierter Leiter, der in eine Elektrolytlösung eingebracht wird, ohne direkt an die Stromquelle angeschlossen zu sein.
Sie fungiert gleichzeitig als Anode auf der Seite, die der Hauptkathode zugewandt ist, und als Kathode auf der Seite, die der Hauptanode zugewandt ist, wodurch eine Reihe von Reaktionen innerhalb einer einzigen Zelle ermöglicht wird.
Die richtige Entscheidung treffen
Ihr Verständnis von Elektroden sollte Ihnen helfen, ein elektrochemisches System zu analysieren. Der „Typ“ der Elektrode wird durch ihren Kontext innerhalb der Zelle definiert.
- Wenn Sie eine Batterie (galvanische Zelle) analysieren: Identifizieren Sie den Ort der Oxidation als die negative Anode und den Ort der Reduktion als die positive Kathode.
- Wenn Sie einen elektrolytischen Prozess (z. B. Galvanik) analysieren: Identifizieren Sie die Elektrode, die an den positiven Pol angeschlossen ist, als Anode (Oxidation) und diejenige, die an den negativen Pol angeschlossen ist, als Kathode (Reduktion).
- Bei der Gestaltung eines Experiments: Sie müssen entscheiden, ob Sie eine aktive Elektrode benötigen, die an der Reaktion teilnimmt, oder eine inerte Elektrode, um lediglich eine Reaktion zwischen bereits in der Lösung vorhandenen Spezies zu erleichtern.
Indem Sie sich auf die Funktion und die Materialbeteiligung konzentrieren, können Sie das Verhalten jeder Elektrode in jedem elektrochemischen System genau beschreiben und vorhersagen.
Zusammenfassungstabelle:
| Klassifizierung | Typ | Schlüsselrolle | Häufige Beispiele |
|---|---|---|---|
| Nach Funktion | Anode | Ort der Oxidation (verliert Elektronen) | Variiert je nach Zelltyp |
| Kathode | Ort der Reduktion (nimmt Elektronen auf) | Variiert je nach Zelltyp | |
| Nach Material | Aktiv | Nimmt an der Reaktion teil | Zink, Kupfer |
| Inert | Stellt Oberfläche für Reaktion bereit (nicht reaktiv) | Platin, Graphit | |
| Spezialisiert | Bipolar | Fungiert sowohl als Anode als auch als Kathode | Wird in spezifischen Zellkonstruktionen verwendet |
Benötigen Sie die richtigen Elektroden für Ihre elektrochemische Anwendung? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich langlebiger inerter Elektroden aus Platin und Graphit, die für Präzision und Zuverlässigkeit in Ihrem Labor entwickelt wurden. Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Komponenten für Ihre Forschung oder Ihren Prozess unterstützen. Kontaktieren Sie uns noch heute, um Ihre spezifischen Anforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Gold-Elektrodenblech Gold-Elektrode
- Metall-Scheibenelektrode Elektrochemische Elektrode
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Goldplattierte Elektrode
Andere fragen auch
- Was ist eine RVC-Glaskohlenstoffplatte? Ein Hochleistungsmaterial für anspruchsvolle Anwendungen
- Was sind die Vorteile der Verwendung von Kohlenstoffvlies als Arbeitselektrode in BES? Maximierung der Biofilmleistung
- Warum ist die Auswahl einer hochwertigen Referenzelektrode für die elektrochemische Synthese entscheidend? | KINTEK
- Warum wird Platin bei epiduralen Elektroden verwendet? Überlegene Biokompatibilität & Elektrische Effizienz
- Welche Vorbehandlungsschritte sind vor der Verwendung einer RVC-Platte notwendig? Gewährleistung zuverlässiger Leistung und Datenintegrität
- Warum wird Molybdän-haltiger Edelstahl als Kathode für Fischmehl-Abwasser ausgewählt? Langlebiges & Stabiles Design
- Was ist die Referenzelektrode in der Potentiometrie? Der Schlüssel zu stabilen & genauen Messungen
- Aus welchen Materialien bestehen die Komponenten eines PTFE-Elektrodenständers? Ein Leitfaden zur chemischen Beständigkeit & Stabilität



















