Bei jedem elektrochemischen Experiment, das Strom beinhaltet, dient die Hilfselektrode (auch Gegenelektrode genannt) einem primären Zweck: den elektrischen Stromkreis zu schließen. Sie arbeitet Hand in Hand mit der Arbeitselektrode und ermöglicht den Stromfluss, sodass die interessierende Reaktion angetrieben und untersucht werden kann, während gleichzeitig die Stabilität und Genauigkeit der Messung gewährleistet wird.
Die wahre Funktion der Hilfselektrode besteht darin, die Integrität Ihrer Messung zu schützen. Indem sie den gesamten Stromfluss übernimmt, isoliert sie die Referenzelektrode und stellt sicher, dass das Potenzial an der Arbeitselektrode gegen einen stabilen, ungestörten Referenzpunkt gemessen wird.

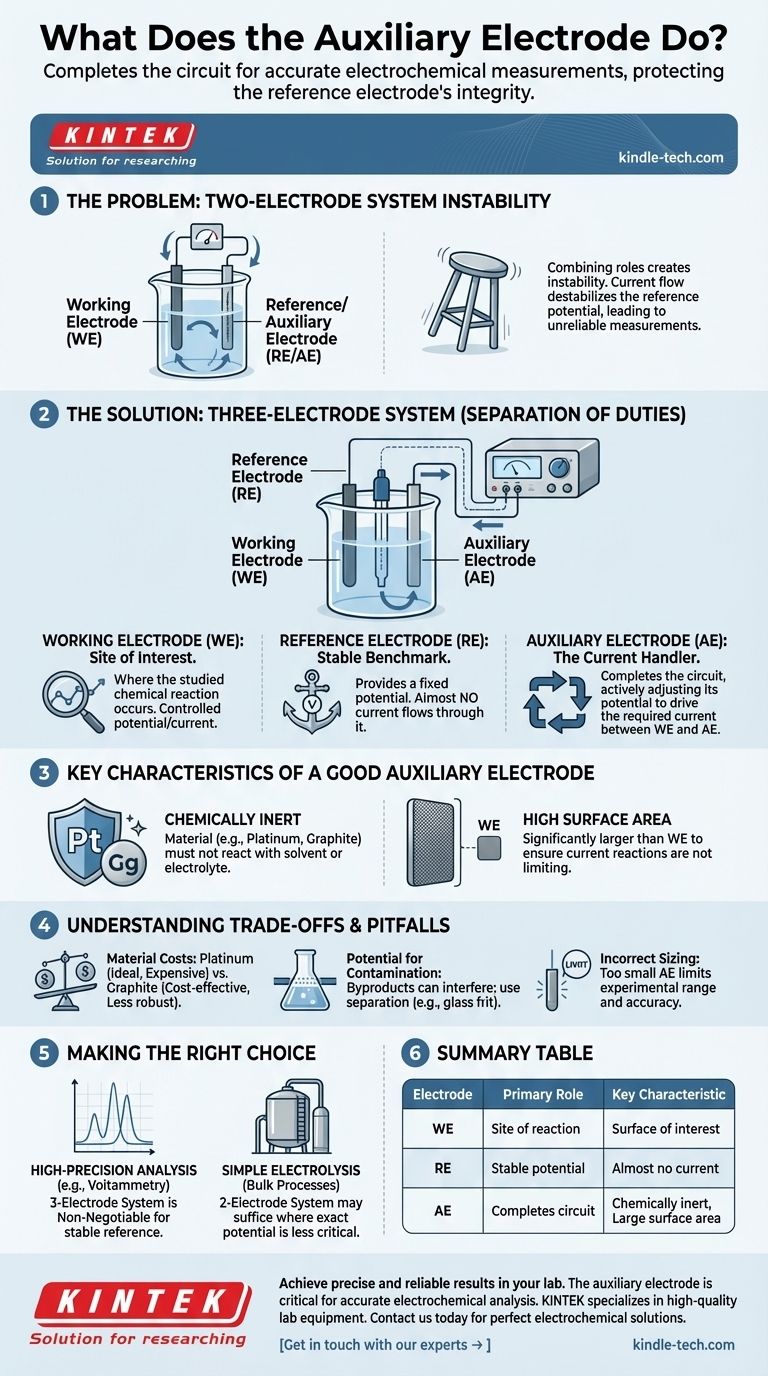
Das Problem eines Zwei-Elektroden-Systems
Um zu verstehen, warum eine Hilfselektrode notwendig ist, müssen wir zunächst die Einschränkungen eines einfacheren Aufbaus betrachten. In vielen Situationen ist ein Zwei-Elektroden-System für eine präzise Steuerung und Messung unzureichend.
Die Kombination von Rollen führt zu Instabilität
In einer Zwei-Elektroden-Zelle haben Sie nur eine Arbeitselektrode und eine zweite Elektrode, die gezwungen ist, sowohl als Referenz (der stabile Punkt, gegen den das Potenzial gemessen wird) als auch als Hilfselektrode (der Strompfad) zu fungieren.
Der Einfluss des Stromflusses
Das Potenzial einer Referenzelektrode ist nur stabil, wenn kein signifikanter Strom durch sie fließt. Wenn sie gezwungen wird, auch als stromführende Gegenelektrode zu dienen, destabilisiert dies ihr Potenzial. Dies macht es unmöglich, das wahre Potenzial an Ihrer Arbeitselektrode zu kennen, wodurch Ihre Messungen unzuverlässig werden.
Die Drei-Elektroden-Lösung: Eine Aufgabentrennung
Die Einführung einer dritten Elektrode – der Hilfselektrode – löst dieses Problem, indem sie eine klare Trennung der Rollen innerhalb der elektrochemischen Zelle schafft. Dieser Aufbau, der von einem Instrument namens Potentiostat verwaltet wird, ist der Standard für die moderne Elektroanalyse.
Die Arbeitselektrode (WE): Der Ort des Interesses
Hier findet die chemische Reaktion statt, die Sie untersuchen möchten. Ihr gesamtes Experiment ist darauf ausgelegt, das Potenzial und/oder den Strom an dieser Oberfläche zu steuern und zu messen.
Die Referenzelektrode (RE): Der stabile Referenzpunkt
Die einzige Aufgabe der Referenzelektrode ist es, ein festes, bekanntes Potenzial bereitzustellen. Der Potentiostat misst die Potenzialdifferenz zwischen der Arbeitselektrode und der Referenzelektrode. Entscheidend ist, dass fast kein Strom durch die RE fließt, wodurch ihre Stabilität erhalten bleibt.
Die Hilfselektrode (AE): Der Stromhandler
Die Hilfselektrode schließt den Stromkreis. Der Potentiostat legt Strom zwischen der Arbeitselektrode und der Hilfselektrode an. Das Potenzial der AE wird vom Instrument aktiv auf die Spannung eingestellt, die erforderlich ist, um die Reaktion an der WE auszugleichen und den Zielstrom fließen zu lassen. Sie absorbiert effektiv die elektrische Belastung des Systems.
Wichtige Eigenschaften einer guten Hilfselektrode
Um ihre Rolle effektiv zu erfüllen, sollte eine Hilfselektrode spezifische Eigenschaften aufweisen, die verhindern, dass sie die Messung stört oder das Experiment einschränkt.
Chemisch inert
Die Hilfselektrode muss aus einem Material wie Platin oder Graphit bestehen, das nicht mit Ihrem Lösungsmittel oder Elektrolyten reagiert. Ihre einzige Aufgabe ist es, den Elektronentransfer zu erleichtern, nicht Teil der Chemie zu werden, die Sie untersuchen.
Große Oberfläche
Die Oberfläche der Hilfselektrode sollte deutlich größer sein als die der Arbeitselektrode. Dies stellt sicher, dass die an der Hilfselektrodenoberfläche ablaufenden Reaktionen den Strombedarf der Arbeitselektrode problemlos decken können, wodurch verhindert wird, dass die AE zum limitierenden Faktor in Ihrem Experiment wird.
Verständnis der Kompromisse und Fallstricke
Obwohl unerlässlich, ist die Hilfselektrode keine „einmal einstellen und vergessen“-Komponente. Die richtige Auswahl und Platzierung sind entscheidend für gute Daten.
Materialkosten
Platin ist aufgrund seiner Inertheit und Effizienz ein ideales Material, aber es ist teuer. Graphit ist eine gängige, kostengünstige Alternative, kann aber weniger robust sein und seine Oberfläche kann sich im Laufe der Zeit verändern.
Potenzial für Kontamination
Die an der Hilfselektrode ablaufenden Reaktionen (oft die Oxidation oder Reduktion des Lösungsmittels) erzeugen chemische Nebenprodukte. In einer schlecht konzipierten Zelle können diese Produkte zur Arbeitselektrode diffundieren und Ihre interessierende Reaktion stören. Deshalb ist eine Trennung, manchmal mit einer Glasfritte, wichtig.
Falsche Dimensionierung
Die Verwendung einer zu kleinen Hilfselektrode ist ein häufiger Fehler. Wenn ihre Oberfläche unzureichend ist, kann sie den erforderlichen Strom nicht effizient leiten. Dies begrenzt den experimentellen Bereich und kann zu ungenauen Ergebnissen führen, da das Instrument Schwierigkeiten hat, das Zielpotenzial an der Arbeitselektrode aufrechtzuerhalten.
Die richtige Wahl für Ihr Ziel treffen
Die Notwendigkeit einer Hilfselektrode ist direkt mit der Notwendigkeit einer präzisen Potenzialregelung verbunden.
- Wenn Ihr Hauptaugenmerk auf hochpräzisen Analysen liegt (z. B. Voltammetrie): Ein Drei-Elektroden-System mit einer separaten, inerten Hilfselektrode ist unerlässlich, um ein stabiles Referenzpotenzial zu erreichen.
- Wenn Ihr Hauptaugenmerk auf einfacher Elektrolyse oder Massenprozessen liegt: Ein Zwei-Elektroden-System kann ausreichen, wenn das genaue Potenzial weniger kritisch ist als das Antreiben der Gesamtreaktion mit einem großen Strom.
- Wenn Sie ein neues Experiment entwerfen: Standardmäßig immer einen Drei-Elektroden-Aufbau verwenden. Die Verwendung einer richtig dimensionierten Hilfselektrode stellt sicher, dass die von Ihnen gesammelten Daten eine wahre Widerspiegelung der Chemie an Ihrer Arbeitselektrode sind.
Letztendlich ist die Hilfselektrode der unbesungene Held, der eine präzise und wiederholbare elektrochemische Steuerung ermöglicht.
Zusammenfassungstabelle:
| Elektrode | Primäre Rolle | Wichtigste Eigenschaft |
|---|---|---|
| Arbeitselektrode (WE) | Ort der untersuchten chemischen Reaktion. | Die interessierende Oberfläche für das Experiment. |
| Referenzelektrode (RE) | Bietet ein stabiles, bekanntes Potenzial zur Messung. | Es fließt fast kein Strom durch sie. |
| Hilfselektrode (AE) | Schließt den elektrischen Stromkreis durch Handhabung des Stromflusses. | Chemisch inert (z. B. Platin) und hat eine große Oberfläche. |
Erzielen Sie präzise und zuverlässige Ergebnisse in Ihrem Labor. Die Hilfselektrode ist entscheidend für eine genaue elektrochemische Analyse. Damit Ihre Forschung vertrauenswürdig ist, benötigen Sie die richtige Ausrüstung.
KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich elektrochemischer Zellen und Komponenten. Wir bieten die zuverlässigen Werkzeuge, die Ihr Labor benötigt, um die Messintegrität und den experimentellen Erfolg zu gewährleisten.
Kontaktieren Sie uns noch heute, um die perfekten elektrochemischen Lösungen für Ihre spezifische Anwendung zu finden. Nehmen Sie Kontakt mit unseren Experten auf →
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Anpassbare CO2-Reduktions-Flowzelle für NRR-, ORR- und CO2RR-Forschung
- Anpassbare PEM-Elektrolysezellen für vielfältige Forschungsanwendungen
- Knopfzellenbatteriegehäuse für Batterie-Laboranwendungen
Andere fragen auch
- Was ist die Vorsichtsmaßnahme bezüglich der Temperatur bei der Verwendung einer reinen PTFE-Elektrolysezelle? Wesentliche thermische Sicherheitstipps
- Was sind die Vorteile der Verwendung eines PTFE-Abscheidungstanks für EPD? Erzielen Sie unübertroffene Beschichtungspräzision auf Edelstahl
- Was sind die Hauptfunktionen einer Hochleistungs-Elektrolysezelle im eCO2R-Prozess? Optimieren Sie Ihre Laborergebnisse
- Welche Parameter müssen in einer Elektrolysezelle aus reinem PTFE streng kontrolliert werden? Präzision und Sicherheit gewährleisten
- Welche Rolle spielt ein Zwei-Elektroden-Elektrochemie-Reaktor beim Wachstum von TiO2? Erreichen Sie noch heute geordnete Nanostrukturen


















