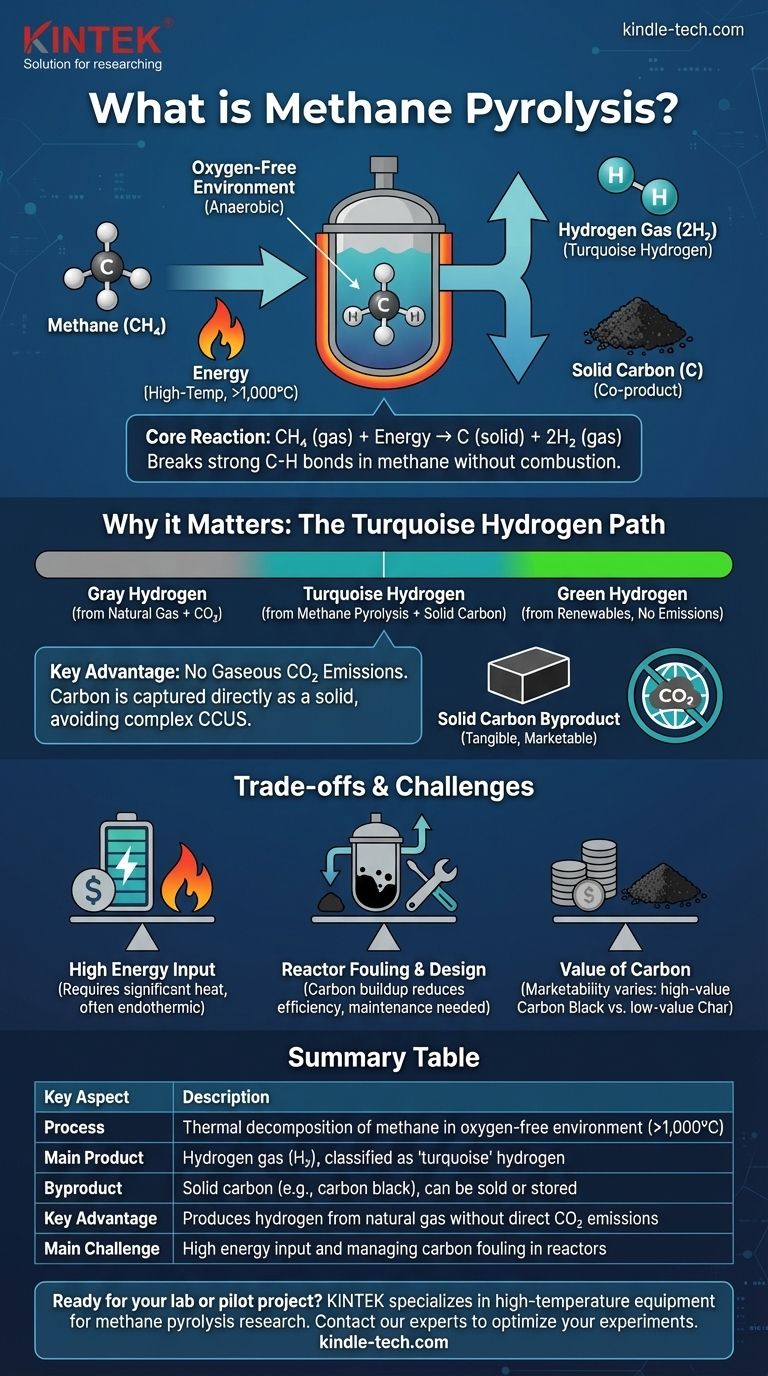
Vereinfacht ausgedrückt ist die Methanpyrolyse ein chemischer Prozess, der Methan (CH₄) in seine grundlegenden Bestandteile zerlegt: Wasserstoffgas (H₂) und festen Kohlenstoff (C). Dies wird erreicht, indem Methan in einer sauerstofffreien Umgebung auf sehr hohe Temperaturen erhitzt wird. Das Fehlen von Sauerstoff ist entscheidend, da es verhindert, dass das Methan verbrennt, und es stattdessen zur Zersetzung zwingt.
Methanpyrolyse ist nicht nur eine chemische Reaktion; sie ist eine Strategie zur Gewinnung von wertvollem Wasserstoff aus Erdgas, ohne Kohlendioxid in die Atmosphäre freizusetzen. Der Kohlenstoff wird in fester, handhabbarer Form abgeschieden, was das Emissionsprofil der Wasserstoffproduktion aus fossilen Brennstoffen grundlegend verändert.

Die chemische Kernreaktion
Die Eleganz der Methanpyrolyse liegt in ihrer Direktheit. Der Prozess, auch als Methanspaltung oder -zersetzung bekannt, nutzt thermische Energie, um eine der stärksten Einfachbindungen in der organischen Chemie aufzubrechen.
Die grundlegende Gleichung
Die Reaktion wird durch eine einfache, saubere Gleichung bestimmt: CH₄ (Gas) + Energie → C (fest) + 2H₂ (Gas). Ein Methanmolekül ergibt ein Atom festen Kohlenstoffs und zwei Moleküle Wasserstoffgas.
Die Rolle hoher Temperaturen
Das Aufbrechen der stabilen Kohlenstoff-Wasserstoff-Bindungen in Methan erfordert einen erheblichen Energieeintrag, wodurch der Prozess endotherm ist. Dies wird typischerweise durch Erhitzen des Methans auf Temperaturen über 1.000 °C (1.832 °F) erreicht, obwohl Katalysatoren diese Anforderung manchmal senken können.
Das Fehlen von Sauerstoff
Der gesamte Prozess muss in einer anaeroben (sauerstofffreien) Umgebung ablaufen. Wäre Sauerstoff vorhanden, würde das Methan verbrennen und Kohlendioxid (CO₂) und Wasser (H₂O) anstelle des gewünschten Wasserstoffs und festen Kohlenstoffs produzieren.
Warum Pyrolyse für die Wasserstoffproduktion wichtig ist
Die Methanpyrolyse gewinnt als potenzielle Brückentechnologie in der Energiewende erheblich an Aufmerksamkeit. Sie bietet ein einzigartiges Wertversprechen im Vergleich zu anderen etablierten Methoden der Wasserstoffproduktion.
Ein "türkiser" Wasserstoffpfad
Wasserstoff wird oft nach seiner Produktionsmethode farblich kodiert. Grauer Wasserstoff wird aus Erdgas mittels Dampfreformierung (SMR) hergestellt, einem Prozess, der große Mengen CO₂ emittiert. Grüner Wasserstoff wird durch Elektrolyse unter Verwendung erneuerbarer Elektrizität hergestellt, ohne Emissionen.
Die Methanpyrolyse erzeugt sogenannten türkisen Wasserstoff. Sie verwendet einen fossilen Rohstoff (Methan), produziert aber keine gasförmigen Kohlenstoffemissionen, wodurch sie auf dem Kohlenstoffintensitätsspektrum zwischen grau und grün angesiedelt ist.
Der Hauptvorteil: Keine gasförmigen Kohlenstoffemissionen
Der entscheidende Vorteil der Pyrolyse ist, dass der Kohlenstoff direkt als Feststoff abgeschieden wird. Dies macht komplexe und teure Carbon Capture, Utilization, and Storage (CCUS)-Systeme überflüssig, die erforderlich sind, um grauen Wasserstoff in emissionsärmeren "blauen" Wasserstoff umzuwandeln.
Das feste Kohlenstoff-Koprodukt
Im Gegensatz zu anderen Prozessen, bei denen CO₂ ein Abfallprodukt ist, das entsorgt werden muss, ist der feste Kohlenstoff aus der Pyrolyse ein greifbares Koprodukt. Seine Form, Reinheit und sein Marktwert sind entscheidend für die Gesamtwirtschaftlichkeit des Prozesses.
Abwägungen und Herausforderungen verstehen
Obwohl vielversprechend, ist die Methanpyrolyse keine Patentlösung. Ihre Machbarkeit hängt von der Lösung erheblicher technischer und wirtschaftlicher Herausforderungen ab.
Hoher Energieeintrag
Als endothermer Prozess erfordert die Pyrolyse eine große, kontinuierliche Zufuhr von Hochtemperaturwärme. Die Quelle dieser Energie ist ein kritischer Faktor. Wird die Wärme durch die Verbrennung von mehr Erdgas erzeugt, steigt der gesamte Kohlenstoff-Fußabdruck des Prozesses, was seine "kohlenstoffarme" Glaubwürdigkeit mindert. Die Verwendung von erneuerbarem Strom für Plasma- oder Widerstandsheizung ist eine Lösung, erhöht aber die Kosten.
Reaktordesign und Verunreinigung
Die Prozessführung bei extremen Temperaturen ist eine große technische Herausforderung. Ein Hauptproblem ist das Kohlenstoff-Fouling, bei dem sich das feste Kohlenstoff-Nebenprodukt auf Reaktoroberflächen, Katalysatoren und Wärmetauschern ablagert, die Effizienz verringert und regelmäßige Abschaltungen zur Reinigung erfordert.
Der Wert des Kohlenstoffs
Die wirtschaftliche Rentabilität von türkischem Wasserstoff hängt oft von der Fähigkeit ab, das feste Kohlenstoff-Koprodukt zu verkaufen. Der Wert dieses Kohlenstoffs variiert dramatisch, von hochwertigem Carbon Black, das in Reifen und Pigmenten verwendet wird, bis hin zu minderwertiger Kohlenstoffkohle oder Ruß, die sogar Entsorgungskosten verursachen können. Die Herstellung eines konsistenten, hochreinen Kohlenstoffprodukts ist ein primäres technisches Ziel.
Die richtige Wahl für Ihr Ziel treffen
Ihre Bewertung der Methanpyrolyse-Technologie muss auf Ihre spezifischen strategischen Ziele abgestimmt sein.
- Wenn Ihr Hauptaugenmerk auf der Dekarbonisierung bestehender Erdgasinfrastrukturen liegt: Die Pyrolyse bietet einen überzeugenden Weg zur Wasserstoffproduktion ohne direkte CO₂-Emissionen, indem sie potenziell bestehende Gaspipelines nutzt und gleichzeitig die Kapitalkosten und das geologische Risiko von CCUS vermeidet.
- Wenn Ihr Hauptaugenmerk auf der Produktion des absolut saubersten Wasserstoffs liegt: Grüner Wasserstoff, der durch Elektrolyse mit dedizierter erneuerbarer Energie erzeugt wird, bleibt der Goldstandard, da er die Verwendung fossiler Brennstoffe vollständig eliminiert.
- Wenn Ihr Hauptaugenmerk auf der wirtschaftlichen Rentabilität liegt: Der Erfolg eines Pyrolyseprojekts wird durch drei Faktoren bestimmt: Zugang zu billigem Erdgas, eine kostengünstige und kohlenstoffarme Energiequelle für die Wärme und ein zuverlässiger Markt für den produzierten hochwertigen festen Kohlenstoff.
Die Methanpyrolyse stellt ein leistungsstarkes, aber komplexes Werkzeug zur Dekarbonisierung dar, bei dem die Steuerung des Energieeintrags und des Kohlenstoffausstoßes ebenso wichtig ist wie die Produktion des Wasserstoffs selbst.
Zusammenfassungstabelle:
| Schlüsselaspekt | Beschreibung |
|---|---|
| Prozess | Thermische Zersetzung von Methan in einer sauerstofffreien Umgebung (>1.000°C). |
| Hauptprodukt | Wasserstoffgas (H₂), klassifiziert als 'türkiser' Wasserstoff. |
| Nebenprodukt | Fester Kohlenstoff (z.B. Ruß), der verkauft oder gelagert werden kann. |
| Hauptvorteil | Produziert Wasserstoff aus Erdgas ohne direkte CO₂-Emissionen. |
| Hauptproblem | Hoher Energieeintrag und Management der Kohlenstoffverunreinigung in Reaktoren. |
Möchten Sie Wasserstoffproduktionslösungen für Ihr Labor oder Pilotprojekt erkunden? KINTEK ist spezialisiert auf Hochtemperatur-Laborgeräte und Verbrauchsmaterialien, die für die Erforschung und Entwicklung von Prozessen wie der Methanpyrolyse unerlässlich sind. Ob Sie Reaktoren, Heizelemente oder Analysegeräte benötigen, unser Fachwissen kann Ihnen helfen, Ihre Experimente zu optimieren und Ihre Technologie zu skalieren. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir Ihre Innovationen im Bereich sauberer Energie unterstützen können.
Visuelle Anleitung
Ähnliche Produkte
- Anpassbare Hochdruckreaktoren für fortschrittliche wissenschaftliche und industrielle Anwendungen
- Elektrischer Drehrohrofen Kleiner Drehrohrofen Biomasse-Pyrolyseanlage
- Mini-Hochdruck-Autoklavreaktor aus Edelstahl für Laboranwendungen
- Hochdruck-Laborautoklav-Reaktor für Hydrothermalsynthese
- Edelstahl-Hochdruck-Autoklav-Reaktor Labor-Druckreaktor
Andere fragen auch
- Warum ist es schwierig, mit CVD eine vollständig gleichmäßige Graphenschicht auf einem Substrat zu erzielen? Beherrschung des Graphenwachstums
- Warum werden Graphitprobenträger zur Unterstützung von Siliziumsubstraten gewählt? Wichtige Vorteile für die Reinheit von Al2TiO5-Beschichtungen.
- Was gilt als Dünnschicht? Der Leitfaden für Nanomaterialien
- Was ist die Auswirkung der Substrattemperatur auf den ALCVD-Prozess? Optimierung von Filmwachstum und -qualität
- Was sind die Komponenten von MOCVD? Eine detaillierte Aufschlüsselung dieses fortschrittlichen Abscheidungssystems
- Warum benötigen wir beim Beschichten ein Vakuum? Erzielen Sie überlegene Reinheit und Haftung
- Was sind die Schritte der chemischen Gasphasenabscheidung? Ein Leitfaden zum 7-Schritte-CVD-Prozess
- Was sind die Techniken der Gasphasenabscheidung? Wählen Sie die richtige Methode für überlegene Dünnschichten



















