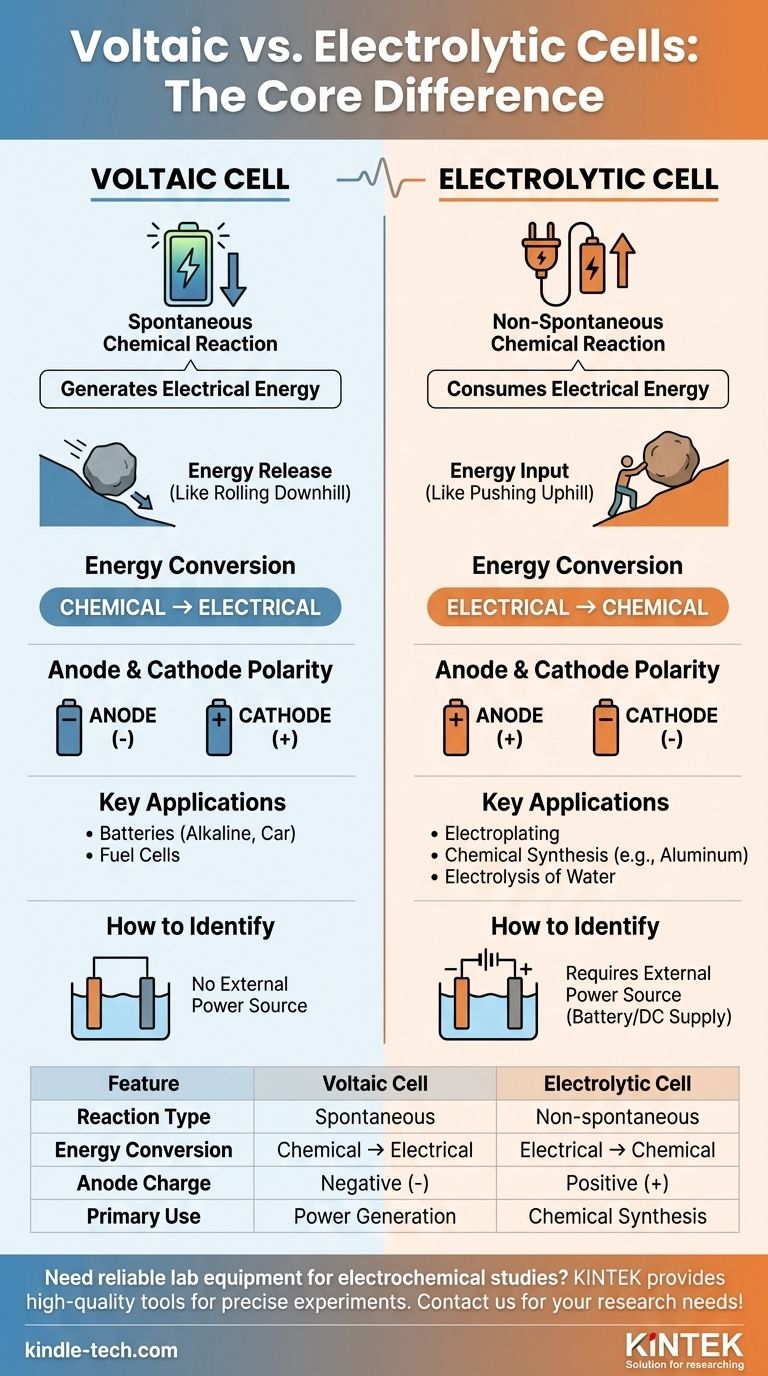
Der Hauptunterschied zwischen einer galvanischen Zelle und einer Elektrolysezelle liegt in ihrem grundlegenden Zweck und der Art der beteiligten chemischen Reaktionen. Eine galvanische Zelle, wie eine gewöhnliche Batterie, nutzt eine spontane chemische Reaktion, um elektrische Energie zu erzeugen. Im Gegensatz dazu verwendet eine Elektrolysezelle externe elektrische Energie, um eine chemische Reaktion anzutreiben, die von selbst nicht ablaufen würde.
Im Kern geht es bei der Unterscheidung um den Energiefluss. Eine galvanische Zelle ist eine Energiequelle, die Energie aus einer willigen chemischen Reaktion freisetzt. Eine Elektrolysezelle ist ein Energieverbraucher, der eine unwillige chemische Reaktion erzwingt.

Das Kernprinzip: Spontaneität
Das wichtigste Konzept, das diese beiden Zellen trennt, ist, ob die chemische Reaktion spontan oder nicht spontan ist. Dies bestimmt die gesamte Funktion und Struktur der Zelle.
Galvanische Zellen: Spontane Energieabgabe
In einer galvanischen Zelle (auch Voltasche Zelle genannt) ist die Redoxreaktion spontan. Die Reaktanten haben eine höhere chemische potenzielle Energie als die Produkte.
Diese natürliche Neigung zur Reaktion setzt Energie frei, die als elektrischer Strom genutzt wird. Stellen Sie es sich wie einen Felsbrocken vor, der einen Hügel hinunterrollt – es geschieht ohne äußeren Anstoß.
Die Standardzellspannung (E°Zelle) für eine galvanische Zelle ist immer positiv, was auf eine spontane Reaktion hindeutet.
Elektrolysezellen: Erzwungener chemischer Wandel
In einer Elektrolysezelle ist die Redoxreaktion nicht spontan. Die Produkte befinden sich in einem höheren Energiezustand als die Reaktanten.
Um diese Reaktion ablaufen zu lassen, muss eine externe Energiequelle (wie eine Batterie oder eine Gleichstromversorgung) angelegt werden. Dies ist, als würde man den Felsbrocken den Hügel hinaufschieben – es erfordert einen konstanten Energieeintrag.
Die Standardzellspannung (E°Zelle) für die Reaktion in einer Elektrolysezelle ist negativ, was bestätigt, dass sie ohne fremde Hilfe nicht ablaufen wird.
Wesentliche funktionale und strukturelle Unterschiede
Der Unterschied in der Spontaneität führt zu mehreren entscheidenden Unterschieden in der Bauweise und Funktionsweise dieser Zellen.
Energieumwandlung
Eine galvanische Zelle führt die Umwandlung von chemischer Energie in elektrische Energie durch. Sie ist ein chemischer Stromerzeuger.
Eine Elektrolysezelle macht genau das Gegenteil. Sie wandelt elektrische Energie in chemische Energie um und nutzt Strom, um neue Substanzen zu erzeugen.
Polarität von Anode und Kathode
Dies ist ein häufiger Verwirrungspunkt, aber es ist einfach, wenn man sich die Kerndefinitionen merkt. In beiden Zelltypen findet die Oxidation immer an der Anode und die Reduktion immer an der Kathode statt.
Allerdings ist die Ladung dieser Elektroden umgekehrt:
- In einer galvanischen Zelle ist die Anode die Quelle der Elektronen aus der spontanen Reaktion, was sie zum negativen (-) Pol macht. Die Kathode ist der Ort, an dem Elektronen verbraucht werden, was sie zum positiven (+) Pol macht.
- In einer Elektrolysezelle bestimmt die externe Stromquelle die Ladung. Sie drückt Elektronen zur Kathode, was sie zum negativen (-) Pol macht. Sie zieht Elektronen von der Anode weg, was sie zum positiven (+) Pol macht.
Praktische Anwendungen
Die Anwendungen für jeden Zelltyp spiegeln direkt ihre Funktion wider.
Galvanische Zellen werden zur Stromversorgung von Geräten verwendet. Beispiele hierfür sind alltägliche Alkalibatterien, Autobatterien (während der Entladung) und Brennstoffzellen.
Elektrolysezellen werden zur Synthese und Reinigung eingesetzt. Häufige Anwendungen sind die Galvanisierung von Metallen, die Herstellung von reinem Aluminium und die Elektrolyse von Wasser zur Erzeugung von Wasserstoff- und Sauerstoffgas.
Häufige Fallstricke und Schlüsselunterschiede
Um häufige Fehler zu vermeiden, konzentrieren Sie sich auf den Zweck der Zelle und die Anwesenheit einer externen Stromquelle.
Zweck: Stromversorgung vs. Produktion
Der einfachste Weg, sie zu unterscheiden, ist ihr Ziel. Stellt die Zelle Elektrizität her, oder verbraucht sie Elektrizität, um etwas Chemisches herzustellen? Das Erste ist galvanisch; das Zweite ist elektrolytisch.
Die Rolle der Salzbrücke
Galvanische Zellen bestehen oft aus zwei getrennten Halbzellen, die durch eine Salzbrücke verbunden sind. Diese Komponente ist entscheidend, um die Ladungsneutralität aufrechtzuerhalten, während Ionen während der spontanen Reaktion fließen.
Elektrolysezellen sind in der Regel einfacher aufgebaut und finden oft in einem einzigen Behälter statt, in dem der Elektrolyt selbst die Ionenbewegung ermöglicht.
Die externe Stromversorgung
Der deutlichste visuelle Indikator in einem Diagramm ist das Vorhandensein einer Batterie oder Stromversorgung. Wenn Sie sehen, dass diese an die Elektroden angeschlossen ist, betrachten Sie eine Elektrolysezelle. Ihr Fehlen impliziert eine galvanische Zelle.
Die richtige Wahl für Ihr Ziel treffen
Um den Zelltyp zu identifizieren oder seine Funktion zu verstehen, berücksichtigen Sie das Hauptziel des Systems.
- Wenn Ihr Hauptaugenmerk darauf liegt, ein Gerät mit Strom zu versorgen: Sie arbeiten mit einer galvanischen Zelle, die eine spontane chemische Reaktion nutzt, um einen Strom zu erzeugen.
- Wenn Ihr Hauptaugenmerk darauf liegt, eine reine Substanz herzustellen (wie Chlorgas oder Kupfermetall): Sie verwenden eine Elektrolysezelle, die eine nicht spontane Reaktion mit einer externen Stromquelle antreibt.
- Wenn Sie ein Diagramm mit einer externen Batterie analysieren: Dies deutet auf eine Elektrolysezelle hin, da sie die notwendige Energie liefert, um die chemische Umwandlung zu erzwingen.
Das Verständnis dieser grundlegenden Trennung zwischen spontaner Erzeugung und erzwungener Reaktion ist der Schlüssel zur Beherrschung der Elektrochemie.
Zusammenfassungstabelle:
| Merkmal | Galvanische Zelle | Elektrolysezelle |
|---|---|---|
| Reaktionstyp | Spontan | Nicht spontan (erfordert externe Energie) |
| Energieumwandlung | Chemisch → Elektrisch | Elektrisch → Chemisch |
| Anodenladung | Negativ (-) | Positiv (+) |
| Hauptverwendung | Stromerzeugung (z. B. Batterien) | Chemische Synthese (z. B. Galvanisierung) |
Benötigen Sie zuverlässige Laborausrüstung für Ihre elektrochemischen Studien? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien und bietet die präzisen Werkzeuge, die Sie für Experimente mit galvanischen und Elektrolysezellen benötigen. Von Elektroden bis hin zu Netzteilen – unsere Lösungen tragen dazu bei, genaue und reproduzierbare Ergebnisse in Ihrem Labor zu gewährleisten. Kontaktieren Sie uns noch heute, um die perfekte Ausrüstung für Ihre Forschungsbedürfnisse zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
- Ausrüstung für Batterielabore Batterietestgerät für Kapazität und umfassende Tests
Andere fragen auch
- Welche regelmäßigen Überprüfungen sind für die Wartung der H-Typ-Elektrolysezelle erforderlich? Gewährleistung der experimentellen Präzision
- Welche Rolle spielen vernickelte Bipolarplatten in einem Elektrolyseur-Stack? Effizienz und Haltbarkeit verbessern
- Welche Schritte sind vor der Verwendung einer superversiegelten Elektrolysezelle erforderlich? Gewährleistung von Sicherheit und Datenintegrität
- Welche Arten von Elektroden werden in der Elektrolysezelle verwendet? Wählen Sie das richtige System für Ihr Labor
- Was ist die Funktion eines mechanischen Rührwerks zur Verbesserung der TOC-Entfernung? Steigerung der Oxidation bei der Abwasserbehandlung von Fischmehl
- Warum ist eine Hochtemperatur-Katalyse-Reaktionszelle für die Analyse von MCFC unerlässlich? Sicherstellung einer präzisen Brennstoffzellenleistung
- Was ist die Funktion einer Zwei-Elektroden-Elektrolysezelle in EPD? Verbesserung der Präzision von Keramikbeschichtungen
- Welche Substanzen sollten bei elektrolytischen Zellen aus Acryl vermieden werden? Schützen Sie Ihre Laborausrüstung vor Beschädigungen














