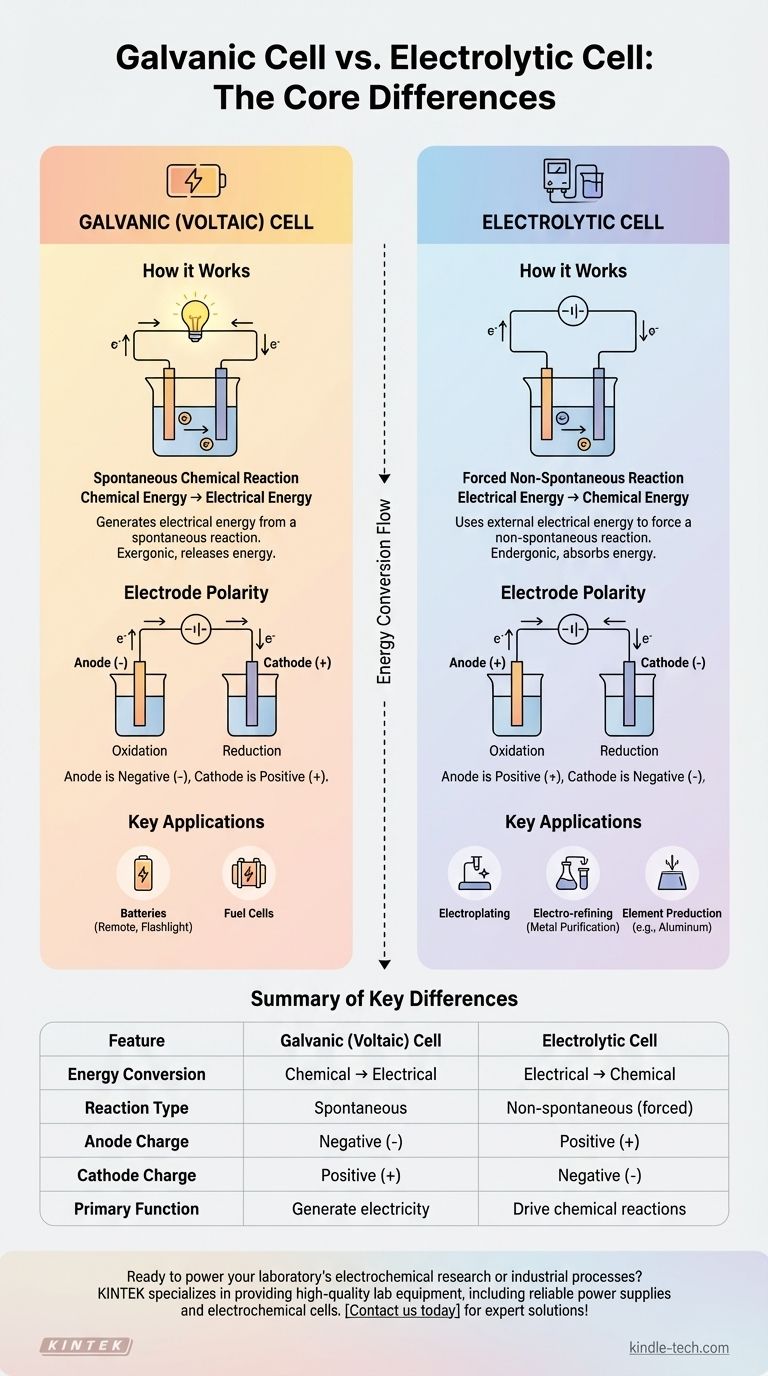
Obwohl Ihre Frage zwei Elektrolysezellen erwähnt, liegt der Kernunterschied in der Elektrochemie zwischen einer Elektrolysezelle und einer galvanischen Zelle (auch bekannt als Volta-Zelle). Eine galvanische Zelle erzeugt elektrische Energie aus einer spontanen chemischen Reaktion, ähnlich einer gewöhnlichen Batterie. Im Gegensatz dazu verwendet eine Elektrolysezelle eine externe Quelle elektrischer Energie, um eine nicht-spontane chemische Reaktion zu erzwingen.
Der grundlegende Unterschied liegt in der Energieumwandlung. Eine galvanische Zelle wandelt gespeicherte chemische Energie in elektrische Energie um, während eine Elektrolysezelle genau das Gegenteil tut, indem sie elektrische Energie in chemische Energie umwandelt, um gewünschte Substanzen zu erzeugen.

Wie galvanische (Volta-)Zellen funktionieren
Eine galvanische Zelle ist ein eigenständiges System, das Elektrizität erzeugt. Denken Sie an jede Standardbatterie, die Sie in einer Fernbedienung oder Taschenlampe verwenden.
Spontane chemische Reaktionen
Der Motor einer galvanischen Zelle ist eine spontane Redox-Reaktion (Reduktion-Oxidation). Das bedeutet, dass die chemische Reaktion ohne externe Energiezufuhr natürlich abläuft und dabei Energie freisetzt.
Energieumwandlung: Chemisch zu elektrisch
Die durch die spontane Reaktion freigesetzte Energie drückt Elektronen durch einen externen Stromkreis und erzeugt so einen elektrischen Strom. Sie wandelt effektiv gespeicherte chemische potenzielle Energie in nutzbare elektrische Energie um.
Elektrodenpolarität
In einer galvanischen Zelle ist die Anode die negative Elektrode, an der Oxidation stattfindet, und die Kathode ist die positive Elektrode, an der Reduktion stattfindet. Elektronen fließen von der negativen Anode zur positiven Kathode.
Wie Elektrolysezellen funktionieren
Eine Elektrolysezelle wird verwendet, um chemische Veränderungen anzutreiben, die nicht von selbst stattfinden würden. Dieser Prozess ist als Elektrolyse bekannt.
Erzwingen nicht-spontaner Reaktionen
Diese Zellen sind darauf ausgelegt, eine nicht-spontane Reaktion zu erzwingen. Zum Beispiel zerfällt Wasser nicht spontan in Wasserstoff und Sauerstoff; es erfordert Energie, um auseinandergedrückt zu werden.
Die Rolle einer externen Stromquelle
Um diese Reaktion anzutreiben, muss eine Elektrolysezelle an eine externe Stromquelle angeschlossen werden, wie eine Batterie oder ein Gleichstromnetzteil. Diese Quelle liefert die Energie, die benötigt wird, um den natürlichen Widerstand der Reaktion zu überwinden.
Die Funktion des Elektrolyten
Die Zelle enthält einen Elektrolyten, der typischerweise ein geschmolzenes Salz oder eine Salzlösung ist. Diese Substanz enthält mobile Ionen, die von den Elektroden angezogen werden, wodurch die chemischen Reaktionen stattfinden und der elektrische Stromkreis geschlossen wird.
Anwendungen in der Industrie
Dieser Prozess ist entscheidend für viele industrielle Anwendungen, einschließlich der Galvanisierung (Beschichten eines Objekts mit einer dünnen Metallschicht), der Elektro-Raffination zur Reinigung von Metallen wie Kupfer und der Herstellung reiner Elemente wie Aluminium aus Bauxiterz.
Die Kernunterschiede verstehen
Der Vergleich dieser beiden Zellen nebeneinander zeigt ihre gegensätzliche Natur. Sie sind zwei Seiten derselben elektrochemischen Medaille.
Energiefluss und Spontaneität
Eine galvanische Zelle ist exergonisch, was bedeutet, dass sie Energie aus einer spontanen Reaktion freisetzt. Eine Elektrolysezelle ist endergonisch, was bedeutet, dass sie Energie aufnimmt, um eine nicht-spontane Reaktion anzutreiben.
Umkehrung der Elektrodenpolarität
Dies ist ein entscheidender Unterschied. Während Oxidation immer an der Anode und Reduktion an der Kathode stattfindet, sind ihre Ladungen umgekehrt.
- In einer galvanischen Zelle: Anode ist negativ (-), Kathode ist positiv (+).
- In einer Elektrolysezelle: Anode ist positiv (+), Kathode ist negativ (-).
Diese Umkehrung geschieht, weil die externe Stromquelle in einer Elektrolysezelle den Elektronenfluss diktiert und die natürliche Tendenz des chemischen Systems übersteuert.
Die richtige Wahl für Ihr Ziel treffen
Welche Zelle verwendet werden soll, hängt ausschließlich davon ab, ob Ihr Ziel die Stromerzeugung oder die Herstellung eines chemischen Produkts ist.
- Wenn Ihr Hauptaugenmerk auf der Stromerzeugung aus einem chemischen Prozess liegt: Sie beschreiben eine galvanische (Volta-)Zelle, die das Prinzip hinter allen Batterien ist.
- Wenn Ihr Hauptaugenmerk darauf liegt, Strom zur Herstellung einer Substanz zu verwenden: Sie benötigen eine Elektrolysezelle, die die Grundlage für die industrielle Galvanisierung, Raffination und Elementproduktion ist.
- Wenn Ihr Hauptaugenmerk auf dem Verständnis der grundlegenden Elektrochemie liegt: Denken Sie daran, dass galvanische Zellen spontan Energie freisetzen, während Elektrolysezellen Energie benötigen, um eine Reaktion zu erzwingen.
Letztendlich ist die Richtung der Energieumwandlung der wichtigste Faktor, der diese beiden grundlegenden elektrochemischen Zellen definiert und trennt.
Zusammenfassungstabelle:
| Merkmal | Galvanische (Volta-)Zelle | Elektrolysezelle |
|---|---|---|
| Energieumwandlung | Chemisch → Elektrisch | Elektrisch → Chemisch |
| Reaktionstyp | Spontan | Nicht-spontan (erzwungen) |
| Anodenladung | Negativ (-) | Positiv (+) |
| Kathodenladung | Positiv (+) | Negativ (-) |
| Primäre Funktion | Strom erzeugen (z.B. Batterien) | Chemische Reaktionen antreiben (z.B. Galvanisierung, Raffination) |
Bereit, die elektrochemische Forschung oder industrielle Prozesse Ihres Labors voranzutreiben? KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborausrüstung und Verbrauchsmaterialien, einschließlich zuverlässiger Netzteile und elektrochemischer Zellen, die auf Ihre spezifischen Bedürfnisse zugeschnitten sind. Egal, ob Sie neue Batterietechnologien entwickeln oder Galvanisierungssysteme optimieren, unsere Expertise stellt sicher, dass Sie die richtigen Werkzeuge für den Erfolg haben. Kontaktieren Sie uns noch heute, um zu besprechen, wie wir Ihre Projekte mit Präzisionsgeräten und Expertenlösungen unterstützen können!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
Andere fragen auch
- Was ist die Funktion der Elektrolysezelle im Cu-Cl-Zyklus? Optimierung der Wasserstoffproduktion und Energieeffizienz
- Wie unterscheiden sich die Leistung von Elektrolyt-unterstützten Zellen (ESC) und Kathoden-unterstützten Zellen (CSC) bei der Hochtemperatur-Festoxid-Elektrolyse (SOE)?
- Wie kann Kontamination bei Experimenten mit der Fünf-Port-Wasserbad-Elektrolysezelle vermieden werden? Meistern Sie das 3-Säulen-Protokoll
- Wie helfen Polarisationskurven und EIS, die Wirkung von Dotierungselementen auf HEAs zu bewerten? Verbessern Sie Ihre Legierungsforschung
- Wie lauten die Standard-Blendenöffnungs-Spezifikationen für nicht-versiegelte und versiegelte Elektrolysezellen? Wählen Sie das richtige Setup für Ihr Experiment
- Was ist elektrochemische Abscheidung in der Nanotechnologie? Eine kostengünstige Methode zum Aufbau von Nanostrukturen
- Was ist ein Beispiel für die Elektroabscheidungsmethode? Kupferbeschichtung für Präzisionsoberflächentechnik
- Was ist die Funktion einer H-Zellen-Elektrolysezelle mit austauschbarer Membran? Beherrschen Sie die präzise Reaktionskontrolle



















