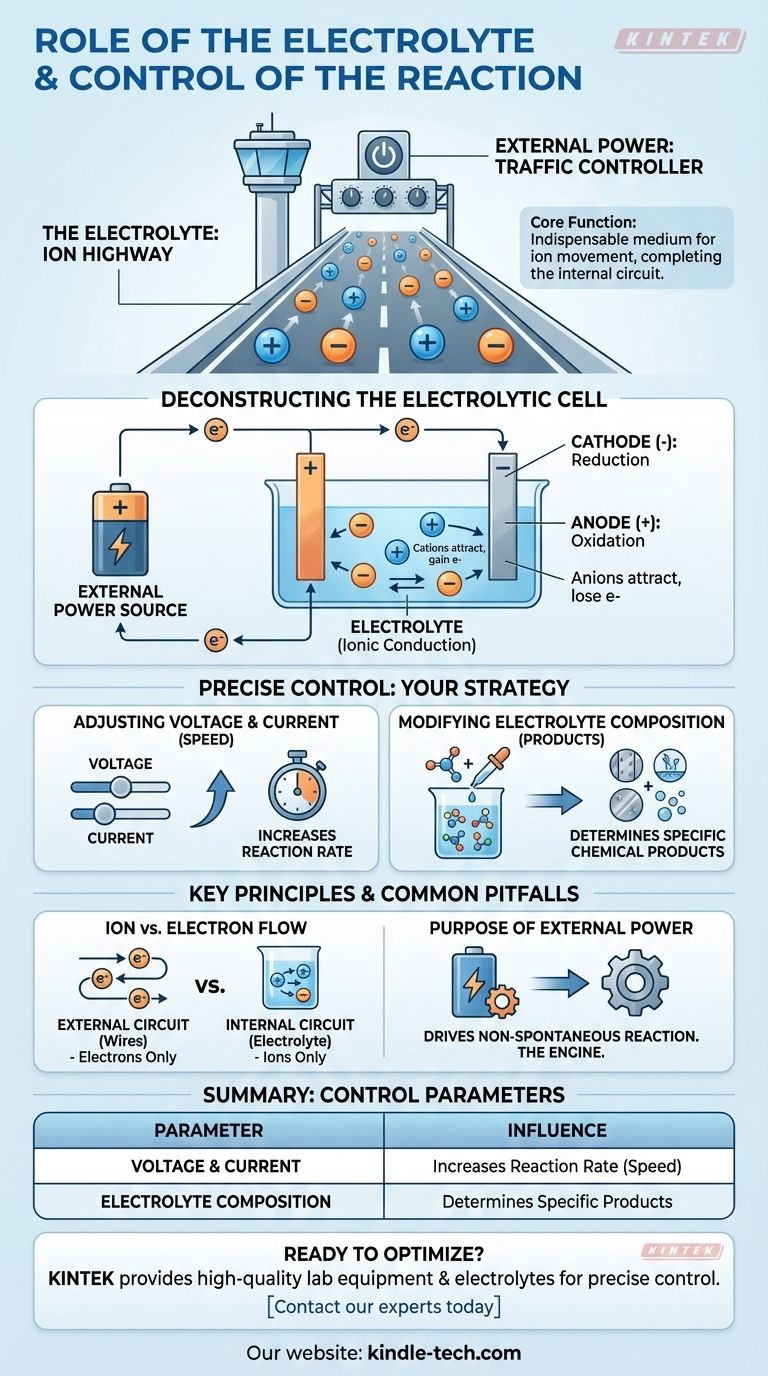
Im Kern ist der Elektrolyt das unverzichtbare Medium für die Ionenbewegung innerhalb einer Zelle, das den elektrischen Stromkreis schließt, der eine chemische Reaktion ermöglicht. Die Reaktion selbst wird präzise gesteuert, indem externe elektrische Eingaben – insbesondere die Spannung und der Strom – manipuliert und die chemische Zusammensetzung der Elektrolytlösung verändert werden.
Der Elektrolyt fungiert als „Ionenautobahn“, die es geladenen Teilchen ermöglicht, sich zwischen den Elektroden innerhalb der Zelle zu bewegen. Die externe Stromversorgung fungiert als „Verkehrsregler“, der die Geschwindigkeit und Richtung der chemischen Reaktion durch die Steuerung des Elektronenflusses vorgibt.

Die grundlegende Rolle des Elektrolyten
Eine elektrochemische Reaktion erfordert einen geschlossenen Stromkreis. Der Elektrolyt ist für die interne Hälfte dieses Stromkreises verantwortlich, eine Rolle, die sich grundlegend von den extern angeschlossenen Drähten unterscheidet.
Was ist ein Elektrolyt?
Ein Elektrolyt ist eine Lösung, typischerweise wässrig oder organisch, die dissoziierte Ionen enthält.
Diese frei schwebenden positiven und negativen Ionen machen die Lösung elektrisch leitfähig.
Ermöglichung der Ionenleitung
Die Hauptfunktion des Elektrolyten ist die Ionenleitung.
Während Elektronen durch die externen Drähte fließen, müssen Ionen durch die Lösung zwischen den beiden Elektroden fließen. Diese Bewegung geladener Ionen schließt den Stromkreis und ermöglicht die Aufrechterhaltung der Reaktion.
Zerlegung der Elektrolysezelle
In einer Elektrolysezelle treibt eine externe Stromquelle eine chemische Reaktion an, die sonst nicht von selbst ablaufen würde. So arbeiten die Komponenten zusammen.
Die externe Stromquelle
Der Prozess beginnt mit einer externen Stromquelle, wie einer Batterie oder einem Netzteil.
Diese Quelle pumpt aktiv Elektronen und erzeugt einen Ladungsunterschied zwischen den beiden Elektroden, der die Reaktion erzwingt.
Die Kathode (Ort der Reduktion)
Die externe Quelle drückt Elektronen zur Kathode und verleiht ihr eine negative Ladung.
Diese negative Ladung zieht die positiv geladenen Ionen (Kationen) aus dem Elektrolyten an. Wenn diese Ionen die Kathode erreichen, nehmen sie Elektronen in einem Prozess auf, der als Reduktion bezeichnet wird.
Die Anode (Ort der Oxidation)
Gleichzeitig zieht die externe Quelle Elektronen von der Anode ab und verleiht ihr eine positive Ladung.
Diese positive Ladung zieht die negativ geladenen Ionen (Anionen) aus dem Elektrolyten an. An der Anode verlieren diese Ionen Elektronen in einem Prozess, der als Oxidation bekannt ist.
Wie die Reaktion präzise gesteuert wird
Sie haben direkte Kontrolle über das Ergebnis und die Geschwindigkeit der elektrochemischen Reaktion, indem Sie drei Schlüsselparameter anpassen.
Anpassung von Spannung und Stromstärke
Spannung kann als der elektrische „Druck“ betrachtet werden, der die Reaktion antreibt, während die Stromstärke die Rate des Elektronenflusses ist.
Die Erhöhung von Spannung und Stromstärke erhöht im Allgemeinen die Geschwindigkeit, mit der die chemische Reaktion abläuft. Dies gibt Ihnen eine direkte, Echtzeit-Kontrolle über die Prozessgeschwindigkeit.
Änderung der Elektrolytzusammensetzung
Die spezifische chemische Reaktion, die stattfindet, wird durch die im Elektrolyten verfügbaren Ionen bestimmt.
Durch Änderung der Zusammensetzung des Elektrolyten – zum Beispiel durch die Verwendung eines anderen Salzes oder Lösungsmittels – können Sie die Produkte ändern, die sich an Anode und Kathode bilden.
Häufige Fallstricke und Schlüsselprinzipien
Um das System wirklich zu verstehen, ist es entscheidend, zwischen den beiden Hälften des Stromkreises und der Art der Zelle zu unterscheiden.
Ionenbewegung vs. Elektronenfluss
Ein häufiger Verwechslungspunkt ist der Unterschied zwischen dem, was innerhalb und außerhalb der Zelle geschieht.
Elektronen fließen nur durch den externen Stromkreis (die Drähte). Ionen fließen nur durch den internen Stromkreis (den Elektrolyten). Die Reaktion an den Elektrodenoberflächen verbindet diese beiden unterschiedlichen Wege.
Der Zweck der externen Energie
Es ist wichtig zu bedenken, dass dieser Prozess eine Elektrolysezelle beschreibt.
In diesen Zellen wird elektrische Energie genutzt, um eine nicht-spontane chemische Reaktion anzutreiben. Die externe Stromquelle ist nicht optional; sie ist der Motor, der den gesamten Prozess ermöglicht.
Die richtige Wahl für Ihr Ziel treffen
Ihre Kontrollstrategie hängt vollständig davon ab, was Sie mit der Reaktion erreichen möchten.
- Wenn Ihr Hauptaugenmerk darauf liegt, die Reaktionsgeschwindigkeit zu erhöhen: Erhöhen Sie die angelegte Spannung und Stromstärke, um den Fluss von Elektronen und Ionen schneller voranzutreiben.
- Wenn Ihr Hauptaugenmerk darauf liegt, ein spezifisches chemisches Produkt zu erzeugen: Wählen und steuern Sie die Zusammensetzung des Elektrolyten sorgfältig, um sicherzustellen, dass die gewünschten Ionen für die Reaktion verfügbar sind.
- Wenn Ihr Hauptaugenmerk darauf liegt, die Effizienz des Systems zu verstehen: Sie müssen sowohl den Elektronenfluss (Stromstärke) im externen Stromkreis als auch die resultierende chemische Veränderung (Ionenkonversion) an den Elektroden überwachen.
Letztendlich bedeutet die Beherrschung eines elektrochemischen Prozesses zu verstehen, dass der Elektrolyt und der externe Stromkreis zwei Hälften eines einzigen, steuerbaren Systems sind.
Zusammenfassungstabelle:
| Kontrollparameter | Wie er die Reaktion beeinflusst |
|---|---|
| Spannung & Stromstärke | Erhöht die Rate (Geschwindigkeit) der chemischen Reaktion. |
| Elektrolytzusammensetzung | Bestimmt die spezifischen chemischen Produkte, die gebildet werden. |
Bereit, Ihren elektrochemischen Prozess zu optimieren?
Ob Sie neue Materialien entwickeln, Galvanisierungen durchführen oder präzise analytische Tests durchführen – die Kontrolle Ihrer elektrochemischen Reaktion ist entscheidend. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborausrüstung und Verbrauchsmaterialien für all Ihre Laboranforderungen, einschließlich zuverlässiger Netzteile und reiner Elektrolyte.
Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie wir Ihnen helfen können, präzise Kontrolle und hervorragende Ergebnisse in Ihrem Labor zu erzielen.
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
Andere fragen auch
- Wie sollte die H-Typ-Elektrolysezelle bei Nichtgebrauch gelagert werden? Leitfaden zur fachgerechten Lagerung und Wartung
- Wie ist die Gesamtstruktur der optischen H-Typ-Doppelschicht-Wasserbad-Elektrolysezelle aufgebaut? Präzisionsdesign für kontrollierte Experimente
- Was ist eine H-Zelle? Ein Leitfaden für geteilte elektrochemische Zellen für präzise Experimente
- Wie lauten die standardmäßigen Öffnungsspezifikationen für eine austauschbare Membran-Elektrolysezelle vom H-Typ? Asymmetrische Anschlüsse für präzise Elektrochemie
- Was ist der Zweck der Doppelglasschichtstruktur in der H-Typ-Elektrolysezelle? Präzise Temperaturregelung erreichen



















