Bei der Auswahl eines Elektrolyten für ein Experiment müssen Sie vier Schlüsseleigenschaften bewerten: seine Ionenleitfähigkeit, sein elektrochemisches Stabilitätsfenster, seine Löslichkeit im gewählten Lösungsmittel und seine chemische Kompatibilität mit Ihrem gesamten experimentellen System. Diese Faktoren bestimmen gemeinsam, ob der Elektrolyt die von Ihnen gewünschte Reaktion unterstützt oder Artefakte einführt, die Ihre Ergebnisse ungültig machen.
Die zentrale Erkenntnis ist, dass ein Elektrolyt nicht nur ein passiver Leiter ist. Er ist eine aktive chemische Komponente, die die Betriebsgrenzen Ihrer elektrochemischen Zelle definiert und direkt an Nebenreaktionen teilnehmen kann, wodurch seine sorgfältige Auswahl grundlegend für den Erhalt zuverlässiger und aussagekräftiger Daten ist.

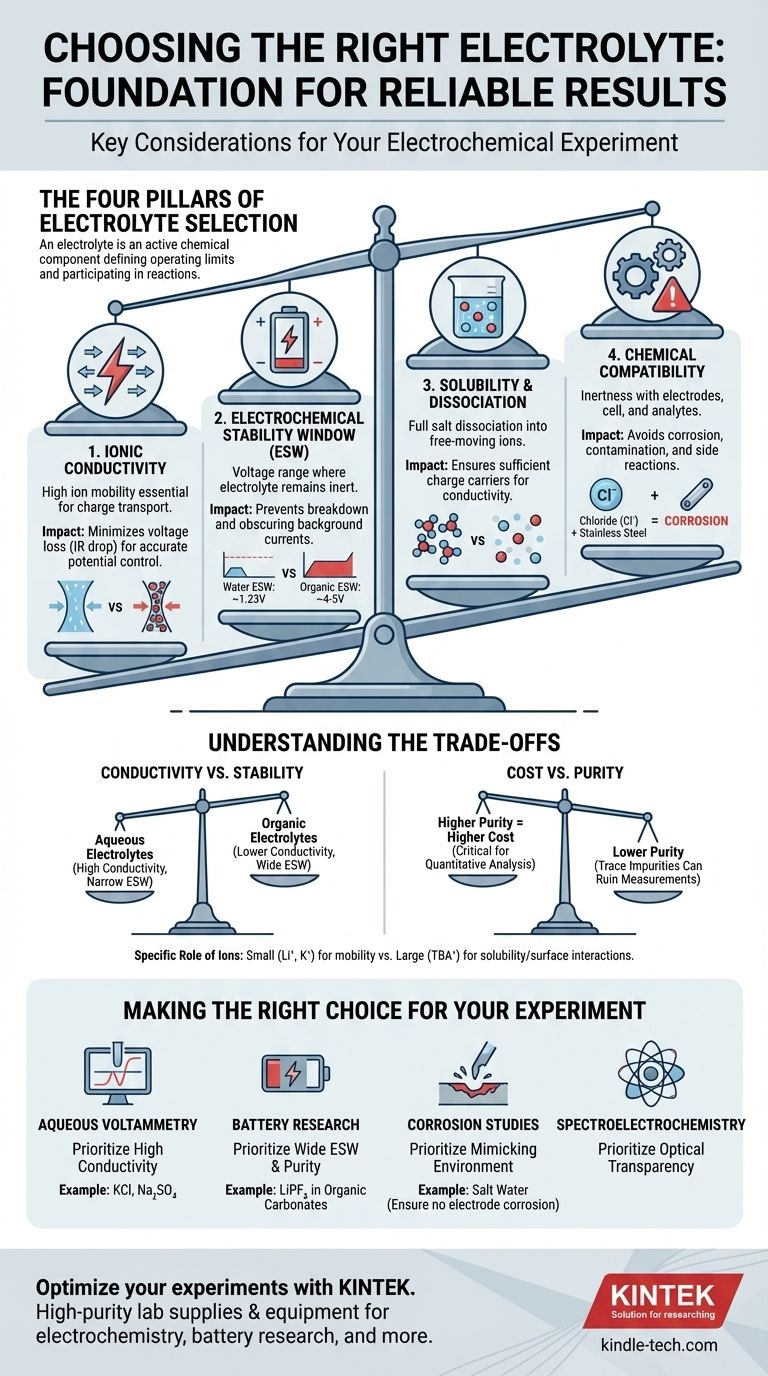
Die vier Säulen der Elektrolytauswahl
Die Wahl des richtigen Elektrolyten ist ein Prozess des Ausbalancierens von Anforderungen. Der ideale Elektrolyt erleichtert Ihre gewünschte Reaktion, während er vollständig inert und für die Messung unsichtbar bleibt. Wir können diesen Auswahlprozess in vier kritische Überlegungen unterteilen.
Säule 1: Ionenleitfähigkeit
Die Hauptaufgabe eines Elektrolyten ist der Ladungstransport zwischen den Elektroden. Eine hohe Ionenleitfähigkeit ist dafür unerlässlich.
Eine schlechte Leitfähigkeit führt zu einem großen ohmschen Abfall (oder IR-Abfall), einem Spannungsverlust über den Elektrolyten. Das bedeutet, dass das Potenzial, das Sie an Ihre Zelle anlegen, nicht das Potenzial ist, das tatsächlich an der Elektrodenoberfläche anliegt, was zu ungenauen Messungen der Reaktionspotenziale führt.
Stellen Sie sich den Elektrolyten als eine Autobahn für Ionen vor. Ein Elektrolyt mit hoher Leitfähigkeit ist eine breite, freie Autobahn, während ein Elektrolyt mit geringer Leitfähigkeit eine verstopfte Seitenstraße ist, die alles verlangsamt und Energie verschwendet.
Säule 2: Elektrochemisches Stabilitätsfenster (ESW)
Das elektrochemische Stabilitätsfenster (ESW) ist der Potentialbereich, in dem der Elektrolyt selbst – sowohl das Salz als auch das Lösungsmittel – nicht oxidiert oder reduziert wird.
Der Betrieb außerhalb dieses Fensters ist ein kritischer Fehler. Wenn Sie ein zu positives oder zu negatives Potential anlegen, beginnen Sie, den Elektrolyten abzubauen, anstatt Ihren Analyten zu untersuchen. Dies erzeugt große Hintergrundströme, die das Signal, das Sie messen möchten, vollständig verdecken können.
Zum Beispiel beträgt das ESW von Wasser nur etwa 1,23 V. Für Experimente, die höhere Potentiale erfordern, wie in der Lithium-Ionen-Batterieforschung, müssen Sie auf organische Lösungsmittel und spezifische Salze (z. B. LiPF₆ in organischen Carbonaten) umsteigen, die ein viel breiteres Fenster (~4-5 V) bieten.
Säule 3: Löslichkeit und Dissoziation
Damit ein Elektrolyt funktioniert, muss das Salz nicht nur gelöst, sondern auch vollständig in frei bewegliche Kationen und Anionen im Lösungsmittel dissoziiert sein.
Wenn das Salz eine schlechte Löslichkeit aufweist oder statt der Trennung feste „Ionenpaare“ bildet, nimmt die Anzahl der verfügbaren Ladungsträger dramatisch ab. Dies senkt direkt die Ionenleitfähigkeit und untergräbt die primäre Funktion des Elektrolyten.
Stellen Sie immer sicher, dass Ihr gewähltes Salz in Ihrem gewählten Lösungsmittel in der von Ihnen beabsichtigten Konzentration (typischerweise 0,1 M bis 1,0 M für Laborexperimente) gut löslich ist.
Säule 4: Chemische Kompatibilität
Der Elektrolyt muss chemisch inert gegenüber jeder Komponente in Ihrer Zelle sein: der Arbeitselektrode, Gegenelektrode, Referenzelektrode und dem Zellkörper selbst.
Ein häufiger Fehler ist die Verwendung eines Elektrolyten, der Chloridionen (wie KCl) enthält, mit Edelstahlkomponenten. Chlorid ist stark korrosiv für Edelstahl und verursacht Lochfraß und die Freisetzung von Metallionen in Ihre Lösung, wodurch das Experiment kontaminiert wird.
Ebenso sollten die Ionen des Elektrolyten nicht mit Ihrer Elektrodenoberfläche reagieren oder zu stark daran adsorbieren, es sei denn, diese Wechselwirkung ist das spezifische Phänomen, das Sie untersuchen.
Die Kompromisse verstehen
Es gibt keinen einzigen „besten“ Elektrolyten; jede Wahl beinhaltet das Abwägen konkurrierender Faktoren. Das Verständnis dieser Kompromisse ist das Merkmal eines erfahrenen Forschers.
Leitfähigkeit vs. Stabilität
Wässrige Elektrolyte (z. B. NaCl in Wasser) bieten eine ausgezeichnete Ionenleitfähigkeit, haben aber ein sehr enges elektrochemisches Stabilitätsfenster. Umgekehrt bieten viele Elektrolyte auf Basis organischer Lösungsmittel ein breites Stabilitätsfenster, leiden aber oft unter geringerer Leitfähigkeit. Ihre Wahl hängt davon ab, ob Ihr Experiment durch Spannung oder Stromeffizienz begrenzt ist.
Kosten vs. Reinheit
Hochreine Salze und Lösungsmittel der Güteklasse „Batteriequalität“ oder „elektrochemische Qualität“ sind deutlich teurer. Spurenverunreinigungen (wie Wasser in einem nicht-wässrigen Elektrolyten oder Halogenidionen) können jedoch unerwünschte elektrochemische Signale einführen und empfindliche Messungen ruinieren. Für einfache Demonstrationen mag eine geringere Qualität ausreichen, aber für die quantitative Analyse ist die Investition in Reinheit entscheidend.
Die spezifische Rolle von Ionen
Nicht alle Ionen sind gleich. Kleine, bewegliche Ionen wie Lithium (Li⁺) oder Kalium (K⁺) sind ausgezeichnete Ladungsträger. Große organische Ionen wie Tetrabutylammonium (TBA⁺) werden jedoch oft verwendet, um die Löslichkeit unpolarer Analyten in polaren Lösungsmitteln zu erhöhen und können helfen, unerwünschte Wechselwirkungen an der Elektrodenoberfläche zu minimieren.
Die richtige Wahl für Ihr Experiment treffen
Ihr spezifisches Ziel bestimmt, welche Eigenschaften Priorität haben.
- Wenn Ihr Hauptaugenmerk auf der Standard-Voltammetrie in wässrigen Lösungen liegt: Priorisieren Sie hohe Leitfähigkeit und verwenden Sie ein einfaches, inertes Salz wie Kaliumchlorid (KCl) oder Natriumsulfat (Na₂SO₄), wobei Sie sicherstellen, dass Ihr Potentialbereich innerhalb des Stabilitätsfensters von Wasser bleibt.
- Wenn Ihr Hauptaugenmerk auf der Hochspannungs-Batterieforschung liegt: Priorisieren Sie ein breites elektrochemisches Stabilitätsfenster und extreme Reinheit, typischerweise unter Verwendung von Salzen wie LiPF₆ oder LiClO₄ in einer Mischung aus organischen Carbonatlösungsmitteln.
- Wenn Ihr Hauptaugenmerk auf Korrosionsstudien liegt: Priorisieren Sie die Schaffung eines Elektrolyten, der die reale Umgebung genau nachbildet (z. B. Salzwasser), während Sie sicherstellen, dass er Ihre Referenz- oder Gegenelektroden nicht korrodiert.
- Wenn Ihr Hauptaugenmerk auf der Spektroelektrochemie liegt: Priorisieren Sie die optische Transparenz sowohl des Salzes als auch des Lösungsmittels in Ihrem gewünschten Wellenlängenbereich, zusätzlich zu den standardmäßigen elektrochemischen Anforderungen.
Letztendlich legt der von Ihnen gewählte Elektrolyt die Bühne fest und definiert die Regeln für Ihre gesamte elektrochemische Messung.
Zusammenfassungstabelle:
| Auswahlsäule | Wichtige Überlegung | Auswirkungen auf das Experiment |
|---|---|---|
| Ionenleitfähigkeit | Hohe Ionenbeweglichkeit | Minimiert Spannungsverluste (IR-Abfall) für genaue Potentialkontrolle. |
| Elektrochemisches Stabilitätsfenster (ESW) | Spannungsbereich der Stabilität | Verhindert Elektrolytzerfall und verdeckende Hintergrundströme. |
| Löslichkeit & Dissoziation | Vollständige Salzdissoziation in Ionen | Gewährleistet ausreichend Ladungsträger für effektive Leitfähigkeit. |
| Chemische Kompatibilität | Inertheit gegenüber Zellkomponenten | Vermeidet Korrosion, Kontamination und unerwünschte Nebenreaktionen. |
Bereit, Ihre elektrochemischen Experimente mit der richtigen Laborausrüstung und Verbrauchsmaterialien zu optimieren? Der richtige Elektrolyt ist nur ein Teil der Gleichung. KINTEK ist spezialisiert auf die Bereitstellung hochreiner Laborbedarf und -ausrüstung, maßgeschneidert für Elektrochemie, Batterieforschung, Korrosionsstudien und mehr. Unsere Produkte helfen Ihnen, die präzise Kontrolle und zuverlässigen Daten zu erzielen, die Ihre Arbeit erfordert.
Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Anwendungsbedürfnisse zu besprechen und zu entdecken, wie KINTEK den Erfolg Ihres Labors unterstützen kann.
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- Doppelte Wasserbad-Elektrolysezelle
- Dünnschicht-Spektroelektrochemische Zelle
Andere fragen auch
- Wie lauten die standardmäßigen Öffnungsspezifikationen für eine austauschbare Membran-Elektrolysezelle vom H-Typ? Asymmetrische Anschlüsse für präzise Elektrochemie
- Wie ist die Gesamtstruktur der optischen H-Typ-Doppelschicht-Wasserbad-Elektrolysezelle aufgebaut? Präzisionsdesign für kontrollierte Experimente
- Was ist eine H-Zelle? Ein Leitfaden für geteilte elektrochemische Zellen für präzise Experimente
- Welche optischen Merkmale weist die H-Typ-Elektrolysezelle auf? Präzisions-Quarzglasfenster für die Photoelektrochemie
- Wie sollte die H-Typ-Elektrolysezelle bei Nichtgebrauch gelagert werden? Leitfaden zur fachgerechten Lagerung und Wartung



















