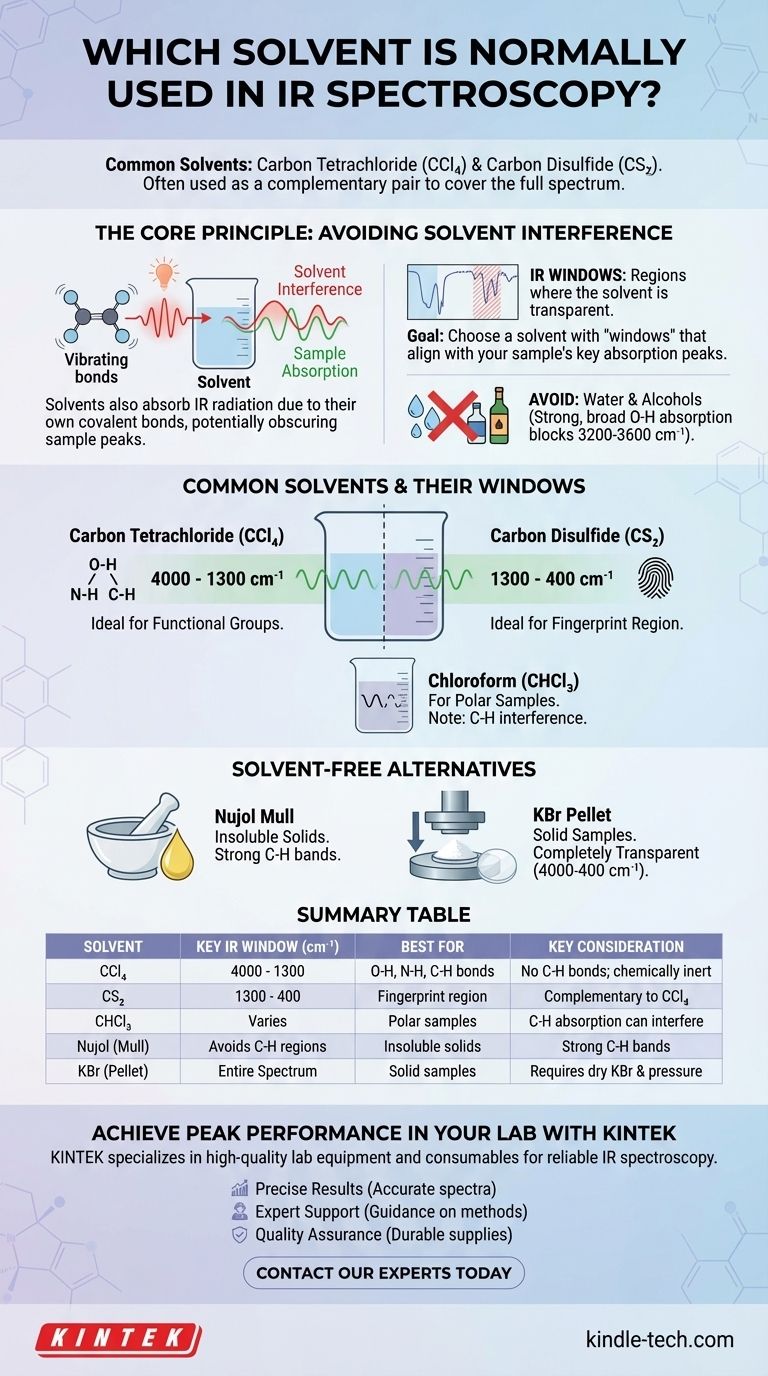
Die gebräuchlichsten Lösungsmittel für die IR-Spektroskopie sind Tetrachlorkohlenstoff (CCl₄) und Schwefelkohlenstoff (CS₂). Da kein einzelnes Lösungsmittel über das gesamte Infrarotspektrum transparent ist, werden diese beiden oft als komplementäres Paar verwendet, um verschiedene Bereiche zu analysieren. Die Wahl des Lösungsmittels ist entscheidend, da das Ziel darin besteht, die Probe zu lösen, ohne dass die eigenen molekularen Schwingungen des Lösungsmittels die Absorptionsbanden der Probe verdecken.
Das Grundprinzip der Lösungsmittelauswahl in der IR-Spektroskopie besteht darin, ein Medium zu finden, das Ihre Verbindung löst, aber in dem spektralen Bereich, der Sie interessiert, selbst "unsichtbar" ist. Da kein perfektes Lösungsmittel existiert, beinhaltet der Prozess die strategische Auswahl eines Lösungsmittels mit bekannten transparenten "Fenstern", die mit den Hauptabsorptionspeaks Ihrer Probe übereinstimmen.

Das Kernprinzip: Vermeidung von Lösungsmittelinterferenzen
Die Infrarotspektroskopie funktioniert durch Messung der Schwingungen von Molekülbindungen. Die Herausforderung besteht darin, dass die kovalenten Bindungen innerhalb jedes Lösungsmittelmoleküls ebenfalls IR-Strahlung absorbieren und eigene Spektralpeaks erzeugen, die die Peaks Ihrer Probe stören oder vollständig maskieren können.
Warum Lösungsmittel IR-Strahlung absorbieren
Genau wie Ihre Probe bestehen Lösungsmittelmoleküle aus Atomen, die durch kovalente Bindungen verbunden sind. Diese Bindungen (wie C-H, C-Cl, C=S) dehnen und biegen sich bei bestimmten Frequenzen, wenn sie Infrarotlicht absorbieren. Diese Absorption ist die Ursache für Interferenzen.
Das Konzept der "IR-Fenster"
Kein Lösungsmittel ist über den gesamten mittleren IR-Bereich (4000 – 400 cm⁻¹) transparent. Jedes Lösungsmittel hat jedoch Bereiche, in denen es nur schwach oder gar nicht absorbiert. Diese Bereiche werden als "IR-Fenster" bezeichnet.
Ziel ist es, ein Lösungsmittel zu wählen, dessen Fenster mit den Absorptionsbereichen der funktionellen Gruppen übereinstimmen, die Sie in Ihrer Probe untersuchen möchten.
Das Problem mit Wasser und Alkoholen
Lösungsmittel mit -OH-Gruppen, wie Wasser und Ethanol, werden fast nie für IR verwendet. Die O-H-Bindung erzeugt eine extrem starke und breite Absorptionsbande, die einen weiten und wichtigen Bereich des Spektrums (ungefähr 3200-3600 cm⁻¹) vollständig verdeckt, wodurch es unmöglich wird, Probenpeaks in diesem Bereich zu sehen.
Gängige Lösungsmittel und ihre Fenster
Um ein vollständiges Spektrum zu erhalten, führen Chemiker oft zwei Scans derselben Probe durch: einen in einem Lösungsmittel, das im Hochfrequenzbereich klar ist, und einen weiteren in einem Lösungsmittel, das im niederfrequenten "Fingerprint"-Bereich klar ist.
Tetrachlorkohlenstoff (CCl₄)
Dies ist die Standardwahl für den Bereich von 4000 cm⁻¹ bis 1300 cm⁻¹. Da es keine C-H-Bindungen enthält, ist es transparent, wo C-H-, N-H- und O-H-Streckschwingungen auftreten, was es ideal für die Analyse dieser kritischen funktionellen Gruppen macht.
Schwefelkohlenstoff (CS₂)
Dies ist das komplementäre Lösungsmittel zu CCl₄. Es ist weitgehend transparent im Fingerprint-Bereich von 1300 cm⁻¹ bis 400 cm⁻¹. Dies ermöglicht eine detaillierte Analyse der komplexen Schwingungen, die einem Molekül seine einzigartige spektrale Identität verleihen.
Chloroform (CHCl₃)
Chloroform ist ein polareres Lösungsmittel und kann eine gute Wahl sein, wenn Ihre Probe nicht in CCl₄ oder CS₂ löslich ist. Seine eigene C-H-Bindung erzeugt jedoch Absorptionsbanden (um 3000 cm⁻¹ und 1200 cm⁻¹), die die Analyse von C-H-Bindungen in der Probe stören können.
Die Kompromisse und Alternativen verstehen
Die Wahl eines Lösungsmittels ist nur eine Möglichkeit, eine Probe vorzubereiten. Wenn Ihre Verbindung unlöslich ist oder wenn Lösungsmittelinterferenzen unvermeidlich sind, gibt es andere Standardtechniken.
Chemische Inertheit ist nicht verhandelbar
Wie im Referenzmaterial vermerkt, darf das Lösungsmittel nicht mit Ihrer Probe reagieren. Die Verwendung eines sauren Lösungsmittels für eine basische Probe würde beispielsweise zu einem Ionenpaar führen, und Sie würden das Spektrum einer völlig anderen chemischen Spezies analysieren, als Sie beabsichtigt hatten.
Der Nujol-Mull: Eine lösungsmittelfreie Alternative
Wenn eine Probe in allen geeigneten IR-Lösungsmitteln unlöslich ist, ist ein Nujol-Mull die bevorzugte Technik. Die feste Probe wird zu einem feinen Pulver gemahlen und mit einem Tropfen Nujol (einem Mineralöl) vermischt, um eine Paste zu bilden.
Diese Paste wird dann zur Analyse zwischen zwei Salzplatten gepresst. Nujol selbst besteht aus langkettigen Kohlenwasserstoffen, daher zeigt es starke C-H-Absorptionsbanden, ist aber an anderer Stelle transparent, was die Analyse der meisten anderen funktionellen Gruppen ermöglicht.
Das KBr-Pressling
Eine weitere gängige lösungsmittelfreie Methode ist der KBr-Pressling. Die feste Probe wird mit reinem, trockenem Kaliumbromid (KBr)-Pulver vermischt und unter hohem Druck zu einer kleinen, transparenten Scheibe gepresst. KBr ist ionisch gebunden und absorbiert keine IR-Strahlung, was es zu einem vollständig transparenten Medium für die Analyse macht.
Die richtige Wahl für Ihre Analyse treffen
Ihre Wahl der Probenvorbereitungsmethode hängt vollständig von den physikalischen Eigenschaften Ihrer Probe und den spezifischen Informationen ab, die Sie aus dem Spektrum benötigen.
- Wenn Ihr Hauptaugenmerk auf O-H-, N-H- oder C-H-Bindungen liegt (4000-1300 cm⁻¹): Verwenden Sie Tetrachlorkohlenstoff (CCl₄) wegen seiner hervorragenden Transparenz in diesem Bereich.
- Wenn Ihr Hauptaugenmerk auf dem Fingerprint-Bereich liegt (1300-400 cm⁻¹): Verwenden Sie Schwefelkohlenstoff (CS₂), um eine klare Sicht auf die komplexen Schwingungen zu erhalten, die für Ihr Molekül einzigartig sind.
- Wenn Ihre Probe in unpolaren Lösungsmitteln unlöslich ist: Ziehen Sie eine polarere Option wie Chloroform in Betracht oder verzichten Sie ganz auf flüssige Lösungsmittel und bereiten Sie einen KBr-Pressling oder einen Nujol-Mull vor.
Letztendlich geht es bei einer effektiven Probenvorbereitung darum, sicherzustellen, dass das aufgezeichnete Spektrum das Ihrer Verbindung ist und kein Artefakt Ihres gewählten Mediums.
Zusammenfassungstabelle:
| Lösungsmittel | Schlüssel-IR-Fenster (cm⁻¹) | Am besten für | Wichtige Überlegung |
|---|---|---|---|
| Tetrachlorkohlenstoff (CCl₄) | 4000 - 1300 | O-H-, N-H-, C-H-Bindungen | Keine C-H-Bindungen; chemisch inert |
| Schwefelkohlenstoff (CS₂) | 1300 - 400 | Fingerprint-Bereich | Komplementär zu CCl₄ |
| Chloroform (CHCl₃) | Variiert (z.B. Lücken um 3000 cm⁻¹) | Polare Proben | C-H-Absorption kann stören |
| Nujol (Mull) | Vermeidet C-H-Bereiche | Unlösliche Feststoffe | Starke C-H-Banden von Nujol |
| KBr (Pressling) | Gesamtes Spektrum (4000-400) | Feste Proben | Erfordert trockenes KBr und hohen Druck |
Erzielen Sie Spitzenleistungen in Ihrem Labor
Die Navigation bei der Lösungsmittelauswahl ist nur ein Schritt zu einer präzisen Materialanalyse. KINTEK ist darauf spezialisiert, hochwertige Laborgeräte und Verbrauchsmaterialien bereitzustellen, die Sie für eine zuverlässige IR-Spektroskopie und darüber hinaus benötigen.
Lassen Sie uns Ihnen helfen, die Fähigkeiten Ihres Labors zu verbessern:
- Präzise Ergebnisse: Stellen Sie sicher, dass Ihre Probenvorbereitung zu genauen, störungsfreien Spektren führt.
- Expertenunterstützung: Erhalten Sie Beratung zu den richtigen Werkzeugen und Methoden für Ihre spezifische Anwendung.
- Qualitätssicherung: Vertrauen Sie auf unsere langlebigen, zuverlässigen Verbrauchsmaterialien für konstante Leistung.
Bereit, Ihre Analyseprozesse zu optimieren? Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie KINTEK die einzigartigen Anforderungen Ihres Labors in der Spektroskopie und Materialanalyse unterstützen kann.
Visuelle Anleitung
Ähnliche Produkte
- Verdampfungsschale für organische Substanz
- Iridiumdioxid IrO2 für die Wasserelektrolyse
- Hochdruck-Laborautoklav-Reaktor für Hydrothermalsynthese
- Anpassbare Hochdruckreaktoren für fortschrittliche wissenschaftliche und industrielle Anwendungen
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
Andere fragen auch
- Was ist das Fundament der Sputterdeposition? Ein Leitfaden zur Dünnschichtbeschichtung auf atomarer Ebene
- Was ist eine Sputteranlage? Ein Leitfaden zur hochwertigen Dünnschichtabscheidung
- Was ist die Alternative zu FTIR? Finden Sie das richtige Werkzeug für Ihre Materialanalyse
- Was sind die vier Wärmebehandlungsmethoden zur Verbesserung der Stahleigenschaften? Glühen, Normalisieren, Härten und Vergüten
- Welcher ist besser, Hochofen oder Elektrolichtbogenofen? Wählen Sie die richtige Stahlherstellungstechnologie für Ihre Bedürfnisse
- Warum wird HF in der Sputtertechnik eingesetzt? Ermöglichung der Dünnschichtabscheidung auf Isoliermaterialien
- Welche verschiedenen Reaktortypen werden bei der Pyrolyse eingesetzt? Finden Sie die beste Lösung für Ihren Rohstoff und Ihre Ziele
- Welche Rolle spielen Labortrockenschränke bei der Pyrolyse von Zuckerrohrbagasse? Verbesserung der Bioölqualität & des GCV





