Einführung in elektrochemische Verbrauchsmaterialien
Inhaltsverzeichnis
Elektrochemische Verbrauchsmaterialien spielen eine entscheidende Rolle in elektrochemischen Experimenten und Anwendungen. Dazu gehören Elektroden, die die Übertragung von Elektronen erleichtern, und Elektrolyte, die Ionen für die elektrochemischen Reaktionen bereitstellen. Dieser umfassende Leitfaden erkundet die Welt der elektrochemischen Verbrauchsmaterialien und umfasst verschiedene Arten von Elektroden (Arbeits-, Hilfs- und Referenzelektroden) und Elektrolyte. Es befasst sich mit Faktoren, die bei der Auswahl von Materialien für elektrochemische Experimente oder Anwendungen zu berücksichtigen sind, um erfolgreiche und genaue Ergebnisse sicherzustellen.
Arten von Elektroden
Arbeitselektrode
Die Arbeitselektrode (WE) ist die Elektrode, an der die interessierende elektrochemische Reaktion stattfindet. Es besteht typischerweise aus einem Edelmetall wie Gold, Platin oder Kohlenstoff, das korrosionsbeständig ist und eine hohe elektrische Leitfähigkeit aufweist. Die Wahl des Materials für das WE hängt von der konkreten Anwendung ab. Beispielsweise wird Gold häufig für elektrochemische Sensoranwendungen verwendet, während Platin häufig für Brennstoffzellenanwendungen verwendet wird.
Hilfselektrode
Die Hilfselektrode (AE) dient zur Vervollständigung des Stromkreises in einer elektrochemischen Zelle. Es stellt einen Weg für den Stromfluss zwischen der WE und der Referenzelektrode bereit. Der AE besteht typischerweise aus einem Metall, das nicht leicht oxidiert oder reduziert wird, wie etwa Platin, Kohlenstoff, Kupfer oder Edelstahl. Die Wahl des Materials für das AE ist nicht so kritisch wie für das WE, es sollte jedoch mit dem Elektrolyten und dem WE-Material kompatibel sein.
Referenzelektrode
Die Referenzelektrode (RE) wird verwendet, um ein stabiles und reproduzierbares Referenzpotential bereitzustellen, gegen das das Potential der WE gemessen werden kann. Das RE besteht typischerweise aus einem Metall, das leicht oxidiert oder reduziert wird, wie etwa Silber, Kalomel oder Quecksilber. Die Wahl des Materials für den RE hängt von der konkreten Anwendung ab. Beispielsweise werden SEs aus Silber/Silberchlorid (Ag/AgCl) üblicherweise in wässrigen Lösungen verwendet, während Kalomel-SEs häufig in nichtwässrigen Lösungen verwendet werden.

Elektrolyte und ihre Eigenschaften
Elektrolyte sind Stoffe, die im geschmolzenen Zustand oder in wässriger Lösung bewegliche Ionen enthalten und so Strom leiten können. Sie spielen eine entscheidende Rolle in elektrochemischen Prozessen, etwa in Batterien, Brennstoffzellen und der Galvanisierung.
Arten von Elektrolyten
Elektrolyte können anhand ihres physikalischen Zustands in drei Haupttypen eingeteilt werden:
Flüssige Elektrolyte: Dies sind die häufigsten Elektrolyttypen und typischerweise Lösungen von Salzen, Säuren oder Basen in einem Lösungsmittel wie Wasser. Beispiele hierfür sind in Wasser gelöstes Natriumchlorid (NaCl), in Wasser gelöste Schwefelsäure (H2SO4) und in Wasser gelöstes Kaliumhydroxid (KOH).
Festelektrolyte: Festelektrolyte sind typischerweise ionische Verbindungen, die im festen Zustand Elektrizität leiten. Sie werden häufig in Festkörperbatterien und Brennstoffzellen eingesetzt. Beispiele hierfür sind Lithiumionen leitende Keramiken und Polymerelektrolyte.
Geschmolzene Elektrolyte: Geschmolzene Elektrolyte sind Salze, die bei hohen Temperaturen geschmolzen werden und dadurch Strom leiten können. Sie werden in Hochtemperaturanwendungen eingesetzt, beispielsweise in Salzschmelze-Reaktoren und bestimmten Batterietypen. Beispiele hierfür sind geschmolzenes Natriumchlorid (NaCl) und geschmolzenes Lithiumchlorid (LiCl).
Bei der Auswahl eines Elektrolyten zu berücksichtigende Faktoren
Bei der Auswahl eines Elektrolyten für eine bestimmte Anwendung müssen mehrere Faktoren berücksichtigt werden:
Leitfähigkeit: Die Leitfähigkeit eines Elektrolyten ist ein Maß für seine Fähigkeit, Elektrizität zu leiten. Sie wird durch die Konzentration der Ionen im Elektrolyten und die Mobilität dieser Ionen beeinflusst.
Stabilität: Der Elektrolyt sollte unter den Betriebsbedingungen der elektrochemischen Zelle stabil sein. Es darf sich nicht zersetzen oder mit den Elektroden oder anderen Komponenten der Zelle reagieren.
Kompatibilität mit Elektroden: Der Elektrolyt sollte mit den in der elektrochemischen Zelle verwendeten Elektroden kompatibel sein. Es darf die Elektroden nicht korrodieren oder auflösen.
Kosten: Auch die Kosten des Elektrolyten sind ein wichtiger Gesichtspunkt, insbesondere bei großtechnischen Anwendungen.
Anwendungen von Elektrolyten
Elektrolyte haben ein breites Anwendungsspektrum, darunter:
Batterien: Elektrolyte werden in Batterien verwendet, um ein Medium für den Ionentransport zwischen der positiven und negativen Elektrode bereitzustellen.
Brennstoffzellen: Elektrolyte werden in Brennstoffzellen verwendet, um die elektrochemischen Reaktionen zur Stromerzeugung zu erleichtern.
Galvanisieren: Beim Galvanisieren werden Elektrolyte verwendet, um eine dünne Metallschicht auf einer Oberfläche abzuscheiden.
Chemische Verarbeitung: Elektrolyte werden in verschiedenen chemischen Prozessen verwendet, beispielsweise bei der Herstellung von Chlor und Natriumhydroxid.

Überlegungen zur Materialauswahl
Die Materialauswahl für Elektroden und Elektrolyte in elektrochemischen Systemen ist ein entscheidender Schritt, der sich erheblich auf die Leistung, Effizienz und Kosteneffizienz des Gesamtprozesses auswirkt. Bei der Auswahl geeigneter Materialien müssen mehrere Faktoren berücksichtigt werden, darunter ihre inhärenten Eigenschaften, Reaktivität, Inertheit, Korrosionsbeständigkeit und Kosten.
Wünschenswerte Eigenschaften für Anoden-, Kathoden- und Elektrolytmaterialien
Anodenmaterialien:
- Effizientes Reduktionsmittel: Das Anodenmaterial sollte über starke Reduktionsfähigkeiten verfügen, um die gewünschten elektrochemischen Reaktionen zu erleichtern.
- Hohe Coulomb-Leistung: Es sollte eine hohe Coulomb-Effizienz aufweisen, um eine effiziente Nutzung des aktiven Materials zu gewährleisten und den Kapazitätsverlust zu minimieren.
- Gute Leitfähigkeit: Eine hohe elektrische Leitfähigkeit ist für eine effiziente Ladungsübertragung unerlässlich und minimiert Energieverluste aufgrund des ohmschen Widerstands.
- Stabilität: Das Anodenmaterial sollte unter den Betriebsbedingungen chemisch und elektrochemisch stabil sein, um eine Verschlechterung zu verhindern und die Leistung langfristig aufrechtzuerhalten.
- Einfache Herstellung: Das Material sollte leicht zu verarbeiten und in die gewünschten Formen und Abmessungen gebracht werden können, um eine kostengünstige Herstellung zu ermöglichen.
- Niedrige Kosten: Ein wirtschaftlich rentables Anodenmaterial ist für großtechnische Anwendungen, insbesondere in industriellen Umgebungen, von entscheidender Bedeutung.
Zu den häufig verwendeten Anodenmaterialien gehören Metalle wie Zink, Lithium und Graphit, die aufgrund ihrer spezifischen Eigenschaften und Eignung für die beabsichtigte Anwendung ausgewählt werden.
Kathodenmaterialien:
- Effizientes Oxidationsmittel: Das Kathodenmaterial sollte über starke Oxidationsfähigkeiten verfügen, um die gewünschten elektrochemischen Reaktionen zu erleichtern.
- Stabilität im Elektrolyten: Es sollte bei Kontakt mit dem Elektrolyten chemisch und elektrochemisch stabil sein, um eine Verschlechterung zu verhindern und die langfristige Leistung aufrechtzuerhalten.
- Nützliche Arbeitsspannung: Das Kathodenmaterial sollte einen geeigneten Arbeitsspannungsbereich aufweisen, der zu den gewünschten Betriebsbedingungen passt und eine effiziente Energiespeicherung oder -umwandlung gewährleistet.
- Einfache Herstellung: Ähnlich wie Anodenmaterialien sollte sich das Kathodenmaterial für eine kostengünstige Herstellung leicht verarbeiten und in die gewünschten Formen und Abmessungen bringen lassen.
- Niedrige Kosten: Wirtschaftlichkeit ist ein wichtiger Gesichtspunkt für Kathodenmaterialien, insbesondere bei großtechnischen Anwendungen.
Zu den häufig verwendeten Kathodenmaterialien gehören Metalloxide wie Lithium-Kobaltoxid (LCO), Lithium-Nickel-Mangan-Kobaltoxid (NMC) und Lithiumeisenphosphat (LFP), die aufgrund ihrer spezifischen Eigenschaften und Eignung für die beabsichtigte Anwendung ausgewählt werden.
Elektrolytmaterialien:
- Ionenleitfähigkeit: Der Elektrolyt sollte eine hohe Ionenleitfähigkeit aufweisen, um einen effizienten Ionentransport zu ermöglichen und den Widerstand gegen den Ladungsfluss zu minimieren.
- Chemische und elektrochemische Stabilität: Der Elektrolyt sollte unter den Betriebsbedingungen chemisch und elektrochemisch stabil sein, um eine Zersetzung zu verhindern und die langfristige Leistung aufrechtzuerhalten.
- Breites elektrochemisches Fenster: Der Elektrolyt sollte über ein breites elektrochemisches Fenster verfügen, das einen breiten Betriebsspannungsbereich ermöglicht, ohne dass es zu Zersetzung oder anderen unerwünschten Reaktionen kommt.
- Kompatibilität mit Elektroden: Der Elektrolyt sollte mit den Anoden- und Kathodenmaterialien kompatibel sein, um stabile Grenzflächen zu gewährleisten und unerwünschte Reaktionen zu verhindern.
- Ungiftig und umweltfreundlich: Der Elektrolyt sollte ungiftig und umweltfreundlich sein, um potenzielle Gefahren zu minimieren und eine sichere Handhabung und Entsorgung zu ermöglichen.
Zu den häufig verwendeten Elektrolyten gehören wässrige Lösungen, organische Lösungsmittel, ionische Flüssigkeiten und Festkörperelektrolyte, die aufgrund ihrer spezifischen Eigenschaften und Eignung für die beabsichtigte Anwendung ausgewählt werden.
Faktoren, die die Materialauswahl beeinflussen
Neben den oben genannten wünschenswerten Eigenschaften beeinflussen mehrere weitere Faktoren die Auswahl der Materialien für Elektroden und Elektrolyte:
- Reaktivität: Die Reaktivität der Materialien sollte sorgfältig abgewogen werden, um die Kompatibilität mit den beabsichtigten elektrochemischen Reaktionen sicherzustellen und unerwünschte Nebenreaktionen zu verhindern.
- Inertheit: Die Materialien sollten gegenüber den anderen Komponenten des elektrochemischen Systems, wie dem Elektrolyten und den Stromkollektoren, inert sein, um Korrosion zu minimieren und die Langzeitstabilität aufrechtzuerhalten.
- Korrosionsbeständigkeit: Die Materialien sollten unter den Betriebsbedingungen eine gute Korrosionsbeständigkeit aufweisen, um eine Verschlechterung zu verhindern und eine zuverlässige Leistung im Laufe der Zeit zu gewährleisten.
- Kosten: Die Materialkosten sind insbesondere bei Großanwendungen ein wesentlicher Faktor und müssen gegen die gewünschte Leistung und langfristige Kosteneffizienz abgewogen werden.
Durch sorgfältige Berücksichtigung dieser Faktoren und Auswahl geeigneter Materialien können Forscher und Ingenieure die Leistung, Effizienz und Kosteneffizienz elektrochemischer Systeme für verschiedene Anwendungen optimieren.
Anwendungen elektrochemischer Verbrauchsmaterialien
Elektrochemische Verbrauchsmaterialien sind spezielle Materialien und Komponenten, die in verschiedenen Branchen zur Durchführung elektrochemischer Experimente und Analysen eingesetzt werden. Sie spielen eine entscheidende Rolle in elektrochemischen Prozessen und ermöglichen die Untersuchung chemischer Reaktionen und des Verhaltens von Stoffen in Lösungen.
Energiespeicher
Elektrochemische Verbrauchsmaterialien finden umfangreiche Anwendungen in Energiespeichersystemen, einschließlich Batterien, Brennstoffzellen und Superkondensatoren. Diese Verbrauchsmaterialien sind wesentliche Bestandteile dieser Geräte und sorgen für die notwendigen elektrochemischen Reaktionen zur Energiespeicherung und -abgabe.
Batterien: Elektrochemische Verbrauchsmaterialien werden in Batterien verwendet, um die elektrochemischen Reaktionen zur Stromerzeugung zu ermöglichen. Zu den gängigen Batterietypen gehören Blei-Säure-Batterien, Lithium-Ionen-Batterien und Nickel-Cadmium-Batterien. Zu diesen Verbrauchsmaterialien gehören Elektroden, Separatoren und Elektrolyte.
Brennstoffzellen: Brennstoffzellen nutzen elektrochemische Reaktionen, um aus Brennstoffen wie Wasserstoff oder Methanol Strom zu erzeugen. Zu den elektrochemischen Verbrauchsmaterialien in Brennstoffzellen gehören Elektroden, Elektrolyte und Katalysatoren.
Superkondensatoren: Superkondensatoren speichern elektrische Energie durch elektrostatische Anziehung. Zu den elektrochemischen Verbrauchsmaterialien in Superkondensatoren gehören Elektroden und Elektrolyte.
Galvanisieren
Beim Galvanisieren handelt es sich um einen Prozess, bei dem elektrochemische Reaktionen genutzt werden, um eine Metalloberfläche mit einer dünnen Schicht eines anderen Metalls zu überziehen. Diese Beschichtung kann Korrosionsschutz bieten, die elektrische Leitfähigkeit verbessern oder das Erscheinungsbild des Metalls verbessern. Zu den elektrochemischen Verbrauchsmaterialien, die beim Galvanisieren verwendet werden, gehören:
Anoden: Anoden sind die positiv geladenen Elektroden im Galvanisierungsprozess. Sie bestehen typischerweise aus dem Metall, das auf der Oberfläche abgeschieden wird.
Kathoden: Kathoden sind die negativ geladenen Elektroden im Galvanikprozess. Sie bestehen typischerweise aus dem zu beschichtenden Metall.
Elektrolyte: Elektrolyte sind Lösungen, die Ionen enthalten und den Stromfluss zwischen Anode und Kathode ermöglichen.

Korrosionsstudien
Elektrochemische Verbrauchsmaterialien werden in Korrosionsstudien eingesetzt, um den Abbau von Metallen und Materialien zu untersuchen. Diese Studien helfen Forschern, die Mechanismen der Korrosion zu verstehen und Strategien zu entwickeln, um sie zu verhindern oder abzuschwächen. Zu den elektrochemischen Verbrauchsmaterialien, die in Korrosionsstudien verwendet werden, gehören:
Elektroden: Elektroden werden zur Messung des elektrischen Potenzials und des Stromflusses in Korrosionsexperimenten verwendet.
Elektrolyte: Elektrolyte sind Lösungen, die Ionen enthalten und den Stromfluss zwischen den Elektroden ermöglichen.
Korrosionszellen: Korrosionszellen sind von Japan entwickelte elektrochemische Zellen, die zur Simulation und Untersuchung von Korrosionsprozessen verwendet werden.
Chemische Analyse
Elektrochemische Verbrauchsmaterialien werden in verschiedenen Analysetechniken verwendet, um die Konzentration oder Eigenschaften von Substanzen in Lösung zu bestimmen. Zu diesen Techniken gehören:
Zyklische Voltammetrie: Die zyklische Voltammetrie ist eine elektrochemische Technik, bei der das Potenzial einer Arbeitselektrode abgetastet und der resultierende Strom gemessen wird. Es dient der Untersuchung des Redoxverhaltens von Stoffen und der Bestimmung ihrer elektrochemischen Eigenschaften.
Potentiometrie: Potentiometrie ist eine elektrochemische Technik, bei der die Potentialdifferenz zwischen zwei Elektroden in einer Lösung gemessen wird. Es wird verwendet, um die Konzentration von Ionen in einer Lösung zu bestimmen und Gleichgewichtsreaktionen zu untersuchen.
Amperometrie: Amperometrie ist eine elektrochemische Technik, bei der der Stromfluss zwischen zwei Elektroden in einer Lösung gemessen wird. Es wird verwendet, um die Kinetik elektrochemischer Reaktionen zu untersuchen und die Konzentration elektroaktiver Spezies in Lösung zu bestimmen.
Dies sind nur einige Beispiele für die vielfältigen Anwendungen elektrochemischer Verbrauchsmaterialien in verschiedenen Industrien und Forschungsbereichen. Diese speziellen Materialien spielen eine entscheidende Rolle bei der Weiterentwicklung unseres Verständnisses elektrochemischer Prozesse und ermöglichen die Entwicklung neuer Technologien und Produkte.
Zwei-Elektroden- und Drei-Elektroden-Aufbauten
Zwei-Elektroden-Aufbau
Bei einem Zwei-Elektroden-Aufbau dient eine einzelne Elektrode sowohl als Arbeitselektrode als auch als Gegenelektrode. Dieser Aufbau wird häufig bei einfachen elektrochemischen Experimenten wie qualitativen Analysen und Korrosionsstudien verwendet. Der Hauptvorteil des Zwei-Elektroden-Aufbaus ist seine Einfachheit. Es hat jedoch mehrere Nachteile, darunter die Unfähigkeit, das Potenzial der Arbeitselektrode zu steuern, und die Schwierigkeit, die Beiträge der Arbeits- und Gegenelektroden zum Gesamtstrom zu trennen.
Drei-Elektroden-Aufbau
Bei einem Drei-Elektroden-Aufbau wird eine spezielle Referenzelektrode verwendet, um das Potenzial der Arbeitselektrode zu steuern. Dies ermöglicht genauere und reproduzierbarere Messungen. Die Gegenelektrode wird verwendet, um den Stromkreis zu schließen und einen Weg für den Stromfluss bereitzustellen. Der Drei-Elektroden-Aufbau ist die am häufigsten in elektrochemischen Experimenten verwendete Konfiguration.
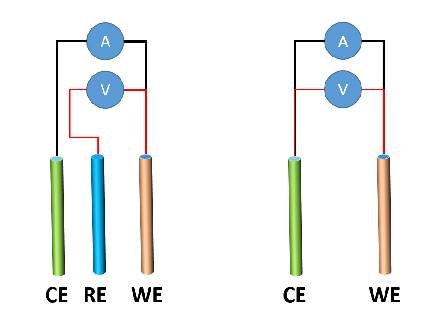
Vor- und Nachteile von Zwei-Elektroden- und Drei-Elektroden-Aufbauten
Die folgende Tabelle fasst die Vor- und Nachteile von Zwei-Elektroden- und Drei-Elektroden-Aufbauten zusammen:
| Einrichtung | Vorteile | Nachteile |
| Zwei-Elektroden | Einfach | Das Potenzial der Arbeitselektrode kann nicht gesteuert werden | Es ist schwierig, die Beiträge der Arbeits- und Gegenelektroden zum Gesamtstrom zu trennen | | Drei-Elektroden | Genauere und reproduzierbarere Messungen | Komplexer | Erfordert eine spezielle Referenzelektrode |
Wann sollte eine Zwei-Elektroden- oder Drei-Elektroden-Konfiguration verwendet werden?
Die Wahl, ob eine Zwei-Elektroden- oder Drei-Elektroden-Konfiguration verwendet werden soll, hängt vom konkret durchgeführten Experiment ab. Im Allgemeinen wird für quantitative Analysen und mechanistische Studien ein Drei-Elektroden-Aufbau bevorzugt. Für qualitative Analysen und Korrosionsstudien kann ein Zwei-Elektroden-Aufbau verwendet werden.
Anwendungen von Zwei-Elektroden- und Drei-Elektroden-Aufbauten
Zwei-Elektroden- und Drei-Elektroden-Aufbauten werden in einer Vielzahl elektrochemischer Experimente verwendet. Zu den häufigsten Anwendungen gehören:
- Zyklische Voltammetrie: Mit dieser Technik werden die elektrochemischen Eigenschaften eines Materials untersucht, indem das Potenzial der Arbeitselektrode zwischen zwei Werten hin und her bewegt wird.
- Lineare Sweep-Voltammetrie: Mit dieser Technik werden die elektrochemischen Eigenschaften eines Materials untersucht, indem das Potential der Arbeitselektrode linear von einem Wert zum anderen verschoben wird.
- Chronoamperometrie: Diese Technik wird verwendet, um die aktuelle Reaktion eines Materials auf eine sprunghafte Änderung des Potenzials zu untersuchen.
- Potentiometrie: Mit dieser Technik wird das Potenzial eines Materials unter Gleichgewichtsbedingungen gemessen.
Abschluss
Zwei-Elektroden- und Drei-Elektroden-Aufbauten sind wesentliche Werkzeuge für elektrochemische Experimente. Die Wahl der zu verwendenden Konfiguration hängt vom konkret durchgeführten Experiment ab.
Abschluss
Zusammenfassend lässt sich sagen, dass elektrochemische Verbrauchsmaterialien eine entscheidende Rolle für den Erfolg elektrochemischer Experimente und Anwendungen spielen. Die Wahl der Elektrodenmaterialien und Elektrolyte muss sorgfältig auf der Grundlage verschiedener Faktoren abgewogen werden, darunter Reaktivität, Inertheit, Korrosionsbeständigkeit und Kompatibilität mit der spezifischen Anwendung. Für Forscher und Praktiker auf dem Gebiet der Elektrochemie ist es wichtig, die verschiedenen Arten von Elektroden und Elektrolyten sowie die Überlegungen zur Materialauswahl zu verstehen. Durch die Auswahl geeigneter elektrochemischer Verbrauchsmaterialien können Wissenschaftler genaue und zuverlässige Ergebnisse erzielen, was zu Fortschritten in Forschung und technologischen Entwicklungen führt.
Ähnliche Produkte
- Elektrodenpolier-Material für elektrochemische Experimente
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Metall-Scheibenelektrode Elektrochemische Elektrode
- Kupfersulfat-Referenzelektrode für Laboranwendungen
- Gold-Elektrodenblech Gold-Elektrode
Ähnliche Artikel
- Elektrodenmaterialien für rotierende Ring-Scheiben-Elektroden
- So wählen Sie die richtige elektrochemische Elektrode aus
- Elektrochemische Elektroden in der chemischen Analyse
- Elektrolyte und elektrochemische Elektroden
- Umfassender Leitfaden zur rotierenden Scheibenelektrode (RDE) in elektrochemischen Studien


















