Definition und Grundfunktionen der Elektrolysezelle
Inhaltsverzeichnis
Verständnis der Rolle von elektrischer und chemischer Energie in einer Elektrolysezelle
Elektrochemische Zelle Eine elektrochemische Zelle ist ein Gerät, das entweder elektrische Energie aus chemischen Reaktionen erzeugen oder chemische Reaktionen durch die Einführung elektrischer Energie erleichtern kann.
Definieren Sie Elektrochemie. Unter Elektrochemie versteht man die Untersuchung chemischer Prozesse, die zur Bewegung von Elektronen führen. Es befasst sich mit der Wechselwirkung zwischen elektrischer Energie und chemischer Veränderung.
Beispiel: Die Untersuchung elektrochemischer Zellen erfolgt in der Elektrochemie. Es handelt sich um Zellen, die chemische Energie in elektrische Energie umwandeln.
Bedeutung der Elektrochemie Die Elektrochemie befasst sich mit den Beziehungen zwischen elektrischen und chemischen Phänomenen. Elektrochemische Verfahren werden in verschiedenen Industriezweigen eingesetzt. Es ist der wichtigste Prozess zur Herstellung mehrerer Chemikalien. Die Herstellung verschiedener Metalle basiert auf elektrochemischen Verfahren. Wasserstoff wird durch Elektrolyse von Wasser hergestellt. Auch bei der Entwicklung des Elektroautos spielt es eine große Rolle.
Beschreibung der Komponenten einer Elektrolysezelle, einschließlich Elektroden und Elektrolyt
Elektrolysezellen bestehen aus drei wesentlichen Komponenten.

Die Anode ist die negative oder reduzierende Elektrode, die Elektronen an den externen Stromkreis abgibt und während einer elektrochemischen Reaktion oxidiert.
Die Kathode ist die positive oder oxidierende Elektrode, die Elektronen aus dem externen Stromkreis aufnimmt und während der elektrochemischen Reaktion reduziert wird.
Der Elektrolyt ist das Medium, das den Ionentransportmechanismus zwischen der Kathode und der Anode einer Zelle bereitstellt. Unter Elektrolyten versteht man oft Flüssigkeiten wie Wasser oder andere Lösungsmittel mit gelösten Salzen, Säuren oder Laugen, die für die Ionenleitung erforderlich sind. Es ist jedoch zu beachten, dass viele Batterien, einschließlich der herkömmlichen Batterien (AA/AAA/D), Festelektrolyte enthalten, die bei Raumtemperatur als Ionenleiter wirken.
Überlegungen zur Auswahl von Kathode, Anode und Elektrolyt
Die gewünschten Eigenschaften für Anoden-, Kathoden- und Elektrolytmaterialien sind unten aufgeführt.
Erklärung des Prozesses der Ladungsübertragung zwischen Elektroden und Ionen
Elektrolysezelle, jedes Gerät, in dem elektrische Energie in chemische Energie umgewandelt wird oder umgekehrt. Eine solche Zelle besteht typischerweise aus zwei metallischen oder elektronischen Leitern (Elektroden), die voneinander entfernt gehalten werden und mit einem Elektrolyten (siehe auch) in Kontakt stehen, normalerweise einer gelösten oder geschmolzenen ionischen Verbindung. Durch den Anschluss der Elektroden an eine Gleichstromquelle wird eine von ihnen negativ und die andere positiv geladen. Positive Ionen im Elektrolyten wandern zur negativen Elektrode (Kathode) und verbinden sich dort mit einem oder mehreren Elektronen, wobei sie ihre Ladung teilweise oder vollständig verlieren und zu neuen Ionen mit geringerer Ladung oder neutralen Atomen oder Molekülen werden; Gleichzeitig wandern negative Ionen zur positiven Elektrode (Anode) und übertragen ein oder mehrere Elektronen auf diese, wodurch sie ebenfalls zu neuen Ionen oder Neutralteilchen werden. Der Gesamteffekt der beiden Prozesse ist die Übertragung von Elektronen von den negativen Ionen auf die positiven Ionen, eine chemische Reaktion (siehe Oxidations-Reduktions-Reaktion). Ein Beispiel ist die Elektrolyse von Natriumchlorid (Kochsalz), bei der Natriummetall und Chlorgas entstehen; Die für den Ablauf der Reaktion erforderliche Energie wird durch den elektrischen Strom bereitgestellt. Weitere häufige Anwendungen der Elektrolyse sind die Elektroabscheidung zum Raffinieren oder Plattieren von Metallen und die Herstellung von Natronlauge.
Was ist eine Elektrolysezelle? Eine Elektrolysezelle kann als ein elektrochemisches Gerät definiert werden, das elektrische Energie nutzt, um eine nicht spontane Redoxreaktion zu ermöglichen. Elektrolysezellen sind elektrochemische Zellen, die zur Elektrolyse bestimmter Verbindungen verwendet werden können. Beispielsweise kann Wasser einer Elektrolyse (mit Hilfe einer Elektrolysezelle) unterzogen werden, um gasförmigen Sauerstoff und gasförmigen Wasserstoff zu bilden. Dies geschieht durch Nutzung des Elektronenflusses (in die Reaktionsumgebung), um die Aktivierungsenergiebarriere der nicht spontanen Redoxreaktion zu überwinden.


Die drei Hauptkomponenten von Elektrolysezellen sind: Kathode (die bei Elektrolysezellen negativ geladen ist) Anode (die bei Elektrolysezellen positiv geladen ist) Elektrolyt Der Elektrolyt stellt das Medium für den Elektronenaustausch zwischen der Kathode und der Anode dar. Zu den in Elektrolysezellen häufig verwendeten Elektrolyten gehören Wasser (das gelöste Ionen enthält) und geschmolzenes Natriumchlorid.
ELEKTROLYTISCHE ZELLEN Um Elektrolysezellen zu definieren, müssen wir zunächst die Elektrolyse verstehen. Elektrolyse ist eine Methode, bei der ein elektrischer Strom durch eine ionenhaltige Flüssigkeit geleitet wird, wodurch die darin enthaltenen Verbindungen zerfallen. Dies wird verwendet, um das Metall von metallischen Elementen zu isolieren, andere chemische Substanzen (wie Wasser) und Metalle zu galvanisieren und Batterien aufzuladen. Für die Aufrechterhaltung eines elektrolytischen Prozesses ist ein vollständiger Kreislauf unerlässlich; Wir müssen in der Lage sein, kontinuierlich Strom aus der Zelle zu beziehen.
Kathode und Anode einer Elektrolysezelle sind an eine Stromquelle angeschlossen. Diese beiden stabilen Elektroden und eine flüssige Elektrolytlösung sind in jeder Elektrolysezelle vorhanden. Die Elektrolytlösung leitet Strom, da sich gelöste Ionen in der Lösung frei bewegen können.
Elektrolysezelle und ihre Komponenten Die Elektrolysezelle besteht aus drei Hauptkomponenten – Batterie, Elektroden und Elektrolyt. Batterie Die Batterie fungiert als Stromquelle. Es liefert die elektrische Energie, um die chemische Veränderung, also die Zersetzung der ionischen Verbindung, herbeizuführen. Elektroden Elektroden sind elektrische Kontakte, die den Stromkreis zwischen den Drähten und dem Elektrolyten schließen oder vervollständigen. Beispiele für Elektroden sind Kohlenstoffstäbe (Graphit) und Metallplatten. Die Elektrode auf der linken Seite (siehe Abbildung oben), die mit dem Pluspol der Batterie verbunden ist, ist die positive Elektrode oder Anode. Die rechte Elektrode, die mit dem Minuspol der Batterie verbunden ist, ist die negative Elektrode oder Kathode. Elektrolyt Der Elektrolyt ist eine Substanz, die im geschmolzenen Zustand oder in wässriger Lösung bewegliche Ionen enthält, um Elektrizität zu leiten. Beispiele für Elektrolyte sind geschmolzenes Natriumchlorid, Kupfer(II)-sulfat-Lösung und Säuren wie verdünnte Salzsäure. Beispiele für Nichtelektrolyte sind Zuckerlösungen, Ethanol und (geschmolzener) Schwefel, da es sich dabei um Flüssigkeiten oder Lösungen handelt, die keine beweglichen Ionen zum Leiten von Elektrizität enthalten.

Anwendungen Elektrolysezellen werden häufig zur Zersetzung chemischer Verbindungen in einem Prozess namens Elektrolyse eingesetzt – wobei „Elektro“ Elektrizität bedeutet und das griechische Wort „Lyse“ „Aufbrechen“ bedeutet. Wichtige Beispiele für die Elektrolyse sind die Zersetzung von Wasser in Wasserstoff und Sauerstoff sowie von Bauxit in Aluminium und andere Chemikalien. Das Galvanisieren (z. B. von Kupfer, Silber, Nickel oder Chrom) erfolgt mithilfe einer Elektrolysezelle. Elektrolyse ist eine Technik, bei der elektrischer Gleichstrom (DC) verwendet wird.
Kommerziell werden Elektrolysezellen bei der Elektroraffinierung und Elektrogewinnung mehrerer Nichteisenmetalle eingesetzt. Das meiste hochreine Aluminium, Kupfer, Zink und Blei werden industriell in Elektrolysezellen hergestellt.
Eine Elektrolysezelle Die drei Komponenten einer Elektrolysezelle sind ein Elektrolyt und zwei Elektroden.
Elektrolyte Elektrolyte sind Substanzen, die beim Auflösen in polaren Lösungsmitteln wie Wasser eine elektrisch leitende Lösung ergeben. Dies liegt daran, dass der Elektrolyt beim Auflösen in den polaren Lösungsmitteln in Kationen und Anionen zerfällt und sich gleichmäßig in der Lösung verteilt. Diese Kationen und Anionen, die in der Lösung unter einem elektrischen Potential stehen, bewegen sich mit einem Überschuss an Elektronen bzw. einem Mangel an Elektronen zur Elektrode. Diese Bewegung von Kationen und Anionen in entgegengesetzter Richtung erzeugt Strom und bildet die Elektrolysezellen.
Während Salze, Säuren und Basen einen Elektrolyten bilden, können sich einige Gase unter bestimmten Bedingungen auch wie ein Elektrolyt verhalten, beispielsweise Chlorwasserstoff bei hoher Temperatur und niedrigem Druck.
Chemische Reaktionen in der Elektrolysezelle
Erklärung der Oxidations-Reduktions-Reaktion in einer Elektrolysezelle
In elektrochemischen Zellen finden Oxidations-Reduktions-Reaktionen (Redox-Reaktionen) statt. Es gibt zwei Arten von elektrochemischen Zellen: galvanische (voltaische) Zellen, in denen spontane Reaktionen stattfinden, und elektrolytische Zellen, in denen nicht spontane Reaktionen stattfinden.
Beide Zelltypen verfügen über Elektroden, an denen Oxidations- und Reduktionsreaktionen stattfinden. Die Oxidation findet an der Elektrode statt, die Anode genannt wird, und die Reduktion findet an der Elektrode statt, die Kathode genannt wird.
In einer Elektrolysezelle ist die Anode positiv und die Kathode negativ. Dies liegt daran, dass die Anode Anionen aus der Lösung anzieht. In einer galvanischen Zelle hingegen ist die Anode negativ geladen, da die spontane Oxidation an der Anode die Quelle der Elektronen oder negativen Ladung der Zelle ist. Die Kathode einer galvanischen Zelle ist ihr Pluspol.
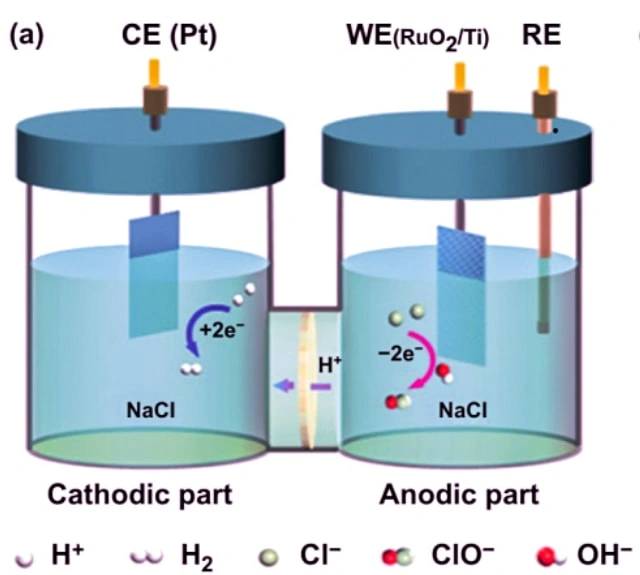
Beispiel der Elektrolyse von Natriumchlorid
Ein Beispiel für eine Elektrolysezelle ist die Elektrolyse von Natriumchlorid. Wenn Natriumchlorid in Wasser gelöst und einer Elektrolyse unterzogen wird, treten folgende Reaktionen auf:
An der Kathode: 2 H2O + 2 e- -> 2 OH- + H2
An der Anode: 2 Cl- -> Cl2 + 2 e-
Gesamtreaktion: 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
In dieser Elektrolysezelle werden zwei inerte Elektroden in geschmolzenes Natriumchlorid eingetaucht. Wenn ein elektrischer Strom durch den Stromkreis fließt, reichert sich die Kathode mit Elektronen an und entwickelt eine negative Ladung. Die positiv geladenen Natriumionen werden von der Kathode angezogen, was zur Bildung von Natriummetall führt. Gleichzeitig werden Chloratome von der positiv geladenen Anode angezogen, was zur Bildung von Chlorgas führt. Das Gesamtergebnis ist die Produktion von Natriummetall, Chlorgas und wässrigem Natriumhydroxid.
Anwendungen von Elektrolysezellen
Elektrolysezellen haben verschiedene Anwendungen:
- Herstellung von Sauerstoffgas und Wasserstoffgas aus Wasser.
- Gewinnung von Aluminium aus Bauxit.
- Beim Galvanisieren wird eine dünne Schutzschicht aus einem bestimmten Metall auf der Oberfläche eines anderen Metalls gebildet.
- Elektroraffinierung von Nichteisenmetallen.
- Elektrolytische Rückgewinnungsprozesse.
- Die industrielle Produktion von hochreinem Kupfer, hochreinem Zink und hochreinem Aluminium erfolgt fast immer über Elektrolysezellen.
![Anwendung von Elektrolysezellen (hochreines Zink, hochreines Aluminium, hochreines Kupfer)]()
Anwendung von Elektrolysezellen (hochreines Zink, hochreines Aluminium, hochreines Kupfer)
Elektrolysezellen spielen in verschiedenen Branchen und Prozessen eine entscheidende Rolle und ermöglichen die Produktion wichtiger Chemikalien und Materialien.
Anwendungen der Elektrolyse
Verwendung der Elektrolyse bei der galvanischen Abscheidung zum Raffinieren oder Plattieren von Metallen
Die Elektrolyse wird häufig im Elektroabscheidungsverfahren zur Veredelung oder Beschichtung von Metallen eingesetzt. Eine praktische Anwendung der Elektrolyse ist in diesem Zusammenhang die Elektroreinigung. Bei der Elektroreinigung wird der zu reinigende Gegenstand, beispielsweise Zink oder Aluminium, zur Kathode gemacht und ein starker Strom durch eine Elektrolytlösung geleitet. An der Kathode entstehen Natronlauge und Wasserstoff, die effektiv Fett und Verunreinigungen von der Oberfläche des Artikels entfernen. Dieses Verfahren kann zum Veredeln oder Plattieren von Metallen eingesetzt werden, sorgt für ein sauberes und glänzendes Aussehen, schützt vor Korrosion und ersetzt abgenutzte Materialien.
Herstellung von Natronlauge durch Elektrolyse
Eine weitere wichtige Anwendung der Elektrolyse ist die großtechnische Herstellung von Chemikalien, darunter Natronlauge (NaOH) und Chlorgas. Bei diesem Verfahren wird Natriumchlorid (NaCl) mittels Elektrolyse in seine Bestandteile Natrium (Na) und Chlor (Cl2) zerlegt. Bei der Reaktion an der Kathode werden Natriumionen (Na+) zu metallischem Natrium (Na) reduziert, während an der Anode Chloridionen (Cl-) zu Chlorgas (Cl2) oxidiert werden. Die gesamte Zellreaktion ist 2NaCl → 2Na + Cl2. Durch diesen elektrolytischen Prozess können große Mengen Natronlauge und Chlorgas für verschiedene industrielle Anwendungen hergestellt werden.
Elektrolyse bei der Gewinnung von Metallen
Bei der Gewinnung von Metallen aus ihren Erzen spielt die Elektrolyse eine entscheidende Rolle. Es gibt zwei Hauptmethoden zur Metallgewinnung mittels Elektrolyse. Bei der ersten Methode wird das Erz mit einer starken Säure behandelt, um ein Salz zu erhalten, und die resultierende Salzlösung wird elektrolysiert, um das Metall freizusetzen. Bei der zweiten Methode befindet sich das Erz in geschmolzenem Zustand und wird direkt in einem Ofen elektrolysiert.
Ein Beispiel für die Metallgewinnung mittels Elektrolyse ist die Gewinnung von Zink. Das Zinkerz wird mit Schwefelsäure behandelt, um eine Zinksulfatlösung zu bilden, die dann elektrolysiert wird. Im Elektrolyttank werden Aluminiumkathoden und Bleianoden verwendet. An den Kathoden wird Zink abgeschieden, während an den Anoden die Schwefelsäure regeneriert wird. Dieser elektrolytische Prozess ermöglicht die Gewinnung von hochreinem Zink.
Ebenso wird die Elektrolyse auch bei der Gewinnung von Aluminium aus Bauxit eingesetzt. Bauxit, ein Aluminiumerz, wird in geschmolzenem Kryolith gelöst und einer Elektrolyse unterzogen. Die Aluminiumionen werden an der Kathode reduziert und bilden metallisches Aluminium, während an der Anode Sauerstoffgas entsteht. Dieses Verfahren ermöglicht die Herstellung von hochreinem Aluminium.

Insgesamt findet die Elektrolyse praktische Anwendungen in verschiedenen Branchen zur Gewinnung, Raffinierung und Galvanisierung von Metallen sowie zur Herstellung von Chemikalien wie Natronlauge. Durch die Nutzung der Kraft der Elektrolyse können Unternehmen qualitativ hochwertige Ergebnisse erzielen und den Anforderungen ihrer jeweiligen Branchen gerecht werden.
Umwandlung chemischer Energie in Elektrizität
Erklärung der Energieerzeugung bei Reaktionen mit energieerzeugenden Stoffen
In elektrochemischen Zellen wird chemische Energie durch einen Prozess namens Elektrolyse in elektrische Energie umgewandelt. Elektrolyse ist eine Redoxreaktion, die in einer elektrochemischen Zelle stattfindet, wobei chemische Substanzen an den Elektroden zersetzt werden. Die Produkte der Elektrolyse hängen von der Art der in der Zelle verwendeten Elektrode und dem Elektrolyten ab. Dieser Prozess ist die Grundlage für verschiedene Anwendungen in der Elektrochemie.
Das Gebiet der Elektrochemie umfasst die Erzeugung von Elektrizität aus der Energie, die bei spontanen chemischen Reaktionen freigesetzt wird, sowie die Nutzung elektrischer Energie, um nicht spontane chemische Veränderungen voranzutreiben. Im Zentrum dieser Prozesse stehen Redoxreaktionen, bei denen es um die Übertragung von Elektronen zwischen Spezies geht. Viele chemische und biologische Reaktionen sind Redoxreaktionen und spielen eine entscheidende Rolle bei der Energiegewinnung für Haushalts-, Transport- oder Industriezwecke.
Die bei diesen Reaktionen erzeugte Energie wird in einer Vielzahl von Anwendungen genutzt, darunter die Verbrennung von Brennstoff für die Verdauung von Nahrungsmitteln bei Tieren, industrielle Prozesse, die Photosynthese, die Gewinnung von Metallen aus Erzen, die Herstellung wichtiger Chemikalien sowie der Betrieb von Batterien und Brennstoffzellen.
Beispiel eines Blei-Säure-Akkumulators
Ein Beispiel für die Umwandlung chemischer Energie in Elektrizität ist der Blei-Säure-Akku. Dieser Batterietyp wird häufig als Energiequelle in Fahrzeugen verwendet. Es besteht aus mehreren miteinander verbundenen elektrochemischen Zellen.

Die Blei-Säure-Batterie fungiert sowohl als Elektrolysezelle als auch als galvanische Zelle. Beim Entladen fungiert es als galvanische Zelle und wandelt chemische Energie in elektrische Energie um. Beim Entladungsprozess reagieren Bleidioxid, Bleimetall und Schwefelsäure zu Bleisulfat und Wasser. An einer Elektrode erfolgt die Oxidation von Blei zu Bleisulfat, an der anderen Elektrode die Reduktion von Bleidioxid zu Bleisulfat. Durch die Wanderung von Wasserstoffionen wird elektrische Ladung durch den Elektrolyten transportiert.
Diese Trennung von Oxidations- und Reduktionsprozessen erzeugt eine treibende Kraft oder Spannung, die den Stromfluss durch einen externen Stromkreis bewirkt, der die beiden Elektroden verbindet. In Zellen und Batterien wurden viele andere chemische Kombinationen verwendet, von denen jede ihre eigenen spezifischen Reaktionen und Eigenschaften aufweist.
Brennstoffzellen
Brennstoffzellen sind eine weitere Art elektrochemischer Zellen, die die chemische Energie von Brennstoffen in Elektrizität umwandeln. Diese Zellen funktionieren durch eine elektrochemische Reaktion zwischen Wasserstoffbrennstoff und einem Oxidationsmittel, typischerweise Sauerstoff. Im Gegensatz zu Batterien, die Energie aus bereits darin enthaltenen Chemikalien erzeugen, benötigen Brennstoffzellen einen kontinuierlichen Sauerstofffluss und eine Brennstoffzufuhr, um Strom zu erzeugen.
Brennstoffzellen wurden von der NASA kommerziell genutzt, um Strom für Raumkapseln und Satelliten zu erzeugen. Sie bieten Vorteile hinsichtlich der thermodynamischen Effizienz, da sie Carnot-Zyklusverluste vermeiden. Allerdings steht die aktuelle Brennstoffzellentechnologie immer noch vor Herausforderungen hinsichtlich der Gesamteffizienz und Zuverlässigkeit. Eine Einschränkung besteht darin, dass Kohlenwasserstoffe nicht direkt verwendet werden können und daher ein Verarbeitungsschritt erforderlich ist, um herkömmliche Kraftstoffe in Wasserstoff umzuwandeln. Darüber hinaus ist die Katalyse der Sauerstoffreduktion ein komplexer Prozess.

Zusammenfassend ist die Umwandlung chemischer Energie in Elektrizität ein grundlegender Prozess in der Elektrochemie. Sie entsteht durch Redoxreaktionen in elektrochemischen Zellen wie Blei-Säure-Akkumulatoren und Brennstoffzellen. Diese Technologien finden vielfältige Anwendungsmöglichkeiten, vom Antrieb von Fahrzeugen bis hin zur Stromerzeugung für die Weltraumforschung.
Alternative Zellen zur Stromerzeugung
Solarzellen und die Rolle von Halbleitern und Lichtabsorption verstehen
- Amorphes Silizium (A-Si) ist ein vorherrschendes Dünnschicht-PV-Material, dessen Lichtabsorptionsvermögen etwa 40-mal höher ist als das von kristallinem Silizium.
- Cadmiumtellurid (CdTe) ist ein weiteres Dünnschichtmaterial mit hoher Lichtabsorptionsfähigkeit. Mit einer nur 1 mm dünnen Folie kann es 90 % des Sonnenspektrums absorbieren.
- Kupfer-Indium-Diselenid (CIGS) ist ein Halbleitermaterial, das in PVs einen hohen Wirkungsgrad erreicht hat, wobei kommerzielle Module Wirkungsgrade von 14 % oder mehr erreichen.

Erläuterung von Brennstoffzellen und deren Einsatz von Oxidationsmitteln und Reduktionsmitteln
- Brennstoffzellen sind elektrochemische Zellen, die Wasserstoff mit Sauerstoff oder einem anderen Oxidationsmittel reagieren lassen, um chemische Energie in Elektrizität umzuwandeln.
- Sie unterscheiden sich von Batterien dadurch, dass sie eine kontinuierliche Brennstoff- und Sauerstoffquelle benötigen, um die chemische Reaktion aufrechtzuerhalten.
- Brennstoffzellen können kontinuierlich Strom erzeugen, solange Brennstoff und Sauerstoff zugeführt werden.
- Sie werden für die Primär- und Notstromversorgung in verschiedenen Anwendungen eingesetzt, darunter Gewerbe- und Industriegebäude, Wohngebäude und abgelegene Gebiete.
- Brennstoffzellen werden auch zum Antrieb von Brennstoffzellenfahrzeugen wie Gabelstaplern, Autos, Bussen, Booten, Motorrädern und U-Booten eingesetzt.
- Der weltweite Brennstoffzellenmarkt soll bis 2030 um 19,9 % wachsen.
Andere Zellen zur Stromerzeugung
- Solarzellen erzeugen Strom durch die Absorption von Licht durch Halbleiter.
- Brennstoffzellen nutzen chemische Energie aus Brennstoff, um Strom zu erzeugen.
- Wiederaufladbare Zellen können durch Aufladen mehrfach verwendet werden.
- Nicht wiederaufladbare Zellen können nicht wiederverwendet werden und müssen entsorgt werden.
- Blei-Säure-/Blei-Akkus sind Sekundärzellen, die als Energiequelle in Fahrzeugen eingesetzt werden.
- Dünnschichtzellen wie Dünnschichtsolarzellen, Dünnschichttransistoren und Dünnschichtbatterien bieten im Vergleich zu herkömmlichen Zellen eine verbesserte Effizienz, schnelleres Laden und eine längere Lebensdauer.
Das Gebiet der alternativen Zellen zur Stromerzeugung entwickelt sich ständig weiter. Forscher verbessern weiterhin die Effizienz und Eigenschaften von Dünnschichtmaterialien, während Branchenexperten daran arbeiten, Kosten zu senken und die Produktion zu steigern.
Wenn Sie an diesem Produkt interessiert sind, können Sie unsere Unternehmenswebsite durchsuchen: https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple . Wir legen immer Wert auf den Grundsatz der Qualität. Während des Produktionsprozesses kontrollieren wir streng jeden Schritt des Prozesses und verwenden hochwertige Materialien und fortschrittliche Produktionstechnologie, um die Stabilität und Haltbarkeit unserer Produkte zu gewährleisten. um sicherzustellen, dass ihre Leistung den höchsten Standards entspricht. Wir glauben, dass wir nur durch die Bereitstellung hervorragender Qualität bei unseren Kunden ihr Vertrauen und eine langfristige Zusammenarbeit gewinnen können.
Ähnliche Produkte
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Dünnschicht-Spektroelektrochemische Zelle
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
- Platinblechelektrode für Labor- und Industrieanwendungen
Ähnliche Artikel
- Elektroden und elektrochemische Zellen verstehen
- Anwendungen von Elektrolysezellen in der Reinigung und Galvanisierung
- Der stille Dialog: Beherrschen Sie die Kontrolle in Elektrolysezellen
- Die Kunst des Widerstands: Warum Ihre Elektrolysezelle Platz zum Atmen braucht
- Quarz-Elektrolyt-Zellen verstehen: Anwendungen, Mechanismen und Vorteile

















