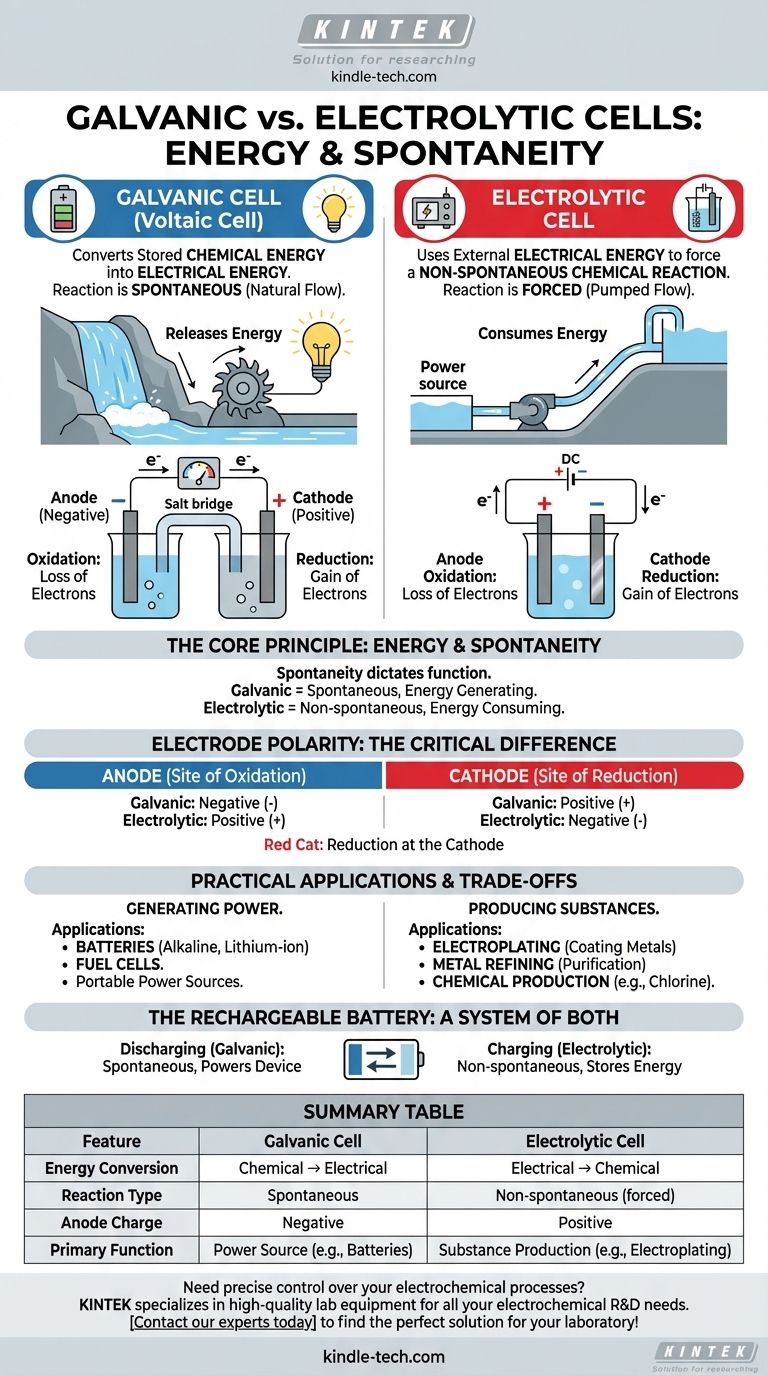
Im Kern liegt der Unterschied zwischen einer galvanischen Zelle und einer Elektrolysezelle in der Richtung der Energieumwandlung. Eine galvanische (oder voltaische) Zelle wandelt gespeicherte chemische Energie durch eine spontane Reaktion in elektrische Energie um, ähnlich einer Batterie, die ein Gerät mit Strom versorgt. Im Gegensatz dazu verwendet eine Elektrolysezelle externe elektrische Energie, um eine nicht-spontane chemische Reaktion zu erzwingen, wie zum Beispiel bei der Metallbeschichtung.
Der grundlegende Unterschied liegt in der Spontaneität. Galvanische Zellen nutzen eine chemische Reaktion, die von selbst ablaufen möchte und dabei Energie als Elektrizität freisetzt. Elektrolysezellen nutzen Elektrizität, um eine chemische Reaktion zu erzwingen, die sonst nicht stattfinden würde.

Das Kernprinzip: Energie und Spontaneität
Das Verhalten jeder elektrochemischen Zelle wird davon bestimmt, ob ihre interne Redoxreaktion spontan oder nicht-spontan ist. Dieses einzige Prinzip bestimmt ihre Funktion und Struktur.
Galvanische Zellen: Energieerzeugung
In einer galvanischen Zelle ist die chemische Reaktion spontan. Das bedeutet, dass die Reaktanten eine höhere potenzielle Energie haben als die Produkte, und die Reaktion läuft natürlich ab und setzt Energie frei.
Diese freigesetzte Energie treibt Elektronen durch einen externen Stromkreis und erzeugt einen elektrischen Strom. Stellen Sie es sich wie einen Wasserfall vor: Das Wasser fließt natürlich bergab, und wir können eine Turbine in seinen Weg stellen, um Elektrizität zu erzeugen.
Elektrolysezellen: Energieverbrauch
In einer Elektrolysezelle ist die gewünschte chemische Reaktion nicht-spontan. Die Produkte befinden sich in einem höheren Energiezustand als die Reaktanten, daher findet die Reaktion nicht von selbst statt.
Um sie zu ermöglichen, müssen wir Energie von einer externen Stromquelle (wie einer Batterie oder einem Netzteil) zuführen. Diese externe Spannung zwingt Elektronen, sich entgegen ihrer natürlichen Richtung zu bewegen, und treibt die Reaktion an. Dies ist vergleichbar mit dem Einsatz einer Pumpe, um Wasser bergauf zu bewegen.
Wie dieses Prinzip die Zellkomponenten definiert
Während die grundlegenden Definitionen von Anode und Kathode gleich bleiben, ist ihre Ladung (Polarität) zwischen den beiden Zelltypen umgekehrt. Dies ist ein häufiger Verwirrungspunkt, aber eine direkte Folge der Spontaneität.
Die Anode: Immer der Ort der Oxidation
In beiden Zelltypen ist die Anode als die Elektrode definiert, an der Oxidation (der Elektronenverlust) stattfindet.
Die Kathode: Immer der Ort der Reduktion
Ebenso ist in beiden Zelltypen die Kathode die Elektrode, an der Reduktion (die Elektronenaufnahme) stattfindet. Eine einfache Eselsbrücke ist "Red Cat" (Reduktion an der Kathode).
Der entscheidende Unterschied: Elektrodenpolarität
In einer galvanischen Zelle setzt die spontane Oxidation an der Anode einen Elektronenfluss frei. Diese Ansammlung negativer Ladung macht die Anode negativ und die Kathode, die die Elektronen anzieht, positiv.
In einer Elektrolysezelle wird eine externe Stromquelle verwendet. Ihr positiver Pol ist mit der Anode verbunden, wo er Elektronen gewaltsam von den chemischen Spezies abzieht und so Oxidation verursacht. Daher ist die Anode positiv und die Kathode negativ.
Praktische Anwendungen und Kompromisse
Der Unterschied zwischen der Erzeugung und dem Verbrauch von Energie führt zu völlig unterschiedlichen realen Anwendungen für diese beiden Zelltypen.
Galvanische Zellen in der Praxis: Tragbare Energie
Galvanische Zellen sind als Stromquellen konzipiert. Ihre Hauptanwendung liegt in Batterien, von Einweg-Alkalibatterien bis hin zu wiederaufladbaren Lithium-Ionen-Zellen in Ihrem Telefon und Auto.
Brennstoffzellen sind eine weitere Art von galvanischen Zellen, die kontinuierlich Elektrizität erzeugen, solange Brennstoff (wie Wasserstoff) zugeführt wird.
Elektrolysezellen in der Praxis: Herstellung und Raffination
Elektrolysezellen sind industrielle Arbeitspferde, die zur Herstellung von Materialien verwendet werden. Zu den Hauptanwendungen gehören die Galvanisierung (Beschichtung eines Objekts mit einer dünnen Metallschicht) und die Reinigung von Metallen wie Kupfer und Aluminium.
Sie sind auch unerlässlich für die Herstellung wichtiger Industriechemikalien wie Chlorgas und Natriumhydroxid aus Salzwasser (Sole).
Die wiederaufladbare Batterie: Ein System aus beidem
Eine wiederaufladbare Batterie ist die perfekte Veranschaulichung beider Prinzipien. Wenn sie Ihr Gerät mit Strom versorgt, fungiert sie als galvanische Zelle, die eine spontane Reaktion ablaufen lässt. Wenn Sie sie zum Laden anschließen, kehrt eine externe Stromquelle den Prozess um und verwandelt sie in eine Elektrolysezelle, um eine nicht-spontane Reaktion anzutreiben und die ursprünglichen Reaktanten wiederherzustellen.
Die richtige Wahl für Ihr Ziel treffen
Ihr Verständnis, welche Zelle zu berücksichtigen ist, hängt vollständig davon ab, ob Sie Energie erzeugen oder eine Substanz herstellen müssen.
- Wenn Ihr Hauptaugenmerk auf der Erzeugung von Strom aus einer chemischen Reaktion liegt: Sie arbeiten mit einer galvanischen Zelle, bei der ein spontaner Prozess einen elektrischen Strom erzeugt.
- Wenn Ihr Hauptaugenmerk auf der Herstellung einer Substanz mittels Elektrizität liegt: Sie verwenden eine Elektrolysezelle, bei der eine externe Spannung eine nicht-spontane chemische Veränderung antreibt.
- Wenn Ihr Hauptaugenmerk auf der Speicherung und Wiederverwendung elektrischer Energie liegt: Sie haben es mit einem wiederaufladbaren System zu tun, das zwischen einer Elektrolysezelle (Laden) und einer galvanischen Zelle (Entladen) wechselt.
Letztendlich sind diese beiden Zelltypen zwei Seiten derselben elektrochemischen Medaille, definiert durch die Richtung des Energieflusses.
Zusammenfassungstabelle:
| Merkmal | Galvanische Zelle | Elektrolysezelle |
|---|---|---|
| Energieumwandlung | Chemisch → Elektrisch | Elektrisch → Chemisch |
| Reaktionstyp | Spontan | Nicht-spontan (erzwungen) |
| Anodenladung | Negativ | Positiv |
| Primäre Funktion | Stromquelle (z.B. Batterien) | Stoffproduktion (z.B. Galvanisierung) |
Benötigen Sie präzise Kontrolle über Ihre elektrochemischen Prozesse? Die richtige Laborausrüstung ist entscheidend für genaue Ergebnisse, egal ob Sie neue Batteriematerialien entwickeln oder Metallbeschichtungstechniken verfeinern. KINTEK ist spezialisiert auf hochwertige Laborausrüstung und Verbrauchsmaterialien für all Ihre elektrochemischen Forschungs- und Entwicklungsbedürfnisse. Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für Ihr Labor zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
Andere fragen auch
- Wie wird eine hochpräzise Elektrolysezelle zur Bewertung der Korrosionsbeständigkeit von Metallen eingesetzt? Validieren Sie DCT-Ergebnisse genau
- Wie funktioniert eine Flachplatten-Korrosionselektrolysezelle? Ein Leitfaden für kontrollierte Materialprüfungen
- Was sind die Vorteile einer flachen elektrochemischen Zelle für die Korrosion? Präzise Lochfraß- und Spaltanalyse erreichen
- Wie funktioniert eine Dreielektroden-Elektrolysezelle? Präzisionsprüfung von 8620er Stahl in korrosiven Umgebungen
- Wie wird eine Dreielektroden-elektrochemische Zelle zur Bewertung der Korrosionsbeständigkeit von Zr-Nb-Legierungen eingesetzt?







