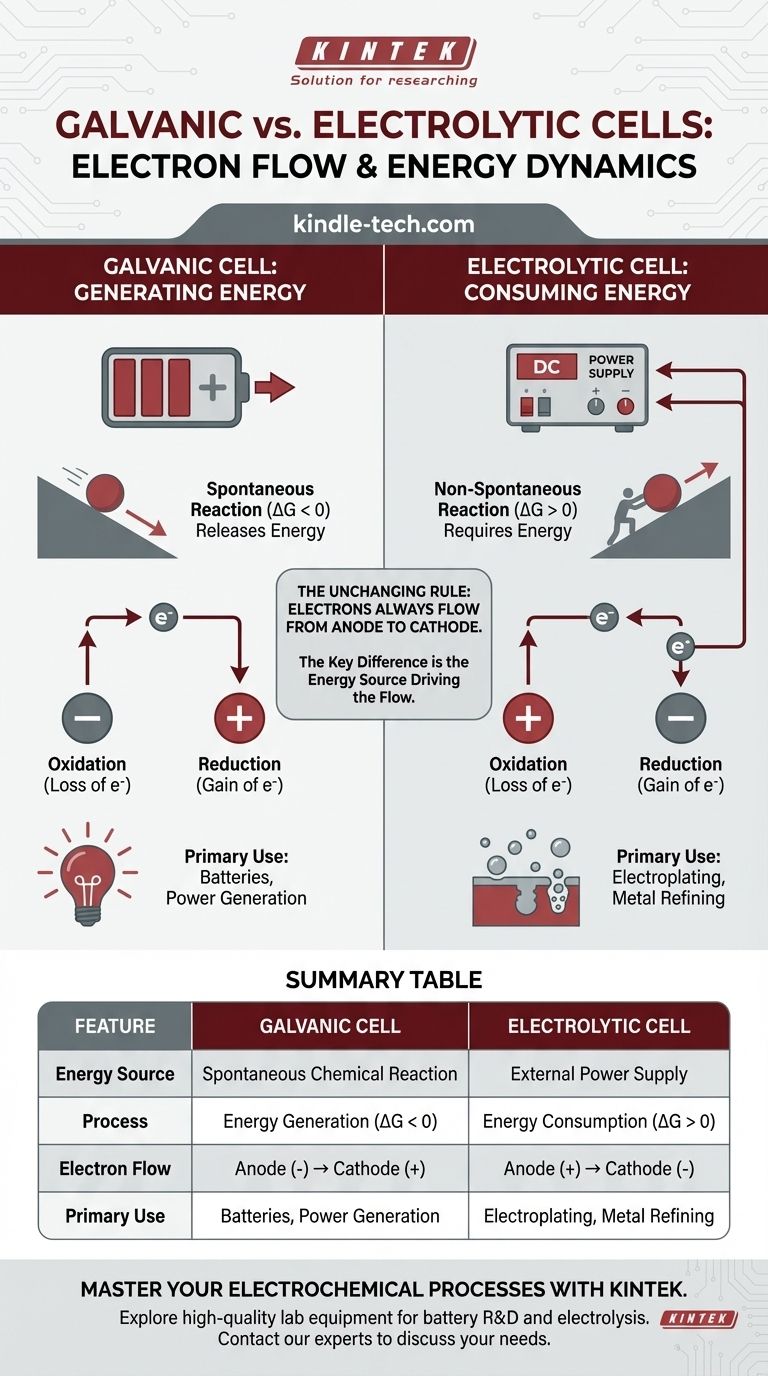
In jeder elektrochemischen Zelle erfolgt der Elektronenfluss im externen Schaltkreis immer von der Anode zur Kathode. Der entscheidende Unterschied liegt darin, warum sie fließen. In einer galvanischen Zelle erzeugt eine spontane chemische Reaktion Energie und treibt die Elektronen an. In einer elektrolytischen Zelle liefert eine externe Stromquelle die Energie, um den Elektronenfluss zu erzwingen und eine nicht-spontane Reaktion anzutreiben.
Der grundlegende Unterschied liegt nicht in der Richtung des Elektronenflusses in Bezug auf Oxidation und Reduktion, sondern in der Energiequelle, die den Prozess antreibt. Eine galvanische Zelle wandelt gespeicherte chemische Energie in elektrische Energie um, während eine elektrolytische Zelle externe elektrische Energie nutzt, um eine chemische Veränderung zu erzwingen.

Das Kernprinzip: Spontane vs. Nicht-spontane Reaktionen
Um den Elektronenfluss zu verstehen, müssen Sie zunächst die Energiedynamik der Zelle verstehen. Das gesamte System wird dadurch bestimmt, ob die chemische Reaktion von selbst abläuft oder erzwungen werden muss.
Galvanische Zellen: Energieerzeugung
Eine galvanische Zelle (auch Voltasche Zelle genannt) nutzt eine spontane chemische Reaktion. Stellen Sie es sich wie einen Ball vor, der einen Hügel hinunterrollt – der Prozess setzt auf natürliche Weise Energie frei.
Diese spontane Reaktion hat eine negative Gibbs-freie Energie (ΔG < 0). Diese Freisetzung chemischer Energie wird direkt in elektrische Energie umgewandelt, wodurch Elektronen von der Anode durch den externen Schaltkreis zur Kathode gedrückt werden.
Galvanische Zellen sind die Grundlage aller herkömmlichen Batterien.
Elektrolytische Zellen: Energieverbrauch
Eine elektrolytische Zelle wird verwendet, um eine nicht-spontane chemische Reaktion anzutreiben. Dies ist wie das Schieben eines Balls einen Hügel hinauf – es erfordert eine ständige Zufuhr externer Energie, damit es geschieht.
Diese Reaktion hat eine positive Gibbs-freie Energie (ΔG > 0). Eine externe Stromquelle, wie eine Batterie oder ein Netzteil, fungiert als „Elektronenpumpe“. Sie zwingt Elektronen auf die Kathode und zieht sie von der Anode weg, wodurch eine Reaktion angetrieben wird, die von selbst nicht ablaufen würde.
Zerlegung des Elektronenflusses und der Elektrodenpolarität
Die Verwirrung um den Elektronenfluss rührt oft von der wechselnden Polarität der Elektroden her. Während die Rollen von Anode und Kathode festgelegt sind, sind ihre Ladungen es nicht.
Die unveränderliche Regel: Anode zu Kathode
Per Definition ist der Ort der Oxidation (Elektronenverlust) immer die Anode, und der Ort der Reduktion (Elektronengewinn) ist immer die Kathode.
Da an der Anode Elektronen verloren gehen und an der Kathode Elektronen gewonnen werden, fließen Elektronen im externen Draht immer von der Anode zur Kathode. Dies ist eine universelle Konstante für beide Zelltypen.
Der entscheidende Unterschied: Die Ladung der Elektroden
Die Polarität (die positive oder negative Ladung) der Elektroden kehrt sich zwischen den beiden Zelltypen um, was die Quelle der meisten Verwirrung ist.
In einer galvanischen Zelle ist die Anode der Ort der spontanen Oxidation, die Elektronen freisetzt. Dieser Aufbau negativer Ladung macht die Anode zum negativen (-) Pol. Die Kathode, die Elektronen aufnimmt, wird zum positiven (+) Pol.
In einer elektrolytischen Zelle bestimmt die externe Stromquelle die Polarität. Sie verbindet ihren negativen Pol mit der Kathode der Zelle, um Elektronen aufzuzwingen und die Reduktion anzutreiben. Sie verbindet ihren positiven Pol mit der Anode der Zelle, um Elektronen abzuziehen und die Oxidation anzutreiben.
- Galvanische Zelle: Anode (-) → Kathode (+)
- Elektrolytische Zelle: Anode (+) → Kathode (-)
Verständnis der praktischen Anwendungen
Die grundlegende Differenz der Energieumwandlung bestimmt, wie diese Zellen eingesetzt werden. Die eine erzeugt Strom, die andere verbraucht ihn zur Herstellung wertvoller Materialien.
Galvanische Zellen: Strom bei Bedarf
Der Hauptvorteil einer galvanischen Zelle ist ihre Fähigkeit, als tragbare Quelle elektrischer Energie zu dienen.
Sie sind die Grundlage für Batterien, von einfachen AA-Zellen bis hin zu Autobatterien. Ihre Haupteinschränkung besteht darin, dass die chemischen Reaktanten schließlich verbraucht werden, wodurch die Spannung sinkt und die Batterie leer wird.
Elektrolytische Zellen: Erzwingen chemischer Veränderungen
Der Zweck einer elektrolytischen Zelle besteht darin, Elektrizität zur Erzeugung eines chemischen Produkts zu nutzen.
Dieser als Elektrolyse bekannte Prozess ist für industrielle Anwendungen unerlässlich, wie z. B. das Raffinieren von Metallen (z. B. die Herstellung von reinem Aluminium), das Galvanisieren von Oberflächen mit einer Schutzschicht oder das Spalten von Wasser in Wasserstoff und Sauerstoff. Ihr Nachteil ist der Bedarf an einer kontinuierlichen und oft kostspieligen Versorgung mit elektrischer Energie.
Wie Sie dies auf Ihr Ziel anwenden
Ihr Ansatz hängt vollständig davon ab, ob Sie Elektrizität erzeugen oder eine chemische Reaktion antreiben müssen.
- Wenn Ihr Hauptaugenmerk auf der Stromerzeugung oder der Herstellung einer Batterie liegt: Sie arbeiten mit einer galvanischen Zelle, bei der eine spontane Reaktion einen elektrischen Strom erzeugt.
- Wenn Ihr Hauptaugenmerk auf der Reinigung eines Metalls, der Galvanisierung einer Oberfläche oder der Spaltung einer Verbindung liegt: Sie benötigen eine elektrolytische Zelle, die externe Energie nutzt, um eine nicht-spontane Reaktion anzutreiben.
- Wenn Ihr Hauptaugenmerk auf dem Verständnis des Kernprinzips liegt: Denken Sie daran, dass die Oxidation immer an der Anode und die Reduktion an der Kathode stattfindet; der Schlüsselunterschied liegt darin, ob die Reaktion spontan (galvanisch) oder erzwungen (elektrolytisch) ist.
Das Verständnis dieses Unterschieds zwischen spontaner Energiefreisetzung und erzwungener Energiezufuhr ist der Schlüssel zur Beherrschung elektrochemischer Zellen.
Zusammenfassungstabelle:
| Merkmal | Galvanische Zelle | Elektrolytische Zelle |
|---|---|---|
| Energiequelle | Spontane chemische Reaktion | Externe Stromversorgung |
| Prozess | Energieerzeugung (ΔG < 0) | Energieverbrauch (ΔG > 0) |
| Elektronenfluss | Anode (-) → Kathode (+) | Anode (+) → Kathode (-) |
| Hauptanwendung | Batterien, Stromerzeugung | Galvanisieren, Metallraffination |
Beherrschen Sie Ihre elektrochemischen Prozesse mit KINTEK
Ob Sie neue Batterietechnologien entwickeln oder Materialien durch Elektrolyse raffinieren – die richtige Laborausrüstung ist entscheidend für genaue und zuverlässige Ergebnisse. KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien und liefert die präzisen Werkzeuge, die Sie für Ihre gesamte elektrochemische Forschung und Entwicklung benötigen.
Lassen Sie uns Ihnen helfen, Ihr Labor für den Erfolg auszustatten. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifischen Anforderungen zu besprechen und herauszufinden, wie KINTEK Ihre bahnbrechende Arbeit unterstützen kann.
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Wie ist die Gesamtstruktur der optischen H-Typ-Doppelschicht-Wasserbad-Elektrolysezelle aufgebaut? Präzisionsdesign für kontrollierte Experimente
- Wie sollte eine doppelschichtige Wasserbad-Elektrolysezelle betrieben werden? Eine Schritt-für-Schritt-Anleitung für zuverlässige Ergebnisse
- Was sind die Hauptmerkmale einer doppelwandigen elektrochemischen Zelle mit Wasserbad? Erzielen Sie eine präzise Temperaturkontrolle für Ihre Experimente
- Was ist eine H-Zelle? Ein Leitfaden für geteilte elektrochemische Zellen für präzise Experimente
- Was ist eine doppelwandige Wasserbad-Elektrolysezelle? Erzielen Sie präzise Temperaturkontrolle für Ihre Elektrolyse



















