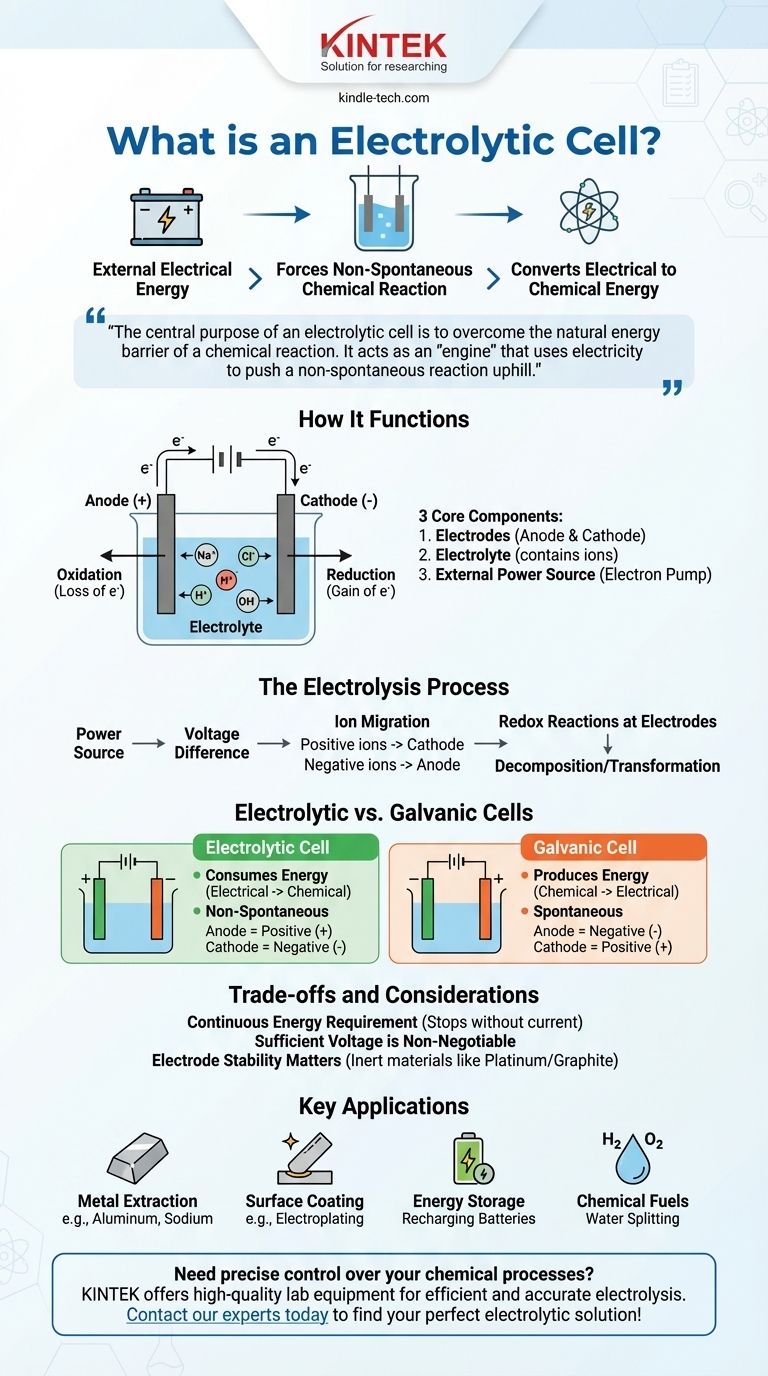
Im Wesentlichen ist eine Elektrolysezelle ein Gerät, das elektrische Energie aus einer externen Quelle, wie einer Batterie, nutzt, um eine chemische Reaktion zu erzwingen, die nicht von selbst ablaufen würde. Dieser Prozess, bekannt als Elektrolyse, wandelt elektrische Energie in gespeicherte chemische Energie um, indem er Verbindungen wie Wasser oder geschmolzene Salze zersetzt.
Der zentrale Zweck einer Elektrolysezelle ist es, die natürliche Energiebarriere einer chemischen Reaktion zu überwinden. Sie fungiert als „Motor“, der Elektrizität nutzt, um eine nicht-spontane Reaktion „bergauf“ zu treiben und Aufgaben wie die Trennung von Elementen oder das Laden einer Batterie zu erfüllen.

Wie eine Elektrolysezelle funktioniert
Um eine Elektrolysezelle zu verstehen, müssen wir ihre wesentlichen Teile und den von ihnen ermöglichten Prozess betrachten. Das gesamte System ist darauf ausgelegt, den Fluss von Elektronen und Ionen zu steuern, um eine spezifische chemische Veränderung herbeizuführen.
Die drei Kernkomponenten
Eine Elektrolysezelle besteht aus drei Hauptteilen.
-
Elektroden (Anode und Kathode): Dies sind zwei metallische oder elektronische Leiter, die als Orte für die chemische Reaktion dienen. Die Anode ist die positive Elektrode, an der Oxidation (Elektronenverlust) stattfindet, und die Kathode ist die negative Elektrode, an der Reduktion (Elektronengewinn) stattfindet.
-
Elektrolyt: Dies ist eine Substanz, typischerweise eine flüssige Lösung oder ein geschmolzenes Salz, die frei bewegliche Ionen enthält. Der Elektrolyt ermöglicht den Ladungsfluss zwischen den beiden Elektroden und schließt den Stromkreis.
-
Externe Stromquelle: Dies ist eine entscheidende Komponente, wie eine Batterie oder ein Gleichstromnetzteil. Sie fungiert als „Elektronenpumpe“, die Elektronen von der Anode abzieht und sie auf die Kathode drückt.
Der Prozess der Elektrolyse
Die Stromquelle erzeugt eine Spannungsdifferenz über die Elektroden.
Dies zwingt Ionen im Elektrolyten zur Migration. Positiv geladene Ionen bewegen sich zur negativen Kathode, und negativ geladene Ionen bewegen sich zur positiven Anode.
An den Elektroden finden Redoxreaktionen (Ladungsaustauschreaktionen) statt. An der Anode verlieren Substanzen Elektronen, und an der Kathode nehmen Substanzen Elektronen auf, was zur Zersetzung oder Umwandlung der Elektrolytkomponenten führt.
Der entscheidende Unterschied: Elektrolysezellen vs. Galvanische Zellen
Ein häufiger Verwirrungspunkt ist der Unterschied zwischen einer Elektrolysezelle und ihrem Gegenstück, der galvanischen (oder voltaischen) Zelle, die wir typischerweise als Standardbatterie bezeichnen.
Energieumwandlung
Eine Elektrolysezelle verbraucht Energie. Sie wandelt elektrische Energie in chemische Energie um.
Eine galvanische Zelle erzeugt Energie. Sie wandelt gespeicherte chemische Energie in elektrische Energie um.
Reaktionsspontaneität
Die Reaktion in einer Elektrolysezelle ist nicht-spontan. Sie erfordert eine externe Energiezufuhr, um abzulaufen.
Die Reaktion in einer galvanischen Zelle ist spontan. Sie läuft natürlich ab und setzt dabei Energie frei.
Elektrodenpolarität
In einer Elektrolysezelle ist die Anode positiv und die Kathode negativ. Dies liegt daran, dass die externe Stromquelle die Ladung bestimmt.
In einer galvanischen Zelle ist die Anode negativ und die Kathode positiv. Die spontane chemische Reaktion selbst bestimmt die Ladung.
Verständnis der Kompromisse und Überlegungen
Obwohl leistungsstark, arbeiten Elektrolysezellen unter spezifischen Einschränkungen, die wichtig zu erkennen sind.
Ein kontinuierlicher Energiebedarf
Das primäre Merkmal einer Elektrolysezelle ist ihre Abhängigkeit von einer externen Stromquelle. Der Elektrolyseprozess stoppt in dem Moment, in dem der elektrische Strom entfernt wird.
Ausreichende Spannung ist nicht verhandelbar
Die angelegte externe Spannung muss hoch genug sein, um den natürlichen Widerstand der nicht-spontanen Reaktion zu überwinden. Ist die Spannung zu niedrig, findet keine chemische Veränderung statt.
Elektrodenstabilität ist wichtig
Die Elektroden selbst müssen sorgfältig ausgewählt werden. In vielen Prozessen bestehen sie aus inerten Materialien wie Platin oder Graphit, die die Reaktion erleichtern, ohne verbraucht zu werden. In anderen Anwendungen wird das Elektrodenmaterial absichtlich so gewählt, dass es an der Reaktion teilnimmt, wie es bei einigen Arten der Reinigung der Fall ist.
Schlüsselanwendungen von Elektrolysezellen
Die Fähigkeit, chemische Reaktionen zu erzwingen, verleiht Elektrolysezellen eine zentrale Rolle in Industrie und Technologie.
- Wenn Ihr Hauptaugenmerk auf der Herstellung reiner Elemente liegt: Elektrolyse wird zur Gewinnung von Metallen wie Aluminium aus seinem Erz (Bauxit) oder zur Herstellung von Natrium und Chlorgas aus geschmolzenem Natriumchlorid verwendet.
- Wenn Ihr Hauptaugenmerk auf der Oberflächenbeschichtung liegt: Der Prozess der Galvanisierung verwendet eine Elektrolysezelle, um eine dünne Schicht eines Metalls (wie Chrom oder Gold) auf ein anderes aufzubringen, zum Schutz oder zur Dekoration.
- Wenn Ihr Hauptaugenmerk auf der Energiespeicherung liegt: Das Aufladen einer Batterie beinhaltet deren Betrieb als Elektrolysezelle. Das externe Ladegerät zwingt Ionen in ihren ursprünglichen Zustand zurück und speichert Energie für eine spätere Verwendung.
- Wenn Ihr Hauptaugenmerk auf der Erzeugung chemischer Brennstoffe liegt: Elektrolysezellen können Wasser (H₂O) in Wasserstoffgas und Sauerstoffgas spalten, wobei der Wasserstoff als saubere Energiequelle dient.
Durch die präzise Anwendung elektrischer Energie ermöglicht uns eine Elektrolysezelle die direkte Kontrolle über chemische Transformationen.
Zusammenfassungstabelle:
| Merkmal | Elektrolysezelle | Galvanische Zelle (Batterie) |
|---|---|---|
| Energieumwandlung | Wandelt elektrische Energie in chemische Energie um | Wandelt chemische Energie in elektrische Energie um |
| Reaktionstyp | Nicht-spontan (erfordert externe Energie) | Spontan (tritt natürlich auf) |
| Anodenladung | Positiv | Negativ |
| Primäre Funktion | Antreiben gewünschter chemischer Reaktionen (z. B. Galvanisierung) | Stromerzeugung |
Benötigen Sie präzise Kontrolle über Ihre chemischen Prozesse? Die hochwertigen Laborgeräte von KINTEK, einschließlich zuverlässiger Netzteile und langlebiger Elektroden, sind unerlässlich für eine effiziente und genaue Elektrolyse. Ob Ihre Anwendung Galvanisierung, Metallreinigung oder Energiespeicherforschung ist, unsere Verbrauchsmaterialien und Instrumente sind für überragende Leistung ausgelegt. Kontaktieren Sie noch heute unsere Experten, um die perfekte Elektrolyselösung für die Bedürfnisse Ihres Labors zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
Andere fragen auch
- Warum wird eine Quarz-Elektrolysezelle für Abwasser aus Acrylsäure verwendet? Gewährleistung chemischer Stabilität & Datenintegrität
- Was ist die wichtige Vorsichtsmaßnahme bezüglich der Elektrodenpolarität beim Aufbau einer Elektrolysezelle? Vermeiden Sie kostspielige Fehler und fehlgeschlagene Experimente
- Was ist der Unterschied im Elektronenfluss zwischen einer galvanischen Zelle und einer elektrolytischen Zelle? Beherrschen Sie die Energiequelle
- Funktion von 2-Kammer-Elektrolysezellen bei der Harzdekontamination: Schnellere & effizientere Reinigung
- Warum werden Diaphragma-Elektrolysezellen bei der Eisengewinnung durch Elektrolyse bevorzugt? Steigerung der Effizienz und Verhinderung der Wiederauflösung
- Welche Vorsichtsmaßnahmen sollten beim Einsatz der Dünnschicht-Spektroelektrochemie-Zelle in Bezug auf Spannung und Polarität getroffen werden?
- Wie sollte eine doppelschichtige Wasserbad-Elektrolysezelle betrieben werden? Eine Schritt-für-Schritt-Anleitung für zuverlässige Ergebnisse
- Wie trägt eine Labor-Schlauchpumpe zum kontinuierlichen Betrieb einer elektrochemischen Durchflusszelle bei?



















