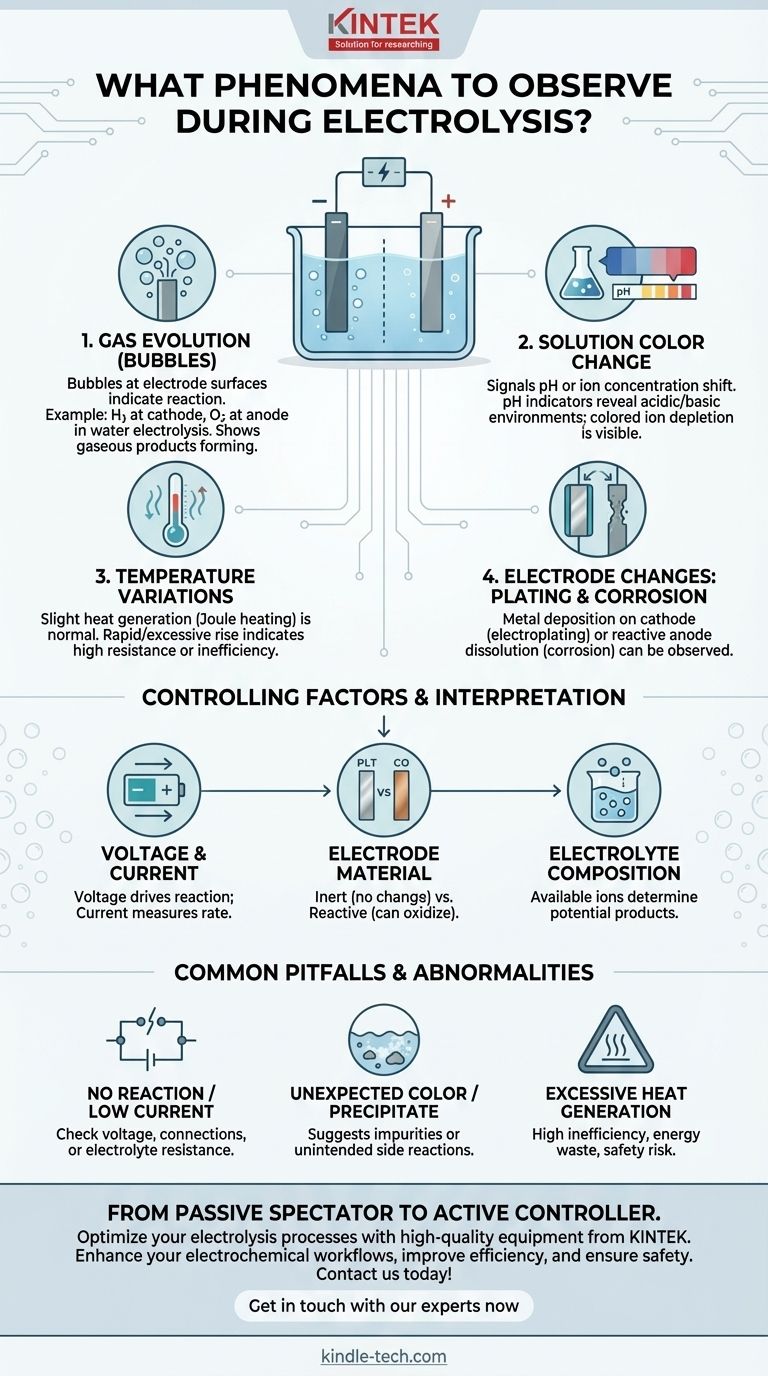
Bei der Durchführung einer Elektrolyse sind die wichtigsten zu beobachtenden Phänomene die Bildung von Gasblasen an den Elektrodenoberflächen, Farbveränderungen der Lösung und jegliche Temperaturveränderung. Diese visuellen und physischen Hinweise sind direkte Indikatoren für die zugrunde liegende elektrochemische Reaktion und liefern sofortiges Feedback darüber, ob der Prozess wie erwartet abläuft.
Die Beobachtung der Elektrolyse ist mehr als nur das Beobachten der Blasenbildung. Jedes Phänomen ist ein Datenpunkt, der die Identität, Effizienz und Sicherheit der Reaktion aufzeigt und es Ihnen ermöglicht, zu interpretieren, was auf molekularer Ebene geschieht.

Interpretation wichtiger Beobachtungen
Jedes beobachtbare Ereignis während der Elektrolyse liefert einen Hinweis auf die stattfindenden chemischen Umwandlungen. Das Verständnis dieser Hinweise ist entscheidend für die Kontrolle des Ergebnisses.
Gasentwicklung (Blasenbildung) an den Elektroden
Blasen sind das häufigste und unmittelbarste Anzeichen dafür, dass eine Reaktion stattfindet. Hierbei handelt es sich um gasförmige Produkte, die sich direkt auf den Elektrodenoberflächen bilden.
Beispielsweise sehen Sie bei der Elektrolyse von Wasser Wasserstoffgas an der negativen Elektrode (Kathode) und Sauerstoffgas an der positiven Elektrode (Anode) aufsteigen. Das spezifische entstehende Gas hängt vollständig von der Zusammensetzung des Elektrolyten ab.
Farbveränderungen der Lösung
Eine Farbveränderung des Elektrolyten kann verschiedene Ereignisse signalisieren. Sie deutet oft auf eine pH-Wert-Änderung oder eine Änderung der Konzentration spezifischer Ionen hin.
Wenn ein pH-Indikator (wie Lackmus oder Universalindikator) vorhanden ist, zeigen Farbveränderungen in der Nähe der Elektroden die Bildung saurer oder basischer Umgebungen an. Alternativ, wenn der Elektrolyt gefärbte Ionen enthält (wie blaue Kupfer(II)-Ionen), kann deren Verbrauch oder Bildung visuell verfolgt werden.
Temperaturschwankungen
Die Elektrolyse beinhaltet das Leiten eines elektrischen Stroms durch eine Lösung, was aufgrund des elektrischen Widerstands inhärent Wärme erzeugt (Joule-Erwärmung).
Ein leichter, allmählicher Temperaturanstieg ist normal. Ein schneller oder übermäßiger Temperaturanstieg kann jedoch auf einen hohen Innenwiderstand, einen ineffizienten Prozess oder eine unbeabsichtigte und stark exotherme Nebenreaktion hinweisen.
Elektrodenveränderungen: Abscheidung oder Korrosion
Die Elektroden selbst können sich verändern. Bei Prozessen wie der Galvanisierung werden Sie beobachten, wie sich eine Metallschicht auf der Kathode abscheidet und wächst.
Umgekehrt, wenn eine reaktive Anode (wie Kupfer oder Zink) verwendet wird, können Sie beobachten, wie sie sichtbar korrodiert oder sich als Ionen in der Lösung auflöst, da sie oxidiert wird. Inert-Elektroden wie Platin oder Kohlenstoff sollten keine Veränderung zeigen.
Verständnis der steuernden Faktoren
Die beobachteten Phänomene werden direkt durch die von Ihnen festgelegten Parameter gesteuert. Die Art der Elektrode und des Elektrolyten bestimmen, *was* passieren kann, während Spannung und Stromstärke bestimmen, *ob* es passiert und wie schnell.
Spannung und Stromstärke
Die Spannung ist die treibende Kraft der Reaktion; eine Mindestspannung (Zersetzungsspannung) muss angelegt werden, damit die Elektrolyse beginnt.
Die Stromstärke ist ein Maß für die Reaktionsgeschwindigkeit. Sie ist direkt proportional zu der Rate, mit der Elektronen übertragen werden, und somit zu der Rate, mit der Produkte gebildet werden.
Elektrodenmaterial (Inert vs. Reaktionsfähig)
Inert-Elektroden (z. B. Platin, Graphit) dienen lediglich als Oberfläche, auf der die Reaktion stattfindet, ohne sich chemisch zu beteiligen.
Reaktive Elektroden (z. B. Kupfer, Zink, Nickel) können an der Anode oxidiert werden und als Ionen in die Lösung gelangen. Dies ist ein fundamentales Prinzip bei der Raffination und Galvanisierung.
Zusammensetzung des Elektrolyten
Die im Elektrolyten vorhandenen Ionen bestimmen die potenziellen Produkte. In einer Lösung mit mehreren Ionentypen reagiert das am leichtesten zu reduzierende Ion an der Kathode und das am leichtesten zu oxidierende Ion an der Anode.
Häufige Fallstricke und anormale Situationen
Die Beobachtung des Prozesses ermöglicht es Ihnen zu erkennen, wann etwas nicht richtig funktioniert. Diese „anormalen Situationen“ sind wichtige diagnostische Werkzeuge.
Keine Reaktion oder sehr geringer Strom
Dies deutet typischerweise auf ein Problem mit dem Aufbau hin. Die Ursache kann eine unzureichende Spannung, eine schlechte elektrische Verbindung oder ein Elektrolyt mit sehr hohem Widerstand sein.
Unerwartete Farbe oder Niederschlag
Wenn Sie eine Farbe beobachten, die nicht durch die Hauptreaktion vorhergesagt wurde, oder einen Feststoff (Niederschlag) in der Lösung entstehen sehen, deutet dies stark auf das Vorhandensein von Verunreinigungen hin. Dies zeigt an, dass eine unbeabsichtigte Nebenreaktion stattfindet.
Übermäßige Wärmeentwicklung
Wie bereits erwähnt, deutet eine erhebliche Wärmeentwicklung auf eine hohe Ineffizienz hin. Das bedeutet, dass ein großer Teil der elektrischen Energie als Wärme verschwendet wird, anstatt für die gewünschte chemische Umwandlung genutzt zu werden. Dies kann auch ein Sicherheitsrisiko darstellen.
Die richtige Wahl für Ihr Ziel treffen
Ihre Interpretation dieser Beobachtungen hängt vom Ziel Ihres Experiments ab.
- Wenn Ihr Hauptaugenmerk auf der Demonstration eines grundlegenden Prinzips liegt (z. B. Wasserelektrolyse): Achten Sie auf die klassischen Anzeichen von Gasblasenbildung an beiden Elektroden und verwenden Sie einen pH-Indikator, um die Bildung von Base an der Kathode und Säure an der Anode zu sehen.
- Wenn Ihr Hauptaugenmerk auf der Galvanisierung liegt: Die wichtigste Beobachtung ist die gleichmäßige Abscheidung von Metall auf der Kathode, wobei Stromstärke und Zeit die wichtigsten Kontrollparameter sind.
- Wenn Ihr Hauptaugenmerk auf der quantitativen Analyse liegt (z. B. Überprüfung der Faraday'schen Gesetze): Sie müssen einen konstanten, stabilen Strom sicherstellen, da dieser die Menge des gebildeten Produkts direkt mit der Gesamtladung in Beziehung setzt, die durch die Zelle fließt.
Durch sorgfältige Beobachtung dieser Phänomene werden Sie vom passiven Zuschauer zum aktiven Kontrolleur des elektrochemischen Prozesses.
Zusammenfassungstabelle:
| Phänomen | Was es anzeigt | Wichtige Erkenntnis |
|---|---|---|
| Gasblasen | Reaktion findet statt; Produktbildung (z. B. H₂ an der Kathode, O₂ an der Anode bei Wasser) | Identifiziert die gasförmigen Produkte der Reaktion |
| Farbänderung | pH-Wert-Verschiebung oder Änderung der Ionenkonzentration (z. B. bei Indikatoren oder gefärbten Ionen wie Cu²⁺) | Zeigt die chemische Umgebung und den Reaktionsfortschritt an |
| Temperaturanstieg | Joule-Erwärmung; übermäßige Hitze kann auf Ineffizienz oder Nebenreaktionen hinweisen | Überwacht die Prozesssicherheit und Energieeffizienz |
| Elektrodenabscheidung/Korrosion | Metallabscheidung (Kathode) oder Auflösung (Anode) bei Prozessen wie der Galvanisierung | Entscheidend für Anwendungen, die eine Oberflächenmodifikation erfordern |
Optimieren Sie Ihre Elektrolyseprozesse mit KINTEK
Möchten Sie eine präzise Kontrolle über Ihre Elektrolyseexperimente oder industriellen Anwendungen erreichen? Das Verständnis dieser beobachtbaren Phänomene ist nur der erste Schritt. KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich zuverlässiger Elektroden, stabiler Netzteile und langlebiger Elektrolysezellen, die für konsistente Leistung und genaue Ergebnisse ausgelegt sind.
Ob Sie Forschung betreiben, neue Materialien entwickeln oder die Produktion skalieren – unsere Produkte helfen Ihnen, Schlüsselparameter effektiv zu überwachen und zu steuern. Kontaktieren Sie uns noch heute, um zu besprechen, wie unsere Lösungen Ihre elektrochemischen Arbeitsabläufe verbessern, die Effizienz steigern und die Sicherheit gewährleisten können.
Nehmen Sie jetzt Kontakt mit unseren Experten auf, um die perfekte Ausrüstung für Ihre Laboranforderungen zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- Doppelte Wasserbad-Elektrolysezelle
- Optisches Wasserbad Elektrolytische elektrochemische Zelle
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
Andere fragen auch
- Welche Schritte sind notwendig, um eine Elektrolysezelle aus Quarz vor einem Experiment vorzubereiten? Gewährleistung von Genauigkeit und Sicherheit
- Aus welchen Materialien besteht die Elektrolysezelle aus reinem Quarz? Ein Leitfaden für Reinheit und Leistung
- Welche Volumina und Abmessungen sind für die Elektrolysezelle aus Quarz erhältlich? Finden Sie die perfekte Lösung für Ihr Labor
- Was sind die Hauptanwendungen der Vollquarz-Elektrolysezelle? Essentiell für hochreine und optische Analysen
- Wie ist das korrekte Verfahren für die Nachbereitung und Lagerung einer Elektrolysezelle aus Quarzglas nach dem Experiment? Langlebigkeit und Reproduzierbarkeit gewährleisten



















