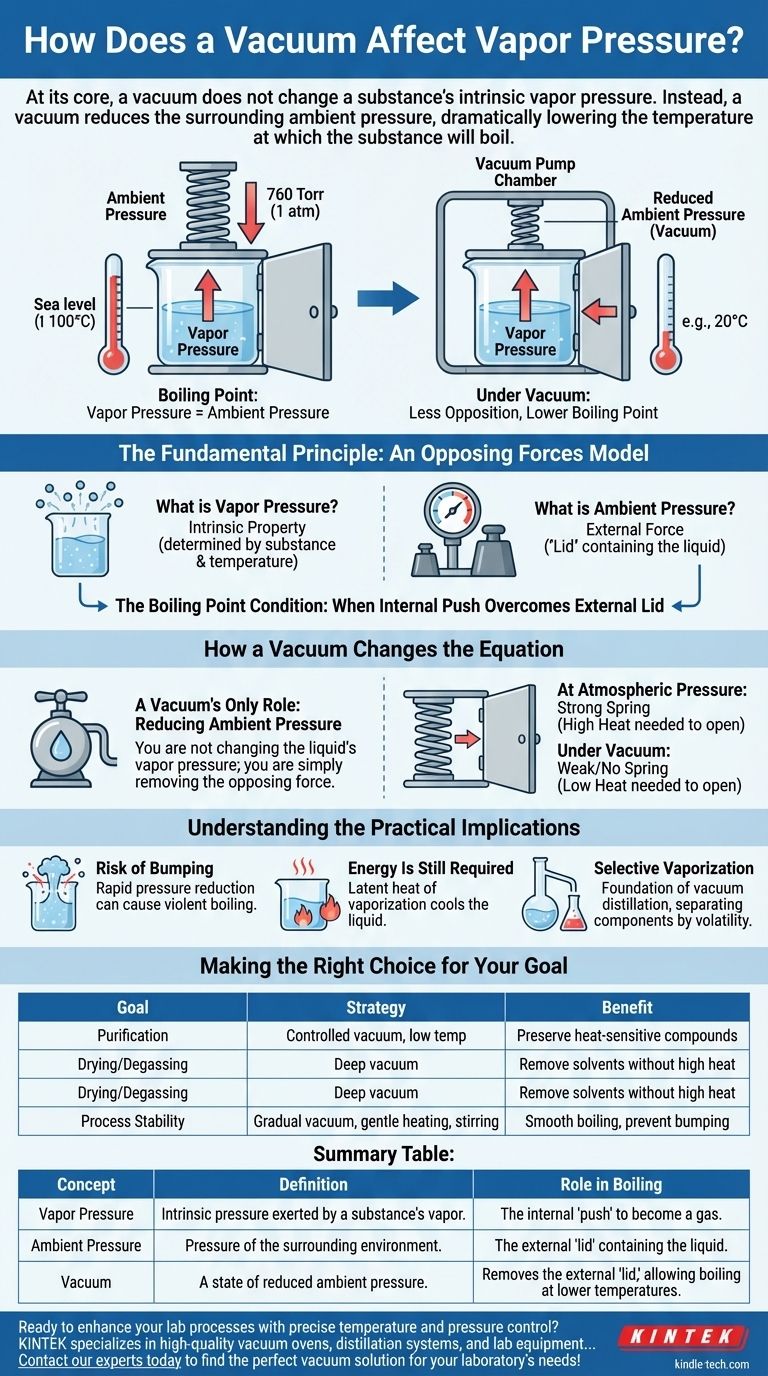
Im Grunde verändert ein Vakuum nicht den intrinsischen Dampfdruck einer Substanz. Stattdessen reduziert ein Vakuum den umgebenden Umgebungsdruck, was die Temperatur, bei der die Substanz siedet, drastisch senkt. Der Dampfdruck einer Substanz ist eine fundamentale Eigenschaft, die nur durch die Substanz selbst und ihre Temperatur bestimmt wird.
Sieden tritt auf, wenn der innere Dampfdruck einer Flüssigkeit dem äußeren Druck, der auf sie drückt, entspricht oder diesen übersteigt. Ein Vakuum beseitigt einfach diesen äußeren Druck, wodurch es für den Dampfdruck der Flüssigkeit viel einfacher wird, zu „gewinnen“ und das Sieden einzuleiten, selbst bei viel niedrigeren Temperaturen.
Das Grundprinzip: Ein Modell der Gegenkräfte
Um die Rolle eines Vakuums zu verstehen, müssen Sie zunächst zwischen zwei Schlüsselkonzepten unterscheiden: dem inneren „Druck“ der Flüssigkeit und dem äußeren „Druck“ der Umgebung.
Was ist Dampfdruck?
Der Dampfdruck ist der Druck, der vom Dampf einer Substanz ausgeübt wird, wenn dieser im Gleichgewicht mit ihrer flüssigen oder festen Phase steht. Betrachten Sie ihn als die inhärente Tendenz der Substanz, zu entweichen und gasförmig zu werden.
Diese Eigenschaft ist für das Material intrinsisch und hauptsächlich eine Funktion der Temperatur. Wenn Sie Wärme hinzufügen, bewegen sich die Moleküle schneller, und mehr von ihnen haben genügend Energie, um die Oberfläche der Flüssigkeit zu verlassen, wodurch der Dampfdruck steigt.
Was ist Umgebungsdruck?
Der Umgebungsdruck ist der Druck der umgebenden Umgebung, der auf die Oberfläche der Substanz drückt. Auf Meereshöhe ist dies das Gewicht der Atmosphäre über uns (ungefähr 760 Torr oder 1 atm).
Diese äußere Kraft wirkt wie ein „Deckel“, der die Flüssigkeit zurückhält und es den Molekülen erschwert zu entweichen.
Die Bedingung für den Siedepunkt
Eine Flüssigkeit siedet, wenn ihr innerer Druck den äußeren Deckel überwindet. Die technische Definition des Siedepunkts ist die Temperatur, bei der der Dampfdruck dem Umgebungsdruck entspricht. Dies ist die entscheidende Beziehung, die es zu verstehen gilt.
Wie ein Vakuum die Gleichung verändert
Ein Vakuumsystem interagiert nicht mit den Molekülen der Flüssigkeit, um deren inhärente Eigenschaften zu verändern. Seine einzige Aufgabe ist es, die äußere Umgebung zu verändern.
Die einzige Rolle eines Vakuums: Reduzierung des Umgebungsdrucks
Eine Vakuumpumpe arbeitet, indem sie Gasmoleküle (wie Luft) aus einer versiegelten Kammer entfernt. Durch das Entfernen dieser Moleküle senkt sie drastisch den Umgebungsdruck, der auf die Flüssigkeit im Inneren drückt.
Sie verändern nicht den Dampfdruck der Flüssigkeit; Sie beseitigen lediglich die Gegenkraft.
Den Siedepunkt früher erreichen
Stellen Sie sich vor, Sie versuchen, eine federbelastete Tür zu öffnen. Der Dampfdruck ist die Kraft, die Sie auf die Tür ausüben, und der Umgebungsdruck ist die Kraft der Feder, die zurückdrückt.
- Bei atmosphärischem Druck: Die Feder ist stark. Sie müssen sehr stark drücken (viel Wärme hinzufügen), um die Tür zu öffnen (damit die Flüssigkeit siedet).
- Unter Vakuum: Sie haben die Feder entfernt. Nun reicht schon ein sanfter Druck (eine geringe Wärmemenge), um die Tür leicht zu öffnen.
Die Beschaffenheit der Tür hat sich nicht geändert, nur der Widerstand. Deshalb kann Wasser, das auf Meereshöhe bei 100 °C (212 °F) siedet, unter einem ausreichenden Vakuum bei Raumtemperatur sieden.
Verständnis der praktischen Auswirkungen
Die Anwendung eines Vakuums ist eine wirkungsvolle Technik, bringt jedoch spezifische Verhaltensweisen und Einschränkungen mit sich, die Sie steuern müssen.
Risiko des „Bumping“ (Gefährliches Aufschäumen)
Wenn der Druck zu schnell reduziert wird, kann die Flüssigkeit unterkühlt werden. Energie baut sich auf, ohne zu sieden, bis sie in einem einzigen, heftigen Ereignis ausbricht, das als Bumping bekannt ist. Deshalb sind eine kontrollierte, schrittweise Vakuum-Anwendung und Rühren in Labor- und Industrieumgebungen von entscheidender Bedeutung.
Energie wird immer noch benötigt
Selbst unter einem perfekten Vakuum ist das Sieden nicht augenblicklich oder „kostenlos“. Der Phasenübergang von flüssig zu gasförmig (Verdampfung) erfordert immer noch Energie, bekannt als die latente Verdampfungswärme. Wenn keine externe Wärmequelle vorhanden ist, entzieht die Flüssigkeit diese Energie sich selbst, wodurch ihre Temperatur schnell sinkt. Dies ist das Prinzip hinter der Gefriertrocknung.
Selektive Verdampfung
Dieses gesamte Prinzip ist die Grundlage der Vakuumdestillation. Zwei Flüssigkeiten mit unterschiedlichen Siedepunkten können bei einer niedrigen Temperatur getrennt werden, die verhindert, dass sie sich zersetzen. Die flüchtigere Substanz (mit dem höheren intrinsischen Dampfdruck) siedet unter Vakuum zuerst ab, während die weniger flüchtige Substanz zurückbleibt.
Die richtige Wahl für Ihr Ziel treffen
Das Verständnis dieser Beziehung ermöglicht es Ihnen, Prozesse präzise zu steuern. Ihre Strategie hängt davon ab, was Sie erreichen möchten.
- Wenn Ihr Hauptaugenmerk auf der Reinigung liegt: Verwenden Sie ein kontrolliertes Vakuum, um flüchtige Komponenten aus einem Gemisch bei niedrigen Temperaturen abzutrennen und hitzeempfindliche Verbindungen zu schonen.
- Wenn Ihr Hauptaugenmerk auf dem Trocknen oder Entgasen liegt: Wenden Sie ein tiefes Vakuum an, um restliche Lösungsmittel wie Wasser oder Luft aus einer Probe zu entfernen, ohne sie auf hohe Temperaturen erhitzen zu müssen.
- Wenn Ihr Hauptaugenmerk auf der Prozessstabilität liegt: Kombinieren Sie ein schrittweises Vakuum mit sanftem Erhitzen und Rühren, um ein gleichmäßiges Sieden zu erreichen und heftiges Bumping zu verhindern.
Indem Sie das Zusammenspiel von Temperatur und Druck beherrschen, erhalten Sie präzise Kontrolle über den physikalischen Zustand Ihrer Materialien.

Zusammenfassungstabelle:
| Konzept | Definition | Rolle beim Sieden |
|---|---|---|
| Dampfdruck | Intrinsischer Druck, der vom Dampf einer Substanz ausgeübt wird. | Der innere „Druck“ der Flüssigkeit, gasförmig zu werden. |
| Umgebungsdruck | Druck der umgebenden Umgebung (z. B. Atmosphäre). | Der äußere „Deckel“, der die Flüssigkeit zurückhält. |
| Vakuum | Ein Zustand mit reduziertem Umgebungsdruck. | Entfernt den äußeren „Deckel“ und ermöglicht das Sieden bei niedrigeren Temperaturen. |
Bereit, Ihre Laborprozesse mit präziser Temperatur- und Druckkontrolle zu verbessern?
KINTEK ist spezialisiert auf hochwertige Vakuumtrockenschränke, Destillationsanlagen und Laborgeräte, die für effizientes Sieden, Trocknen und Reinigen bei niedrigen Temperaturen entwickelt wurden. Unsere Lösungen helfen Ihnen, hitzeempfindliche Materialien zu schonen und die Prozessstabilität zu verbessern.
Kontaktieren Sie noch heute unsere Experten, um die perfekte Vakuumlösung für die Anforderungen Ihres Labors zu finden!
Visuelle Anleitung
Ähnliche Produkte
- Vakuum-Kältesynthese-Direkt-Kältesynthese-Kühler
- Vakuum-Kältesynthese-Kühler Indirekter Kältesynthese-Kühler
- Labor-Wasserumlauf-Vakuumpumpe für Laboranwendungen
- KF ISO Edelstahl Vakuumflansch Blindplatte für Hochvakuum-Systeme
- Vakuum-Wärmebehandlungs-Sinter-Hartlöt-Ofen
Andere fragen auch
- Was ist der Zweck eines Tauchkühlzubehörs? Erweitern Sie die Flexibilität und den Temperaturbereich des Labors
- Warum wird am Reaktorauslass eine Flüssigstickstoff-Kühlfalle installiert? Wesentliche Probenerhaltung & Systemschutz
- Warum ist es notwendig, effiziente Kühlfallen bei der Membrandestillation zu konfigurieren? Sorgen Sie für Flussstabilität & Datenintegrität
- Was ist der Zweck eines Eiswasserbades bei der Mikrowellenpyrolyse? Erhöhung der Bioöl-Ausbeute und der Probenintegrität
- Was ist der Mechanismus einer hocheffizienten Kühlfalle bei der Pervaporation? Optimieren Sie Ihre Dampfabscheideeffizienz



















