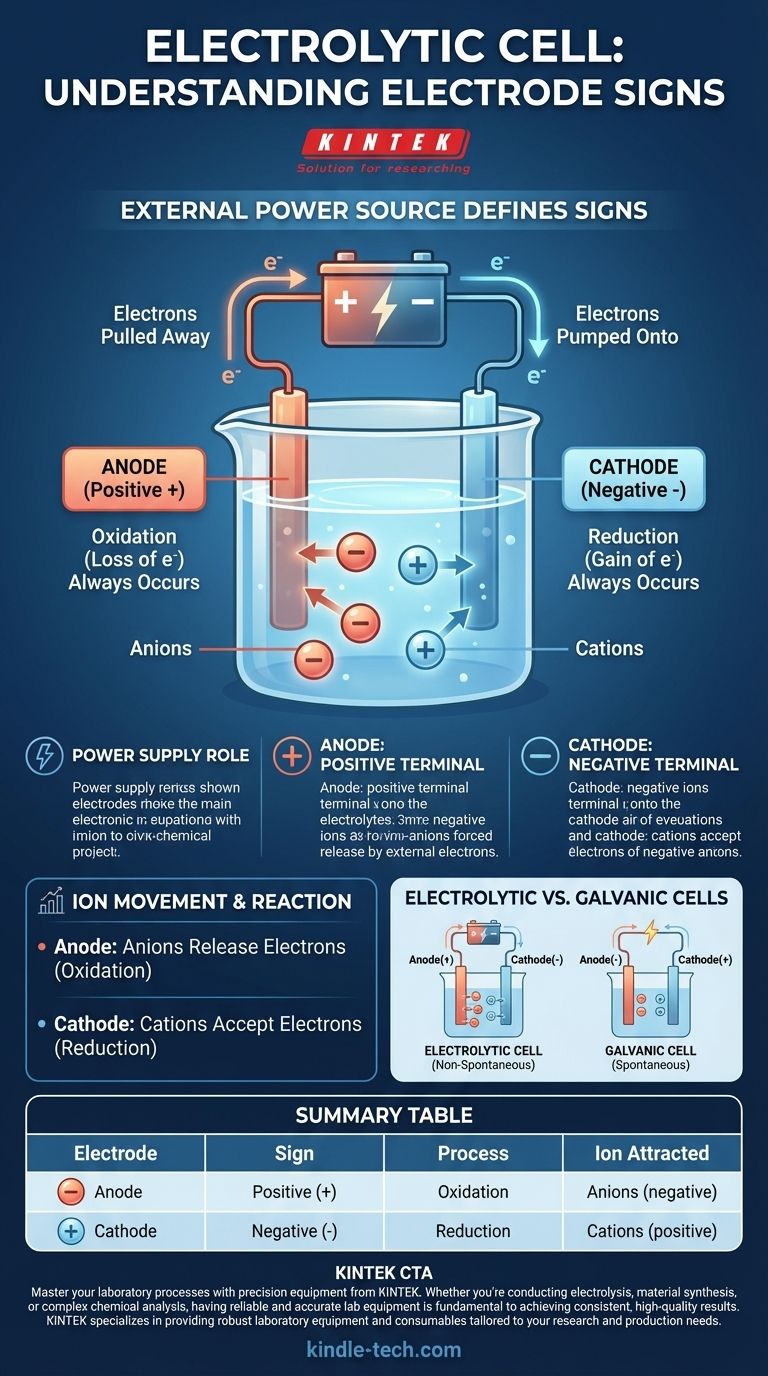
In einer Elektrolysezelle wird die Vorzeichenkonvention durch die externe Stromquelle bestimmt. Der Anode wird ein positives (+) Zeichen und der Kathode ein negatives (-) Zeichen zugeordnet. Dies liegt daran, dass eine externe Spannung angelegt wird, um eine chemische Reaktion zu erzwingen, die nicht spontan ablaufen würde.
Der Schlüssel zum Verständnis einer Elektrolysezelle liegt darin, zu erkennen, dass es sich nicht um ein in sich geschlossenes System handelt. Die Vorzeichen ihrer Elektroden werden vollständig von der externen Stromversorgung bestimmt, an die sie angeschlossen ist, wodurch eine nicht-spontane chemische Umwandlung erzwungen wird.

Warum eine externe Stromquelle die Vorzeichen bestimmt
Eine Elektrolysezelle nutzt elektrische Energie, um chemische Energie zu erzeugen. Dieser Prozess, bekannt als Elektrolyse, erfordert eine äußere Kraft – eine Batterie oder eine Gleichstromquelle –, um die Reaktion einzuleiten und aufrechtzuerhalten.
Die Rolle der Stromversorgung
Die Stromversorgung wirkt als „Elektronenpumpe“. Sie zieht Elektronen von einer Elektrode ab und drückt sie zur anderen, wodurch ein Ladungsausgleich entsteht, der die Ionen in der Elektrolytlösung zur Reaktion zwingt.
Die Anode ist mit dem Pluspol verbunden
Der Pluspol der externen Stromversorgung ist mit der Anode verbunden. Dieser Pol zieht aktiv Elektronen von der Anode weg, wodurch diese eine Nettopositivladung erhält.
Die Kathode ist mit dem Minuspol verbunden
Umgekehrt ist der Minuspol der Stromversorgung mit der Kathode verbunden. Dieser Pol pumpt aktiv Elektronen auf die Kathode, wodurch diese einen Elektronenüberschuss und eine Nettonegativladung erhält.
Wie die Ionenbewegung die Reaktion erzeugt
Die erzwungenen Ladungen an den Elektroden ziehen die im Elektrolyten gelösten Ionen an und zwingen sie zur Bewegung und Reaktion. Die grundlegenden Definitionen von Oxidation und Reduktion bleiben konstant.
Anode: Der Ort der Oxidation (Immer)
Unabhängig vom Zelltyp findet Oxidation (der Elektronenverlust) immer an der Anode statt. In einer Elektrolysezelle werden negativ geladene Ionen (Anionen) von der positiven Anode angezogen, wo sie ihre überschüssigen Elektronen abgeben und oxidiert werden.
Kathode: Der Ort der Reduktion (Immer)
Ebenso findet Reduktion (der Elektronengewinn) immer an der Kathode statt. Positiv geladene Ionen (Kationen) in der Lösung werden von der negativen Kathode angezogen, wo sie die überschüssigen Elektronen aufnehmen und reduziert werden.
Ein kritischer Unterschied: Elektrolytische vs. Galvanische Zellen
Eine Hauptquelle der Verwirrung entsteht beim Vergleich von Elektrolysezellen mit galvanischen (oder voltaischen) Zellen, wie einer Standardbatterie. Ihre Vorzeichenkonventionen sind aus einem ganz bestimmten Grund entgegengesetzt.
Spontane vs. Nicht-spontane Reaktionen
Eine galvanische Zelle läuft mit einer spontanen chemischen Reaktion ab, die elektrische Energie erzeugt. Hier ist die Anode die natürliche Quelle der Elektronen, was sie negativ macht, und die Kathode ist der Ort, an dem sie verbraucht werden, was sie positiv macht.
Eine Elektrolysezelle führt eine nicht-spontane Reaktion durch, die elektrische Energie verbraucht. Die externe Stromquelle kehrt die natürliche Polarität um, um die Reaktion zu erzwingen.
Die universelle Konstante
Trotz des Unterschieds in den Vorzeichen sind die Kernprozesse in beiden Zelltypen gleich:
- Anode ist immer der Ort der Oxidation.
- Kathode ist immer der Ort der Reduktion.
Wie man sich die Vorzeichen merkt
Nutzen Sie diese Prinzipien, um die Konventionen basierend auf Ihrem Ziel klar zu halten.
- Wenn Ihr Hauptaugenmerk auf der Identifizierung der Pole liegt: Denken Sie daran, dass in einer Elektrolysezelle die Vorzeichen mit der externen Stromversorgung übereinstimmen: die Anode ist positiv und die Kathode ist negativ.
- Wenn Ihr Hauptaugenmerk auf der Verfolgung der Ionen liegt: Befolgen Sie die einfache Regel der entgegengesetzten Ladungen: negative Anionen bewegen sich zur positiven Anode, und positive Kationen bewegen sich zur negativen Kathode.
- Wenn Ihr Hauptaugenmerk auf der Unterscheidung der Zelltypen liegt: Verbinden Sie „elektrolytisch“ mit einer externen Stromquelle, die eine positive Ladung auf die Anode und eine negative Ladung auf die Kathode erzwingt, um die Reaktion anzutreiben.
Letztendlich sind die Vorzeichen einer Elektrolysezelle eine direkte Folge einer externen Stromquelle, die den natürlichen Fluss einer chemischen Reaktion außer Kraft setzt.
Zusammenfassungstabelle:
| Elektrode | Zeichen | Prozess | Angeziogenes Ion |
|---|---|---|---|
| Anode | Positiv (+) | Oxidation | Anionen (negativ) |
| Kathode | Negativ (-) | Reduktion | Kationen (positiv) |
Meistern Sie Ihre Laborprozesse mit Präzisionsgeräten von KINTEK.
Ob Sie Elektrolyse, Materialsynthese oder komplexe chemische Analysen durchführen, zuverlässige und genaue Laborgeräte sind grundlegend für konsistente Ergebnisse von hoher Qualität. KINTEK ist spezialisiert auf die Bereitstellung robuster Laborgeräte und Verbrauchsmaterialien, die auf Ihre Forschungs- und Produktionsanforderungen zugeschnitten sind.
Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie unsere Lösungen Ihre Innovationen vorantreiben und die Effizienz Ihrer Laborabläufe verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- Doppelte Wasserbad-Elektrolysezelle
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- Optisches Wasserbad Elektrolytische elektrochemische Zelle
Andere fragen auch
- Aus welchem Material besteht die Fünf-Port-Elektrolysezelle mit Wasserbad? Hochborosilikatglas & PTFE erklärt
- Wie sollte die Fünf-Port-Wasserbad-Elektrolysezelle zur Wartung gereinigt werden? Eine Schritt-für-Schritt-Anleitung für zuverlässige Ergebnisse
- Wie kann Kontamination bei Experimenten mit der Fünf-Port-Wasserbad-Elektrolysezelle vermieden werden? Meistern Sie das 3-Säulen-Protokoll
- Wie können Lecks bei der Verwendung einer Fünf-Port-Wasserbad-Elektrolysezelle verhindert werden? Sorgen Sie für einen zuverlässigen und sicheren elektrochemischen Aufbau
- Wie wird eine Elektrolysezelle mit fünf Anschlüssen im Wasserbad richtig gehandhabt? Gewährleistung genauer und sicherer elektrochemischer Experimente



















