Im Grunde genommen ist Korrosion der natürliche Abbau eines raffinierten Metalls in eine chemisch stabilere Form, wie sein Oxid oder Sulfid. Innerhalb einer elektrochemischen Zelle ist dieser Prozess nicht nur eine Oberflächenreaktion, sondern ein vollständiger Kreislauf, bei dem sich das Metall im Wesentlichen selbst zerstört, indem es eine winzige, unerwünschte Batterie auf seiner eigenen Oberfläche bildet.
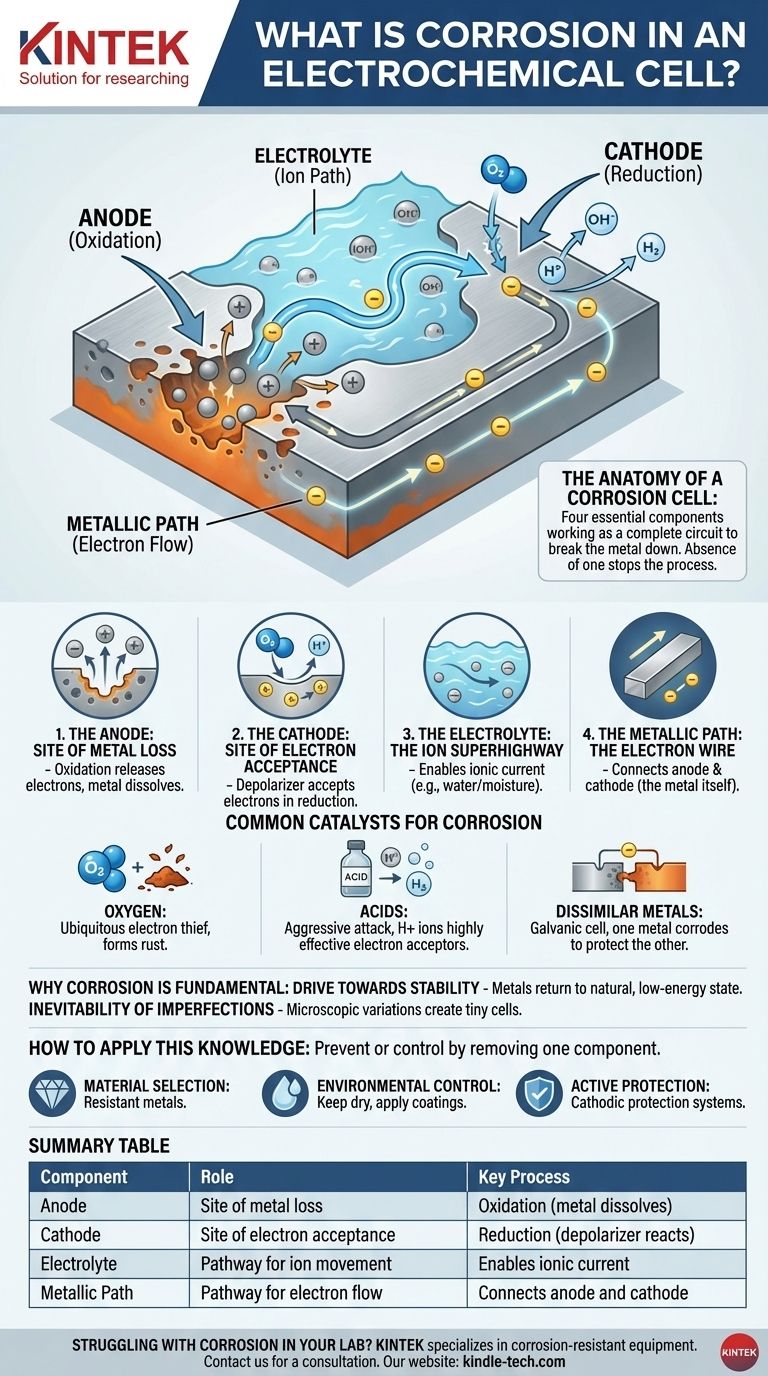
Korrosion ist ein elektrochemischer Prozess, da er die vier wesentlichen Komponenten einer Batterie beinhaltet: eine Anode (wo das Metall verloren geht), eine Kathode, einen Elektrolyten (wie Wasser) und einen metallischen Pfad, die alle zusammenarbeiten, um das Metall abzubauen.
Die Anatomie einer Korrosionszelle
Korrosion zu verstehen bedeutet, die vier Komponenten zu verstehen, die sie zum Funktionieren benötigt. Das Fehlen einer dieser Komponenten stoppt den Prozess vollständig.
Die Anode: Der Ort des Metallverlusts
Die anodische Stelle ist der spezifische Punkt auf der Metalloberfläche, an dem die Korrosion auftritt. Hier erfahren Metallatome eine Oxidation, verlieren Elektronen und wandeln sich in positiv geladene Ionen um, die in das umgebende Wasser oder die Feuchtigkeit gelöst werden. Dies ist der physische Vorgang des „Wegfressens“ des Metalls.
Die Kathode: Der Ort der Elektronenaufnahme
Die von der Anode freigesetzten Elektronen wandern durch das Metall zu einem anderen Ort, der kathodischen Stelle. Hier nimmt eine Substanz in der Umgebung – bekannt als Depolarisator – diese Elektronen in einer Reduktionsreaktion auf. Dieser Depolarisator ist eine entscheidende Zutat.
Der Elektrolyt: Die Ionen-Autobahn
Wasser, selbst in mikroskopischen Mengen wie Luftfeuchtigkeit, fungiert als Elektrolyt. Er bietet ein Medium für die gelösten Metallionen (von der Anode) und andere Ionen, um zu wandern und den Stromkreis zu schließen. Ohne einen Elektrolyten haben die Ionen keine Möglichkeit, sich zu bewegen, und der Kreislauf ist unterbrochen.
Der metallische Pfad: Der Elektronendraht
Der Metallkörper selbst dient als metallischer Pfad. Er bietet einen leitfähigen Weg für die Elektronen, um von der Anode zur Kathode zu wandern. Deshalb können die anodischen und kathodischen Stellen direkt nebeneinander oder weit voneinander entfernt auf demselben Metallstück liegen.
Häufige Katalysatoren für Korrosion
Die Geschwindigkeit und Schwere der Korrosion werden oft durch die Verfügbarkeit und Art des Depolarisators (des Elektronenakzeptors) an der Kathode bestimmt.
Sauerstoff: Der allgegenwärtige Elektronenräuber
In den meisten gängigen Umgebungen ist gelöster Sauerstoff der primäre Elektronenakzeptor. Deshalb sind Wasser und Sauerstoff zusammen für Metalle wie Eisen so zerstörerisch und führen zur Bildung von Rost (Eisenoxid).
Säuren: Ein aggressiver Angriff
Säuren beschleunigen die Korrosion dramatisch. Die Wasserstoffionen (H+) in einer sauren Lösung sind hochwirksame Elektronenakzeptoren und erzeugen an der Kathode Wasserstoffgas. Dieser Prozess ist typischerweise viel schneller und aggressiver als die sauerstoffgetriebene Korrosion.
Ungleiche Metalle: Die galvanische Zelle
Wenn zwei verschiedene Metalle in einem Elektrolyten in elektrischem Kontakt stehen, bilden sie eine galvanische Zelle. Das unedlere, aktivere Metall wird zur Anode und korrodiert schnell, während das edlere Metall zur Kathode wird und geschützt wird. Deshalb sieht man Opferanoden aus Zink an Bootsrümpfen, um den Stahl zu schützen.
Warum Korrosion ein fundamentaler Prozess ist
Korrosion ist kein Fehler; sie ist ein natürlicher und spontaner Prozess, der durch grundlegende thermodynamische Gesetze angetrieben wird. Dieses Unvermeidliche zu verstehen, ist der Schlüssel zu seiner Bewältigung.
Der Drang zur Stabilität
Raffinierte Metalle wie Aluminium und Stahl sind vom Menschen hergestellte Materialien, die sich in einem energiereichen Zustand befinden. Korrosion ist einfach der Prozess, bei dem dieses Metall in seinen natürlichen, energiearmen Zustand zurückkehrt, ähnlich dem Erz, aus dem es gewonnen wurde. Das Metall gibt seine gespeicherte Energie ab.
Die Unvermeidbarkeit von Unvollkommenheiten
Keine Metalloberfläche ist perfekt einheitlich. Mikroskopische Unterschiede in der Zusammensetzung, Spannungen durch die Herstellung oder sogar Unterschiede in der Sauerstoffexposition erzeugen winzige anodische und kathodische Stellen auf der gesamten Oberfläche. Diese Unvollkommenheiten sind alles, was nötig ist, um Tausende mikroskopischer Korrosionszellen zu initiieren.
Wie man dieses Wissen anwendet
Zu verstehen, dass Korrosion eine elektrochemische Zelle ist, gibt Ihnen einen klaren Rahmen für deren Verhinderung oder Kontrolle. Die Strategie besteht immer darin, eine der vier wesentlichen Komponenten zu entfernen.
- Wenn Ihr Hauptaugenmerk auf der Materialauswahl liegt: Verwenden Sie Metalle, die in ihrer Betriebsumgebung von Natur aus beständig gegen die Bildung einer elektrochemischen Zelle sind, oder vermeiden Sie den Kontakt ungleicher Metalle.
- Wenn Ihr Hauptaugenmerk auf der Umweltkontrolle liegt: Beseitigen Sie den Elektrolyten, indem Sie das Metall trocken halten oder eine wasserdichte Beschichtung (wie Farbe) auftragen, um das Eindringen von Feuchtigkeit auf die Oberfläche zu verhindern.
- Wenn Ihr Hauptaugenmerk auf dem aktiven Schutz liegt: Erzeugen Sie absichtlich eine stärkere elektrochemische Zelle, bei der Ihr Strukturmetall gezwungen wird, die Kathode zu sein. Dies ist das Prinzip hinter sowohl Opferanoden als auch kathodischen Schutzsystemen.
Indem Sie Korrosion als einen einfachen Stromkreis betrachten, können Sie systematisch deren Ursache diagnostizieren und ihren zerstörerischen Weg wirksam unterbrechen.

Zusammenfassungstabelle:
| Komponente | Rolle in der Korrosionszelle | Schlüsselprozess |
|---|---|---|
| Anode | Ort des Metallverlusts | Oxidation (Metall löst sich auf) |
| Kathode | Ort der Elektronenaufnahme | Reduktion (Depolarisator reagiert) |
| Elektrolyt | Weg für Ionenbewegung | Ermöglicht Ionenstrom (z. B. Wasser) |
| Metallischer Pfad | Weg für Elektronenfluss | Verbindet Anode und Kathode (das Metall selbst) |
Haben Sie Probleme mit Korrosion an Ihrer Laborausrüstung?
Korrosion kann Ihre Experimente gefährden, empfindliche Instrumente beschädigen und zu kostspieligen Ausfallzeiten führen. KINTEK ist spezialisiert auf korrosionsbeständige Laborgeräte und Verbrauchsmaterialien und hilft Ihnen, Ihre Investitionen zu schützen und die Integrität Ihrer Forschung zu gewährleisten.
Unsere Experten können Ihnen helfen, die richtigen Materialien und Lösungen auszuwählen, um den Korrosionskreislauf in Ihrer spezifischen Laborumgebung zu unterbrechen.
Kontaktieren Sie KINTEK noch heute für eine Beratung und erfahren Sie, wie wir Ihnen helfen können, Korrosion zu bekämpfen und die Leistung Ihres Labors zu verbessern.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Flache Korrosions-Elektrolysezelle
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Dünnschicht-Spektroelektrochemische Zelle
Andere fragen auch
- Was sind die Standardspezifikationen für Volumen und Öffnungen der In-situ-Raman-Elektrolysezelle? Meistern Sie das Design für präzise Analysen
- Wie sollte die H-Typ-Elektrolysezelle vor einem Experiment gereinigt werden? Gewährleisten Sie die Datenintegrität mit ordnungsgemäßen Protokollen
- Wie beeinflusst die Stromdichte MgO-Nanostrukturen? Steuerung der Mikromorphologie bei der elektrochemischen Synthese
- Wie ist eine H-Typ-Elektrolysezelle mit austauschbarer Membran aufgebaut? Ein Leitfaden zur präzisen elektrochemischen Trennung
- Wie erleichtert eine Leitfähigkeitsprüfzelle mit Kupferelektroden und PTFE-Ringen die Charakterisierung von fluorierten Kohlenstoffaerogelen?
- Welche Parameter müssen in einer Elektrolysezelle aus reinem PTFE streng kontrolliert werden? Präzision und Sicherheit gewährleisten
- Was ist bei der Auswahl eines Elektrolyten für eine reine PTFE-Zelle zu beachten? Expertentipps für Spitzenleistungen
- Was sind die gängigen Typen von elektrolytischen Acrylzellen? Wählen Sie die richtige Zelle für Ihr elektrochemisches Experiment



















