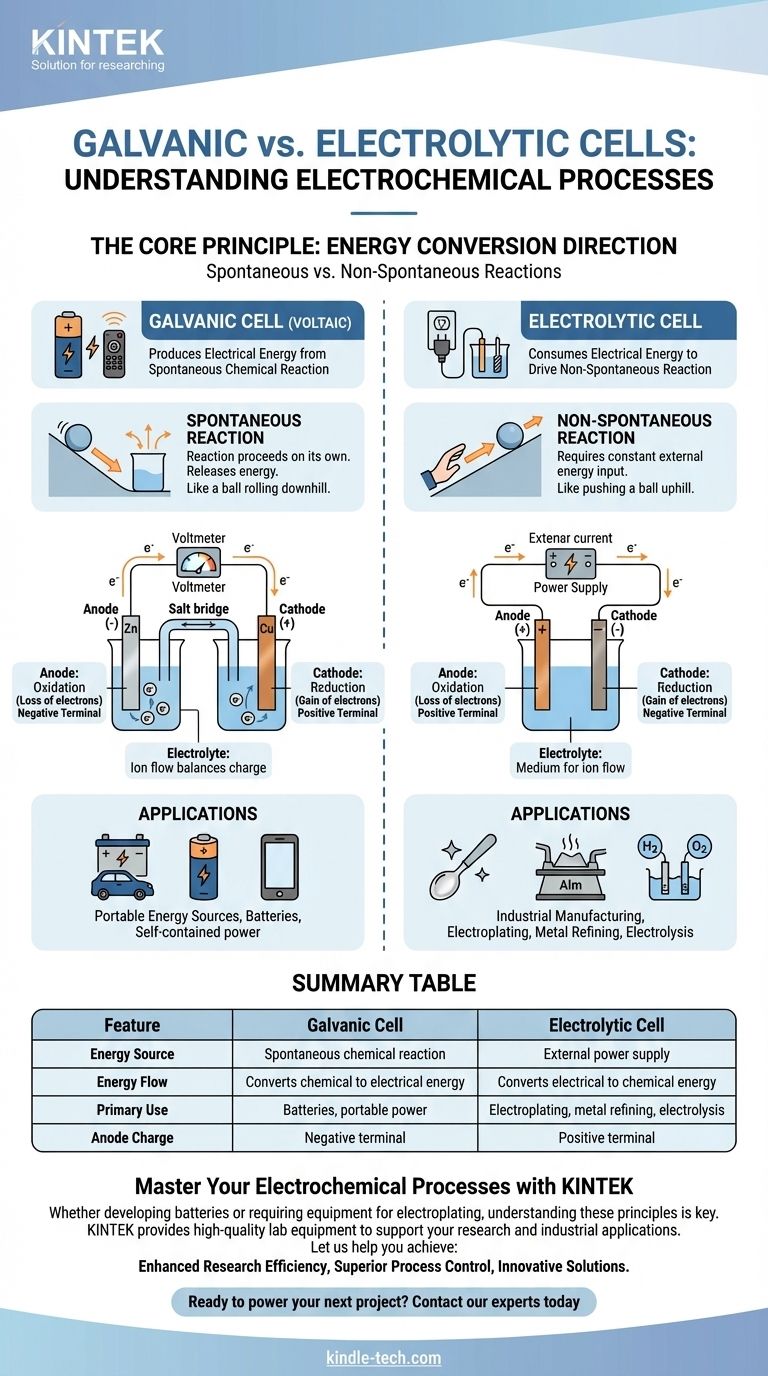
Im Kern ist eine galvanische Zelle eine elektrochemische Zelle, die elektrische Energie aus einer spontanen chemischen Reaktion erzeugt, wie eine Batterie, die Ihre Fernbedienung mit Strom versorgt. Im Gegensatz dazu verbraucht eine Elektrolysezelle elektrische Energie aus einer externen Quelle, um eine nicht-spontane chemische Reaktion zu erzwingen, ein Prozess, der bei der Metallbeschichtung und -reinigung eingesetzt wird.
Der grundlegende Unterschied liegt in der Richtung der Energieumwandlung. Eine galvanische Zelle wandelt gespeicherte chemische Energie in elektrische Energie um, während eine Elektrolysezelle externe elektrische Energie in chemische Energie umwandelt.

Das Kernprinzip: Spontane vs. nicht-spontane Reaktionen
Das Verhalten jeder elektrochemischen Zelle wird durch die natürliche Tendenz ihrer chemischen Reaktion bestimmt. Diese Tendenz ist der Schlüssel zum Verständnis, warum die eine Zelle Strom erzeugt und die andere ihn benötigt.
Wie galvanische Zellen Strom erzeugen
Eine galvanische Zelle, auch als voltaische Zelle bekannt, basiert auf einer spontanen chemischen Reaktion.
Dies ist eine Reaktion, die ohne äußere Einwirkung von selbst abläuft und dabei Energie freisetzt. Stellen Sie es sich wie einen Ball vor, der einen Hügel hinunterrollt.
Diese Energiefreisetzung treibt Elektronen durch einen externen Stromkreis und erzeugt einen elektrischen Strom. Dies ist das Prinzip hinter allen nicht wiederaufladbaren und entladenden wiederaufladbaren Batterien.
Wie Elektrolysezellen Strom verbrauchen
Eine Elektrolysezelle treibt eine nicht-spontane chemische Reaktion an.
Dies ist eine Reaktion, die nicht von selbst abläuft und eine ständige Energiezufuhr erfordert, um abzulaufen. Es ist das Äquivalent dazu, einen Ball bergauf zu schieben.
Eine externe Stromquelle, wie ein Netzteil, liefert die notwendige Spannung, um Elektronen gegen ihre natürliche Richtung fließen zu lassen und die gewünschte chemische Veränderung herbeizuführen.
Ein praktischer Blick auf die Zellfunktion
Obwohl ihre Zwecke entgegengesetzt sind, teilen beide Zellen gemeinsame Komponenten, die unter denselben grundlegenden chemischen Regeln arbeiten, jedoch mit einem kritischen Unterschied in der Polarität.
Anode und Kathode: Eine Geschichte zweier Polaritäten
Bei beiden Zelltypen ist die Anode immer der Ort, an dem Oxidation stattfindet (Elektronenverlust), und die Kathode ist der Ort, an dem Reduktion stattfindet (Elektronengewinn).
Ihre elektrische Ladung ist jedoch umgekehrt. In einer galvanischen Zelle ist die Anode der negative Pol, da die spontane Reaktion Elektronen von ihr freisetzt.
In einer Elektrolysezelle ist die Anode der positive Pol, da die externe Stromquelle Elektronen von ihr abzieht und so die Oxidation erzwingt.
Die Rolle des Elektrolyten
Beide Zellen enthalten einen Elektrolyten, typischerweise eine Ionen enthaltende Lösung.
Dieses Medium ist wesentlich für den Abschluss des elektrischen Stromkreises. Während Elektronen durch den externen Draht fließen, fließen Ionen durch den Elektrolyten, um die Ladung an den Elektroden auszugleichen.
Anwendungen und Kompromisse verstehen
Die entgegengesetzten Funktionen dieser Zellen führen zu sehr unterschiedlichen realen Anwendungen und inhärenten Einschränkungen.
Galvanische Zellen: Tragbare Energiequellen
Die Hauptanwendung von galvanischen Zellen ist die Funktion als Batterien. Sie bieten eine tragbare, eigenständige elektrische Energiequelle.
Der Kompromiss besteht darin, dass die chemischen Reaktanten in der Zelle endlich sind. Sobald sie verbraucht sind, erzeugt die Zelle keinen Strom mehr und muss entweder entsorgt oder wieder aufgeladen werden.
Elektrolysezellen: Industrielle Fertigung und Reinigung
Elektrolysezellen sind die Arbeitspferde der Industrie und werden für Prozesse eingesetzt, die sonst chemisch unmöglich oder ineffizient wären.
Zu den Hauptanwendungen gehören die Galvanisierung (Beschichtung eines Metalls mit einem anderen), die Raffination von Metallen wie Aluminium und Kupfer sowie die Elektrolyse von Wasser zur Erzeugung von Wasserstoff und Sauerstoff. Ihre Haupteinschränkung ist der Bedarf an einer erheblichen und kontinuierlichen Zufuhr externer elektrischer Energie.
Wie man dieses Wissen anwendet
Ihre Wahl zwischen diesen Konzepten hängt ausschließlich davon ab, ob Ihr Ziel die Stromerzeugung oder die Herbeiführung einer chemischen Veränderung ist.
- Wenn Ihr Hauptaugenmerk auf der Erzeugung von Elektrizität aus einer chemischen Reaktion liegt: Sie arbeiten mit den Prinzipien einer galvanischen Zelle, z. B. beim Entwurf oder Verständnis einer Batterie.
- Wenn Ihr Hauptaugenmerk darauf liegt, Elektrizität zur Herstellung eines Produkts oder zur Raffination einer Substanz zu nutzen: Sie arbeiten mit den Prinzipien einer Elektrolysezelle, die in der chemischen Fertigung und Metallurgie üblich ist.
Das Verständnis dieser Unterscheidung ist der erste Schritt zur Beherrschung der praktischen Anwendung der Elektrochemie.
Zusammenfassungstabelle:
| Merkmal | Galvanische Zelle | Elektrolysezelle |
|---|---|---|
| Energiequelle | Spontane chemische Reaktion | Externe Stromversorgung |
| Energiefluss | Wandelt chemische in elektrische Energie um | Wandelt elektrische in chemische Energie um |
| Hauptanwendung | Batterien, tragbare Energie | Galvanisierung, Metallraffination, Elektrolyse |
| Anodenladung | Negativer Pol | Positiver Pol |
Meistern Sie Ihre elektrochemischen Prozesse mit KINTEK
Ob Sie neue Batterietechnologien entwickeln oder präzise Ausrüstung für die Galvanisierung und Metallreinigung benötigen, das Verständnis dieser elektrochemischen Grundprinzipien ist nur der Anfang. KINTEK ist spezialisiert auf die Bereitstellung hochwertiger Laborausrüstung und Verbrauchsmaterialien zur Unterstützung Ihrer Forschungs- und Industrieanwendungen.
Lassen Sie uns Ihnen helfen, zu erreichen:
- Erhöhte Forschungseffizienz: Mit zuverlässiger Ausrüstung zum Testen und Entwickeln von galvanischen und elektrolytischen Systemen.
- Überlegene Prozesskontrolle: Für konsistente Ergebnisse bei Galvanisierung, Elektrolyse und Materialsynthese.
- Innovative Lösungen: Zugeschnitten auf die einzigartigen Bedürfnisse von Laboren und Produktionsstätten.
Bereit, Ihr nächstes Projekt voranzutreiben? Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für Ihre Laborbedürfnisse zu finden!
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
Andere fragen auch
- Welche optischen Merkmale weist die H-Typ-Elektrolysezelle auf? Präzisions-Quarzglasfenster für die Photoelektrochemie
- Was ist der Zweck der Doppelglasschichtstruktur in der H-Typ-Elektrolysezelle? Präzise Temperaturregelung erreichen
- Wie sollte die H-Typ-Elektrolysezelle bei Nichtgebrauch gelagert werden? Leitfaden zur fachgerechten Lagerung und Wartung
- Was sind die typischen Volumina und Öffnungskonfigurationen für eine doppelwandige Wasserbad-Elektrolysezelle? Optimieren Sie Ihr elektrochemisches Setup
- Wie ist die Gesamtstruktur der optischen H-Typ-Doppelschicht-Wasserbad-Elektrolysezelle aufgebaut? Präzisionsdesign für kontrollierte Experimente



















