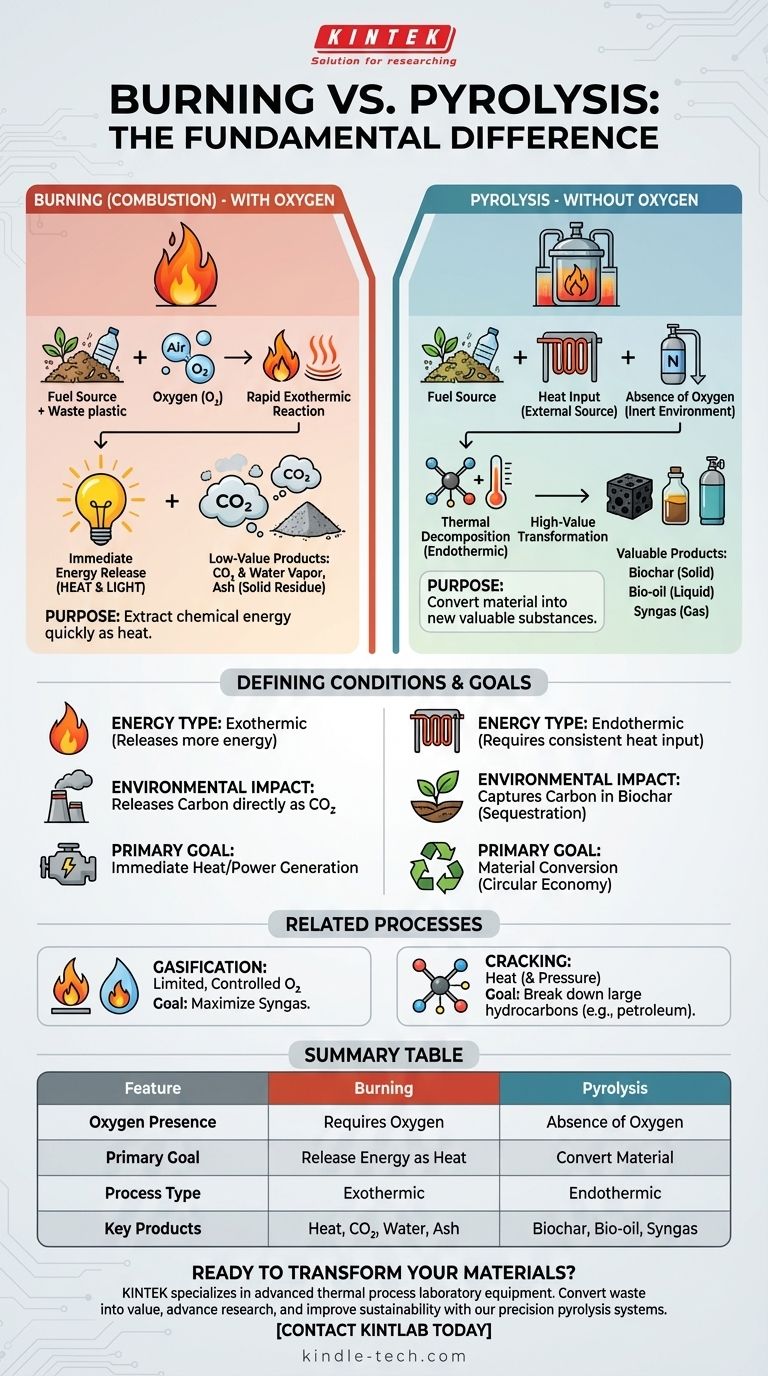
Im Kern liegt der Unterschied im Sauerstoff. Verbrennung (Combustion) ist eine chemische Reaktion, die Sauerstoff nutzt, um schnell Energie aus einem Material als Wärme und Licht freizusetzen. Pyrolyse ist ein thermischer Zersetzungsprozess, der Hitze nutzt, um ein Material in völliger Abwesenheit von Sauerstoff abzubauen und es in neue wertvolle Substanzen umzuwandeln, anstatt es einfach zu verbrennen.
Die grundlegende Unterscheidung liegt im Zweck. Verbrennung ist ein Oxidationsprozess, der darauf abzielt, Energie freizusetzen und minderwertige Asche und Gase zu erzeugen. Pyrolyse ist ein Zersetzungsprozess, der darauf abzielt, Material umzuwandeln und hochwertige Feststoffe (Pflanzenkohle), Flüssigkeiten (Bio-Öl) und Gase (Synthesegas) zu erzeugen.

Definition der Kernprozesse
Um die praktischen Auswirkungen zu verstehen, müssen wir zunächst die Bedingungen und Ergebnisse jedes Prozesses klar definieren.
Was ist Verbrennung (Combustion)?
Verbrennung ist eine Hochtemperaturreaktion zwischen einer Brennstoffquelle und einem Oxidationsmittel, fast immer atmosphärischem Sauerstoff.
Es ist ein exothermer Prozess, was bedeutet, dass er mehr Energie freisetzt, als er verbraucht, was wir als Flamme wahrnehmen.
Die primären Produkte sind typischerweise Kohlendioxid (CO2), Wasserdampf und ein fester Rückstand, bekannt als Asche.
Was ist Pyrolyse?
Pyrolyse ist der thermische Abbau eines Materials bei hohen Temperaturen in einer inerten oder sauerstofffreien Umgebung.
Da kein Sauerstoff vorhanden ist, mit dem es reagieren könnte, verbrennt das Material nicht. Stattdessen zerfallen seine komplexen Moleküle in kleinere, oft wertvollere Moleküle.
Dieser Prozess ist hauptsächlich endotherm und erfordert eine konstante externe Wärmequelle. Seine Produkte – Pflanzenkohle (fest), Bio-Öl (flüssig) und Synthesegas (gasförmig) – behalten einen hohen Energiegehalt bei.
Wie sich die Pyrolyse von verwandten Prozessen unterscheidet
Der Begriff „Pyrolyse“ ist spezifisch und wird oft mit anderen thermischen Behandlungen verwechselt. Die Klärung dieser Unterschiede ist entscheidend für das Verständnis ihrer einzigartigen Rolle.
Pyrolyse vs. Vergasung
Bei der Vergasung wird ein Material mit einer sehr begrenzten und kontrollierten Menge an Sauerstoff erhitzt – nicht genug für eine vollständige Verbrennung.
Sie wird typischerweise bei höheren Temperaturen als die Pyrolyse (>700°C) durchgeführt, mit dem Hauptziel, die Produktion von Synthesegas (Syngas), einer Mischung aus Wasserstoff und Kohlenmonoxid, zu maximieren.
Pyrolyse vs. Cracking (Spaltung)
Cracking ist ein allgemeinerer Begriff, der in der Erdölindustrie üblich ist, für den Abbau großer Kohlenwasserstoffmoleküle in kleinere, nützlichere Moleküle mithilfe von Hitze und oft Druck.
Die Pyrolyse kann als eine spezielle Art des thermischen Crackens betrachtet werden, wird aber meist auf Biomasse, Kunststoffe oder andere Abfallmaterialien angewendet, während „Cracking“ eher mit der Raffination von Rohöl in Verbindung gebracht wird.
Die Abwägungen und der Zweck verstehen
Die Wahl zwischen Verbrennung und Pyrolyse wird ausschließlich durch das gewünschte Ergebnis bestimmt. Ein Prozess zerstört Material für seine Energie, während der andere es in neue Rohstoffe umwandelt.
Das Ziel der Verbrennung: Sofortige Energiefreisetzung
Der einzige Zweck der Verbrennung ist es, die in einem Material gespeicherte chemische Energie so schnell und vollständig wie möglich in Form von Wärme zu gewinnen.
Diese Wärme kann direkt für industrielle Prozesse oder zur Stromerzeugung genutzt werden. Die entstehende Asche und die Rauchgase werden im Allgemeinen als Abfallprodukte betrachtet.
Das Ziel der Pyrolyse: Materialumwandlung
Der Zweck der Pyrolyse besteht darin, wertvolle neue Produkte aus einem minderwertigen Ausgangsmaterial wie Biomasse oder Kunststoffabfällen herzustellen.
Anstatt als Wärme freigesetzt zu werden, bleiben die Energie und die chemische Struktur des ursprünglichen Materials in der Pflanzenkohle, dem Bio-Öl und dem Synthesegas erhalten. Jedes dieser Produkte kann weiter raffiniert, als Brennstoff verwendet oder als chemischer Baustein dienen.
Die Umweltgleichung
Die Verbrennung setzt Kohlenstoff direkt als CO2 in die Atmosphäre frei.
Die Pyrolyse bietet einen anderen Weg. Sie kann Kohlenstoff in der stabilen, festen Form der Pflanzenkohle binden, die zur Bodenverbesserung oder für andere Anwendungen genutzt werden kann, wodurch er effektiv abgeschieden wird. Dies macht sie zu einer Schlüsseltechnologie in Strategien der Kreislaufwirtschaft und Kohlenstoffabscheidung.
Die richtige Wahl für Ihr Ziel treffen
Die Auswahl des richtigen thermischen Prozesses hängt vollständig davon ab, was Sie mit dem Ausgangsmaterial erreichen möchten.
- Wenn Ihr Hauptaugenmerk auf der sofortigen Wärme- oder Stromerzeugung vor Ort liegt: Die Verbrennung ist die direkteste und etablierteste Methode zur Energiefreisetzung.
- Wenn Ihr Hauptaugenmerk auf der Herstellung von Mehrwertprodukten aus Abfall oder Biomasse liegt: Die Pyrolyse ist die überlegene Wahl, um Ausgangsmaterialien in lagerfähige, transportable und wertvolle neue Materialien umzuwandeln.
- Wenn Ihr Hauptaugenmerk auf der Herstellung eines gasförmigen Brennstoffs für Spezialmotoren oder chemische Synthesen liegt: Die Vergasung ist der optimierte Prozess zur Maximierung der Synthesegasausbeute.
Letztendlich geht es bei der Wahl des richtigen thermischen Prozesses darum, zu entscheiden, ob Sie die Energie eines Materials sofort freisetzen oder seine Struktur in neue Wertformen für die Zukunft umwandeln möchten.
Zusammenfassungstabelle:
| Merkmal | Verbrennung (Combustion) | Pyrolyse |
|---|---|---|
| Sauerstoffpräsenz | Erfordert Sauerstoff | Abwesenheit von Sauerstoff |
| Hauptziel | Energie als Wärme freisetzen | Material in neue Produkte umwandeln |
| Prozesstyp | Exotherm (setzt Wärme frei) | Endotherm (erfordert Wärmezufuhr) |
| Hauptprodukte | Wärme, CO₂, Wasserdampf, Asche | Pflanzenkohle (fest), Bio-Öl (flüssig), Synthesegas |
Bereit, Ihre Abfallmaterialien in wertvolle Ressourcen umzuwandeln?
KINTEK ist spezialisiert auf fortschrittliche Laborausrüstung für thermische Prozesse wie die Pyrolyse. Egal, ob Sie die Biomasseumwandlung erforschen, neue Materialien aus Kunststoffabfällen entwickeln oder die Fähigkeiten Ihres Labors optimieren möchten – unsere Lösungen sind auf Präzision, Effizienz und Zuverlässigkeit ausgelegt.
Wir helfen unseren Kunden:
- Abfall in Wert umwandeln: Hochwertige Pflanzenkohle, Bio-Öl und Synthesegas produzieren.
- Forschung vorantreiben: Mit präzisen, kontrollierten Pyrolysesystemen.
- Nachhaltigkeit verbessern: Kreislaufwirtschafts- und Kohlenstoffabscheidungsstrategien im Labor umsetzen.
Lassen Sie uns besprechen, wie unsere Pyrolysegeräte Ihre spezifischen Laboranforderungen erfüllen können. Kontaktieren Sie KINTLAB noch heute für eine Beratung!
Visuelle Anleitung
Ähnliche Produkte
- Vakuumversiegelter kontinuierlich arbeitender Drehtiegelofen Rotierender Röhrenofen
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
- Vertikaler Labortiegelofen
- Hochtemperatur-Muffelofen für Laborentbinderung und Vorsintern
- Labor-Schnelltemperatur-Prozess (RTP) Quarzrohr-Ofen
Andere fragen auch
- Warum sind beim Sintern von Edelstählen hohe Temperaturen erforderlich? Erzielen Sie reine, hochdichte Ergebnisse
- Was ist der Temperaturbereich der Pyrolyse? Beherrschung der Temperaturregelung für optimale Bio-Produktausbeuten
- Welche Ausrüstungsanforderungen gibt es für das Beladen von Platin (Pt) auf Verbundträger? Präzises Rühren für hohe Dispersion
- Wie wird ein Hochtemperatur-Kalzinierungsofen in der BZY20-Sol-Gel-Methode verwendet? Erzielung reiner kubischer Perowskitphasen
- Wie steuern Hochtemperatur-Reaktionsöfen In-situ-MMCs? Beherrschung von Materialpräzision und struktureller Integrität



















