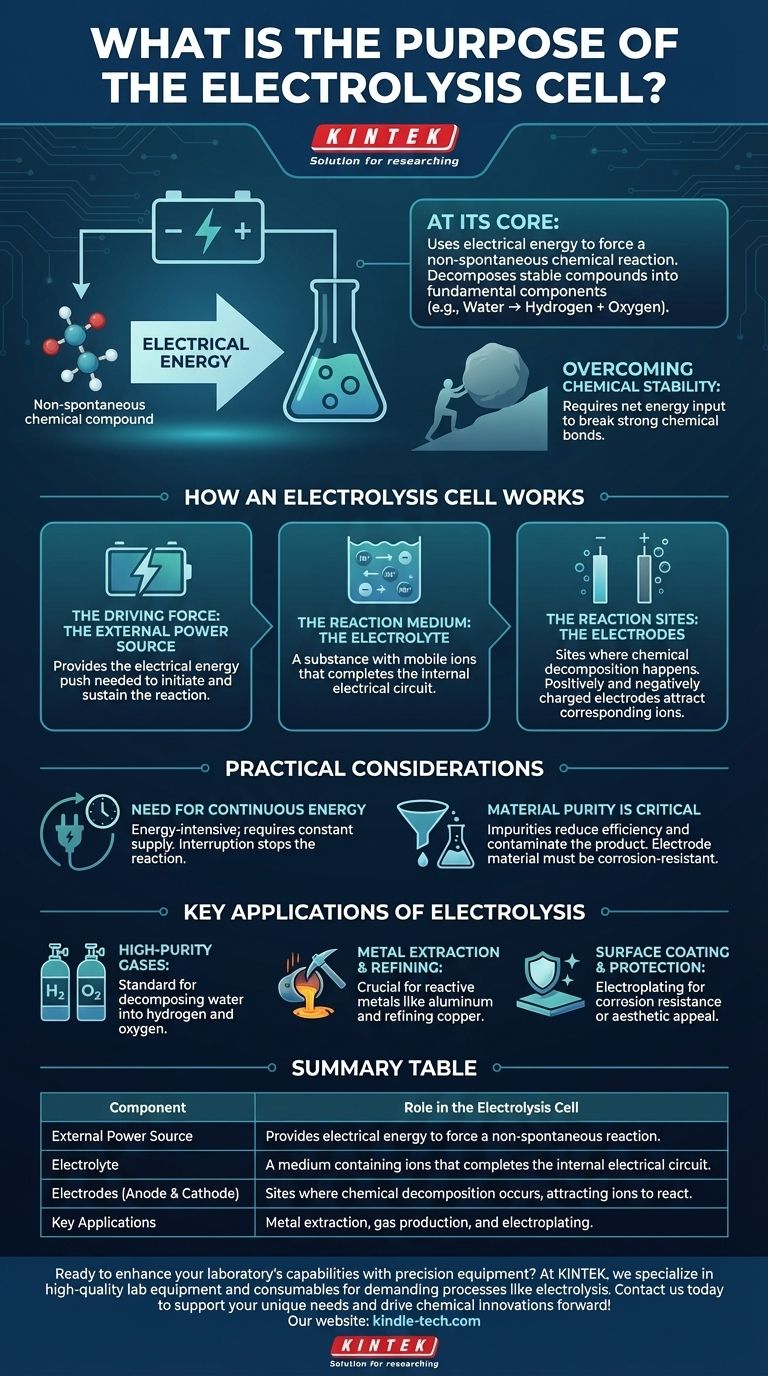
Im Kern besteht der Zweck einer Elektrolysezelle darin, elektrische Energie zu nutzen, um eine chemische Reaktion zu erzwingen, die von selbst nicht ablaufen würde. Dieser als Elektrolyse bekannte Prozess ermöglicht es uns, stabile chemische Verbindungen in ihre grundlegenderen Bestandteile zu zerlegen, wie z. B. die Zersetzung von Wasser in Wasserstoff und Sauerstoff.
Während viele chemische Reaktionen Energie freisetzen, erfordern einige der wichtigsten industriellen Prozesse einen Energieeintrag, um abzulaufen. Die Elektrolysezelle ist das grundlegende Werkzeug, das entwickelt wurde, um diese Energie bereitzustellen, indem Elektrizität genutzt wird, um nicht-spontane Reaktionen anzutreiben und wertvolle chemische Produkte zu erzeugen.

Wie eine Elektrolysezelle funktioniert
Eine Elektrolysezelle ist ein System mit drei kritischen Komponenten, die zusammenarbeiten, um eine spezifische chemische Umwandlung zu erreichen. Das Verständnis jedes Teils verdeutlicht den gesamten Prozess.
Die treibende Kraft: Die externe Stromquelle
Eine externe Stromquelle, wie eine Batterie, liefert die erforderliche elektrische Energie. Diese Energie wirkt als der „Stoß“, der erforderlich ist, um eine chemische Reaktion einzuleiten und aufrechtzuerhalten, die energetisch nicht begünstigt ist. Ohne diese externe Spannung würde die Zersetzung nicht stattfinden.
Das Reaktionsmedium: Der Elektrolyt
Der Elektrolyt ist das Medium, das den Fluss geladener Teilchen (Ionen) ermöglicht. Es ist nicht einfach nur eine Flüssigkeit; es ist eine Substanz, typischerweise eine Lösung gelöster Salze in Wasser oder ein geschmolzenes Salz, die mobile Ionen enthält. Diese Bewegung der Ionen zwischen den Elektroden schließt den elektrischen Stromkreis innerhalb der Zelle ab.
Die Reaktionsstätten: Die Elektroden
Zwei Elektroden (eine Anode und eine Kathode) sind in den Elektrolyten eingetaucht. Dies sind die physikalischen Orte, an denen die chemische Zersetzung tatsächlich stattfindet. Wenn die externe Stromquelle angelegt wird, wird eine Elektrode positiv und die andere negativ geladen, wodurch die entsprechenden Ionen aus dem Elektrolyten angezogen werden und sie zur Reaktion gezwungen werden.
Das grundlegende Ziel: Erzwingen einer nicht-spontanen Reaktion
Der gesamte Zweck der Zelle besteht darin, die natürliche Stabilität einer Verbindung zu überwinden. Dies ist der Hauptunterschied zwischen einer galvanischen Zelle (wie einer normalen Batterie), die Energie aus einer spontanen Reaktion freisetzt, und einer Elektrolysezelle.
Überwindung chemischer Stabilität
Eine nicht-spontane Reaktion ist eine, die einen Nettoenergieeintrag erfordert, um abzulaufen. Stellen Sie es sich wie das Schieben eines Felsbrockens einen Hügel hinauf vor – es wird nicht von selbst geschehen. Die elektrische Energie, die der Elektrolysezelle zugeführt wird, liefert die notwendige Kraft, um diesen „chemischen Felsbrocken“ den Hügel hinaufzuschieben und starke chemische Bindungen zu brechen.
Die Bedeutung der Elektrolyse
Der Name selbst erklärt die Funktion. Er leitet sich von „Elektro“ ab, was sich auf Elektrizität bezieht, und dem griechischen Wort „Lysis“, was „aufbrechen“ oder „zersetzten“ bedeutet. Die Zelle nutzt Elektrizität, um eine Verbindung aufzubrechen.
Verständnis der praktischen Aspekte
Obwohl die Elektrolyse leistungsstark ist, ist sie nicht ohne Anforderungen und Einschränkungen. Ihre Anwendung ist eine bewusste technische Entscheidung, die auf spezifischen Abwägungen beruht.
Die Notwendigkeit kontinuierlicher Energie
Die Elektrolyse ist ein energieintensiver Prozess. Sie erfordert eine konstante und oft erhebliche Stromzufuhr. Wird die Stromversorgung unterbrochen, stoppt die Reaktion sofort. Diese Energiekosten sind ein Hauptfaktor für die wirtschaftliche Tragfähigkeit der industriellen Elektrolyse.
Materialreinheit ist entscheidend
Die Reinheit des Elektrolyten ist entscheidend. Verunreinigungen können zu unerwünschten Nebenreaktionen führen, die Effizienz des Hauptprozesses verringern und das Endprodukt verunreinigen. Die Wahl des Elektrodenmaterials ist ebenfalls wichtig, da es der korrosiven Umgebung standhalten und die gewünschte Reaktion nicht stören darf.
Wichtige Anwendungen der Elektrolyse
Die richtige Anwendung hängt vollständig von Ihrem Endziel ab. Die Vielseitigkeit der Elektrolyse macht sie zu einem Eckpfeiler der modernen Chemie und Industrie.
- Wenn Ihr Hauptaugenmerk auf der Herstellung hochreiner Gase liegt: Die Elektrolyse ist die Standardmethode zur Zersetzung von Wasser (H₂O) in außergewöhnlich reinen Wasserstoff und Sauerstoff.
- Wenn Ihr Hauptaugenmerk auf der Metallgewinnung und -raffination liegt: Der Prozess ist unverzichtbar für die Herstellung hochreaktiver Metalle wie Aluminium aus seinem Erz (Bauxit) oder die Raffination von Kupfer zu hoher Reinheit.
- Wenn Ihr Hauptaugenmerk auf Oberflächenbeschichtung und -schutz liegt: Ein ähnlicher elektrolytischer Prozess, bekannt als Galvanisieren (oder Elektroplattieren), wird verwendet, um eine dünne Schicht eines Metalls (wie Chrom oder Gold) auf ein anderes aufzutragen, um Korrosionsbeständigkeit oder ästhetische Wirkung zu erzielen.
Letztendlich ist die Elektrolysezelle ein grundlegendes Werkzeug zur Umwandlung von elektrischer Energie in wertvolle chemische Veränderungen, das es uns ermöglicht, Substanzen herzustellen, die die Natur von selbst nicht erzeugen würde.
Zusammenfassungstabelle:
| Komponente | Rolle in der Elektrolysezelle |
|---|---|
| Externe Stromquelle | Liefert elektrische Energie, um eine nicht-spontane Reaktion zu erzwingen. |
| Elektrolyt | Ein Medium, das Ionen enthält und den internen elektrischen Stromkreis schließt. |
| Elektroden (Anode & Kathode) | Stätten, an denen die chemische Zersetzung stattfindet und Ionen zur Reaktion angezogen werden. |
| Hauptanwendungen | Metallgewinnung (z. B. Aluminium), Gasproduktion (z. B. Wasserstoff) und Galvanisierung. |
Bereit, die Fähigkeiten Ihres Labors mit Präzisionsgeräten zu erweitern? Bei KINTEK sind wir auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien spezialisiert, die auf anspruchsvolle Prozesse wie die Elektrolyse zugeschnitten sind. Ob Sie Metalle raffinieren, hochreine Gase herstellen oder Galvanisierungen durchführen, unsere zuverlässigen Werkzeuge gewährleisten Effizienz und Genauigkeit. Kontaktieren Sie uns noch heute, um herauszufinden, wie KINTEK die einzigartigen Bedürfnisse Ihres Labors unterstützen und Ihre chemischen Innovationen vorantreiben kann!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- Anpassbare CO2-Reduktions-Flowzelle für NRR-, ORR- und CO2RR-Forschung
- Li-Luft-Batteriegehäuse für Batterie-Laboranwendungen
Andere fragen auch
- Wie wird die elektrochemische Fragmentierung zur Erhöhung der Flüssigmetalloberfläche genutzt? Steigerung der katalytischen Effizienz
- Was ist bei der Auswahl und Verwendung einer Ionenaustauschermembran zu beachten? Ein Leitfaden für optimale elektrochemische Ergebnisse
- Welche Bedeutung hat die Verwendung einer hochpräzisen Elektrolysezelle und einer Bleikathode für die Synthese von Polyvanillin?
- Was sind die Hauptmerkmale einer doppelwandigen elektrochemischen Zelle mit Wasserbad? Erzielen Sie eine präzise Temperaturkontrolle für Ihre Experimente
- Was ist der Unterschied zwischen einer galvanischen Zelle und einer Elektrolysezelle? Beherrschung der elektrochemischen Prinzipien
- Wie sollten die Elektroden der Elektrolysezelle gewartet werden? Ein Leitfaden zur Maximierung von Leistung und Lebensdauer
- Was sind die wichtigsten Vorsichtsmaßnahmen bei der Reinigung der Elektrolysezelle? Schäden vermeiden und Sicherheit gewährleisten
- Welche vollständigen Vorbereitungsschritte sind vor der Verwendung einer Flachplatten-Korrosionselektrolysezelle zu beachten? Gewährleistung genauer und wiederholbarer Ergebnisse



















