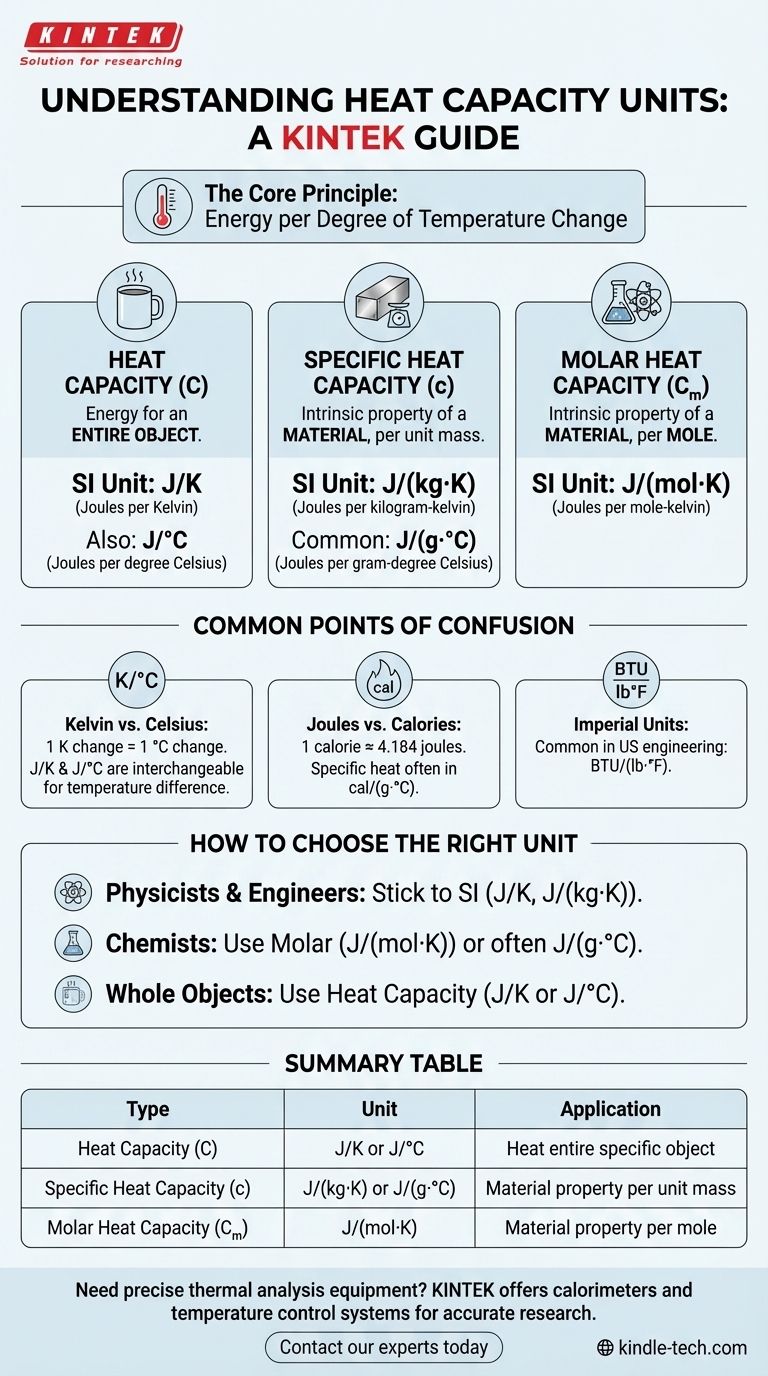
Die primäre SI-Einheit für die Wärmekapazität ist Joule pro Kelvin (J/K). Diese Einheit beschreibt die Energiemenge (in Joule), die erforderlich ist, um die Temperatur eines gesamten Objekts oder Systems um ein Kelvin zu erhöhen. Die spezifischen Einheiten, denen Sie begegnen, ändern sich jedoch, je nachdem, ob Sie ein ganzes Objekt, eine bestimmte Masse einer Substanz oder eine molare Menge messen.
Die Einheiten für die Wärmekapazität stellen immer Energie pro Grad Temperaturänderung dar. Das Verständnis des Unterschieds zwischen Wärmekapazität, spezifischer Wärmekapazität und molarer Wärmekapazität ist der Schlüssel zur Identifizierung und Verwendung der richtigen Einheit für Ihre Berechnung.

Was die Einheiten tatsächlich bedeuten
Wärmekapazität (C)
Wärmekapazität bezieht sich auf die Energie, die benötigt wird, um die Temperatur eines gesamten Objekts um ein Grad zu erhöhen. Da es sich um ein ganzes, spezifisches Objekt (wie eine Kaffeetasse oder einen Motorblock) handelt, ist seine Masse bereits berücksichtigt.
Die Einheit ist einfach Energie geteilt durch Temperatur: Joule pro Kelvin (J/K). Sie kann auch als Joule pro Grad Celsius (J/°C) ausgedrückt werden.
Spezifische Wärmekapazität (c)
Dies ist die häufigste Messgröße, der Sie begegnen werden. Die spezifische Wärme ist eine intrinsische Eigenschaft eines Materials, nicht eines Objekts. Es ist die Energie, die erforderlich ist, um die Temperatur einer Einheit Masse einer Substanz um ein Grad zu erhöhen.
Die Standard-SI-Einheit ist Joule pro Kilogramm-Kelvin (J/(kg·K)).
In der Chemie und anderen Laborbereichen ist es sehr üblich, Einheiten basierend auf Gramm und Celsius zu sehen, wie z.B. Joule pro Gramm-Grad Celsius (J/(g·°C)).
Molare Wärmekapazität (Cₘ)
Die molare Wärmekapazität ist ebenfalls eine intrinsische Eigenschaft eines Materials, wird aber pro Mol anstatt pro Masse definiert. Dies ist besonders nützlich in der Chemie, wo Reaktionen in Mol beschrieben werden.
Die Standard-SI-Einheit ist Joule pro Mol-Kelvin (J/(mol·K)).
Häufige Verwirrungspunkte
Kelvin vs. Celsius
Für Wärmekapazitätsberechnungen ist eine Änderung von einem Kelvin (1 K) genau dasselbe wie eine Änderung von einem Grad Celsius (1 °C).
Daher sind die Einheiten J/K und J/°C funktional austauschbar, wenn Sie eine Temperaturdifferenz berechnen. Dasselbe gilt für J/(kg·K) und J/(kg·°C).
Joule vs. Kalorien
Die Kalorie (cal) ist eine ältere, nicht-SI-Einheit für Energie. Sie wird immer noch in einigen Kontexten verwendet, insbesondere in der Chemie und Ernährung.
Die Umrechnung beträgt ungefähr 1 Kalorie = 4,184 Joule. Sie können die spezifische Wärme als cal/(g·°C) ausgedrückt sehen. Zum Beispiel liegt die spezifische Wärme von Wasser sehr nahe bei 1,0 cal/(g·°C).
Imperiale und US-amerikanische Einheiten
In einigen technischen Bereichen, insbesondere in den Vereinigten Staaten, können Sie auf imperiale Einheiten stoßen.
Die gebräuchlichste Einheit für die spezifische Wärme in diesem System ist die British Thermal Unit pro Pfund pro Grad Fahrenheit (BTU/(lb·°F)).
So wählen Sie die richtige Einheit für Ihre Anwendung
-
Wenn Sie Physiker oder Ingenieur sind: Halten Sie sich an die Standard-SI-Einheiten. Verwenden Sie J/K für ganze Systeme und J/(kg·K) für Materialeigenschaften.
-
Wenn Sie Chemiker sind: Die molare Wärmekapazität (J/(mol·K)) ist oft am nützlichsten für Reaktionsberechnungen, obwohl Sie häufig J/(g·°C) für Laborarbeiten verwenden werden.
-
Wenn Sie mit einem ganzen, spezifischen Objekt arbeiten: Verwenden Sie die allgemeine Wärmekapazitätseinheit, J/K oder J/°C, da die Masse des Objekts bereits berücksichtigt ist.
Das Verständnis, welche Größe gemessen wird – ein ganzes Objekt, eine Masseneinheit oder ein Mol – ist der entscheidende Leitfaden für die Wahl der richtigen Einheit.
Zusammenfassungstabelle:
| Art der Wärmekapazität | Einheit | Anwendung |
|---|---|---|
| Wärmekapazität (C) | J/K oder J/°C | Energie zum Erhitzen eines spezifischen, gesamten Objekts |
| Spezifische Wärmekapazität (c) | J/(kg·K) oder J/(g·°C) | Intrinsische Eigenschaft eines Materials (pro Masseneinheit) |
| Molare Wärmekapazität (Cₘ) | J/(mol·K) | Intrinsische Eigenschaft eines Materials (pro Mol) |
Benötigen Sie präzise Thermoanalysegeräte für Ihr Labor? Das Verständnis der Wärmekapazität ist entscheidend für Experimente in Chemie, Materialwissenschaft und Ingenieurwesen. KINTEK ist spezialisiert auf hochwertige Laborgeräte, einschließlich Kalorimeter und Temperaturkontrollsysteme, um sicherzustellen, dass Ihre Messungen genau und zuverlässig sind. Kontaktieren Sie noch heute unsere Experten, um die perfekte Lösung für die Thermoanalyseanforderungen Ihres Labors zu finden.
Visuelle Anleitung
Ähnliche Produkte
- Automatische Labor-Heißpresse
- Labor-Siebmaschinen und Vibrationssieb-Schüttelmaschinen
- Anpassbare XRD-Probenhalter für vielfältige Forschungsanwendungen
- Kundenspezifischer PTFE-Teflon-Teilehersteller für PTFE-Maschensieb F4
- Dreidimensionales elektromagnetisches Siebinstrument
Andere fragen auch
- Was ist der HIP-Prozess in der Pulvermetallurgie? Volle Dichte und überlegene Materialeigenschaften erreichen
- Wie unterscheidet sich die Pulvermetallurgie von anderen Fertigungsverfahren? Bauteile mit minimalem Abfall herstellen
- Was ist der Unterschied zwischen Sinter- und Schmelztemperatur? Die Wahl des richtigen thermischen Prozesses für Ihre Materialien
- Bei welcher Temperatur wird KBr für IR getrocknet? Der Schlüssel zu feuchtigkeitsfreien, hochwertigen Spektren
- Wie lange kann eine Beschichtung halten? Maximieren Sie die Haltbarkeit mit dem richtigen System
- Was ist das Ziel des Sinterns? Pulver in Hochleistungskomponenten umwandeln
- Welche Rolle spielt hochreiner Stickstoff in einer Supercritical-Water-Testschleife? Gewährleistung der Integrität von Testdaten
- Was ist die zweistufige Sintermethode? Hohe Dichte mit feiner Kornstruktur erreichen



















