In jedem elektrochemischen System sind die beiden kritischsten Vorsichtsmaßnahmen die Gewährleistung der korrekten Elektrodenpolarität und die Auswahl des geeigneten Elektrolyten für Ihre Reaktion. Die Polarität bestimmt, welcher chemische Prozess wo stattfindet, während der Elektrolyt das notwendige Medium für diesen Prozess bereitstellt. Ein Fehler bei beidem kann zu fehlgeschlagenen Experimenten, beschädigter Ausrüstung oder erheblichen Sicherheitsrisiken führen.
Die Polarität Ihrer Elektroden definiert die Richtung der chemischen Reaktion, und der Elektrolyt bestimmt deren Machbarkeit. Ein Missverhältnis bei einem von beiden wird den beabsichtigten elektrochemischen Prozess grundlegend verändern, hemmen oder aktiv stören.
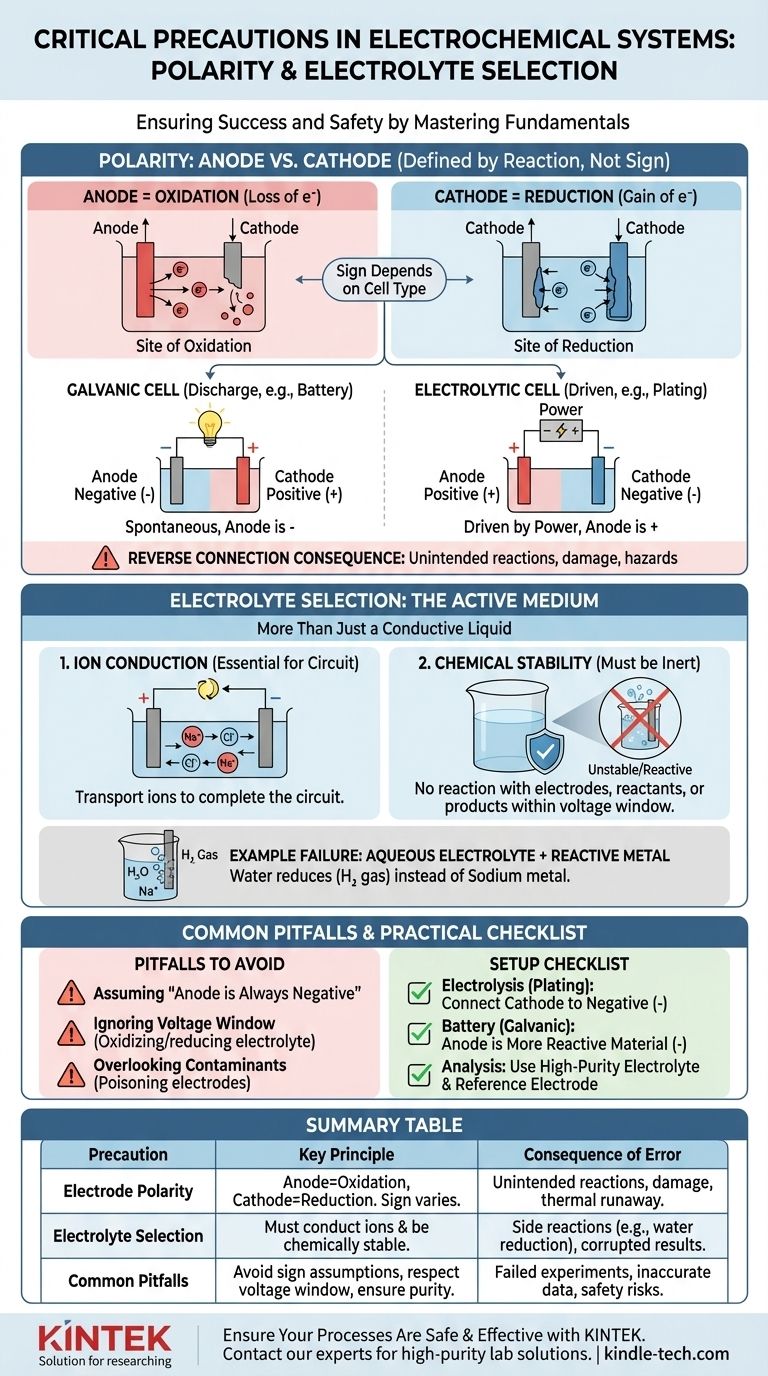
Die kritische Rolle der Polarität: Anode vs. Kathode
Die korrekte Identifizierung von Anode und Kathode ist der erste Schritt zum Aufbau einer funktionsfähigen und vorhersagbaren elektrochemischen Zelle. Dies geht über die bloße Kennzeichnung von Anschlüssen als „positiv“ oder „negativ“ hinaus.
Was „Polarität“ wirklich bedeutet
Die Begriffe Anode und Kathode werden durch den Reaktionstyp definiert, nicht durch ihre Ladung.
- Die Anode ist immer der Ort der Oxidation (Elektronenverlust).
- Die Kathode ist immer der Ort der Reduktion (Elektronenaufnahme).
Die Verwirrung entsteht, weil das Vorzeichen (+ oder -) dieser Elektroden vom Zelltyp abhängt. In einer entladenden Batterie (einer galvanischen Zelle) ist die Anode der negative Anschluss. In einer Elektrolyseanlage (einer elektrolytischen Zelle) ist die Anode mit dem positiven Anschluss der Stromversorgung verbunden.
Die Folge eines verpolten Anschlusses
Ein falscher Anschluss der Elektroden führt dazu, dass die chemischen Reaktionen umgekehrt oder auf unerwünschte Weise ablaufen.
In einer elektrolytischen Zelle (z. B. Galvanisieren) bedeutet ein verpolter Anschluss, dass Sie Material von der Elektrode, die Sie beschichten wollten, abtragen und Material auf Ihre Quellanode abscheiden, wodurch beide zerstört werden.
In einer wiederaufladbaren Batterie kann das Laden mit umgekehrter Polarität irreversible Schäden an den Elektrodenstrukturen verursachen, die zu dauerhaftem Kapazitätsverlust, internen Kurzschlüssen und potenziell gefährlichem thermischem Durchgehen führen können.
Elektrolytwahl: Mehr als nur eine leitfähige Flüssigkeit
Der Elektrolyt ist keine passive Komponente; er ist ein aktiver und kritischer Bestandteil des elektrochemischen Systems. Seine Eigenschaften bestimmen, welche Reaktionen überhaupt möglich sind.
Die primäre Funktion: Ionenleitung
Die grundlegendste Aufgabe des Elektrolyten ist der Transport von Ionen zwischen Anode und Kathode, wodurch der elektrische Kreislauf geschlossen wird. Ohne ein Medium für den Ionenfluss würde die gesamte Reaktion sofort zum Stillstand kommen.
Die kritische Funktion: Chemische Stabilität
Der Elektrolyt und sein Lösungsmittel müssen unter den Betriebsbedingungen chemisch inert sein. Sie sollten nicht mit den Elektroden, den Reaktanten oder den Produkten Ihrer primären Reaktion reagieren. Dies ist die Ursache für die in Sicherheitsprotokollen erwähnten „unerwünschten Nebenreaktionen“.
Beispiel: Warum wässrige Elektrolyte bei reaktiven Metallen versagen
Stellen Sie sich vor, Sie versuchen, Natriummetall durch Elektrolyse einer Natriumchlorid (NaCl)-Lösung in Wasser herzustellen.
Sie würden erwarten, dass Natriumionen (Na+) zur Kathode wandern, ein Elektron aufnehmen und Natriummetall bilden. Wasser (H₂O) ist jedoch ebenfalls vorhanden und viel leichter zu reduzieren als Natriumionen. Infolgedessen wird an der Kathode Wasserstoffgas produziert, und es bildet sich kein Natriummetall. Die Elektrolytwahl machte die gewünschte Reaktion unmöglich.
Verständnis der Kompromisse und häufigen Fallstricke
Das Vermeiden einfacher Fehler erfordert das Verständnis der zugrunde liegenden Prinzipien, die alle elektrochemischen Zellen steuern.
Fallstrick 1: Annahme „Anode ist negativ“
Der häufigste Fehler ist die falsche Identifizierung von Anode und Kathode. Denken Sie immer daran, sie durch die Reaktion (Oxidation/Reduktion) zu definieren, nicht durch ein festes Vorzeichen. Bestimmen Sie, ob Ihre Zelle galvanisch (spontan) oder elektrolytisch (durch externe Energie angetrieben) ist, um das korrekte Vorzeichen zuzuweisen.
Fallstrick 2: Ignorieren des Spannungsfensters des Elektrolyten
Jeder Elektrolyt hat ein Potenzialfenster der Stabilität. Wenn Sie eine Spannung anlegen, die dieses Fenster überschreitet, beginnen Sie, den Elektrolyten selbst zu oxidieren oder zu reduzieren, nicht Ihr beabsichtigtes Ziel. Dies verbraucht Energie, erzeugt Verunreinigungen und stoppt die gewünschte Reaktion.
Fallstrick 3: Übersehen von Verunreinigungen
Selbst Spuren von Verunreinigungen in einem Elektrolyten können massive Auswirkungen haben. Verunreinigungen können sich auf einer Elektrodenoberfläche ablagern, diese „vergiften“ und die beabsichtigte Reaktion verhindern, oder sie können als Katalysatoren für unerwünschte Nebenreaktionen wirken, die Ihre Ergebnisse verfälschen.
Eine praktische Checkliste für Ihr Setup
Verwenden Sie diese Richtlinien, um sicherzustellen, dass Ihr experimenteller Aufbau von Anfang an korrekt ist.
- Wenn Ihr Hauptaugenmerk auf der Elektrolyse liegt (z. B. Beschichten, Raffinieren): Verbinden Sie die Elektrode, die Sie beschichten möchten (die Kathode), mit dem negativen Anschluss der Stromversorgung und das Ausgangsmaterial (die Anode) mit dem positiven Anschluss.
- Wenn Ihr Hauptaugenmerk auf dem Bau einer Batterie liegt (einer galvanischen Zelle): Das chemisch reaktivere Material, das oxidiert wird, ist Ihre Anode (negativer Anschluss), und das weniger reaktive Material ist Ihre Kathode (positiver Anschluss).
- Wenn Ihr Hauptaugenmerk auf einer genauen elektrochemischen Analyse liegt: Verwenden Sie einen hochreinen, oft entgasten Elektrolyten, um Nebenreaktionen zu verhindern, und bestätigen Sie Ihre Polaritätseinstellung relativ zu einem bekannten Standard oder einer Referenzelektrode.
Indem Sie Polarität und Elektrolytwahl als grundlegende Designparameter behandeln, gehen Sie über das bloße Befolgen von Anweisungen hinaus und gestalten Ihr gewünschtes elektrochemisches Ergebnis wirklich.

Zusammenfassungstabelle:
| Vorsichtsmaßnahme | Schlüsselprinzip | Folge eines Fehlers |
|---|---|---|
| Elektrodenpolarität | Anode = Ort der Oxidation; Kathode = Ort der Reduktion. Das Vorzeichen hängt vom Zelltyp ab (galvanisch vs. elektrolytisch). | Verpolung führt zu unbeabsichtigten Reaktionen (z. B. Abtragen statt Beschichten), Geräteschäden oder thermischem Durchgehen. |
| Elektrolytwahl | Muss Ionen leiten und unter Betriebsbedingungen chemisch stabil bleiben (Spannungsfenster). | Falscher Elektrolyt ermöglicht Nebenreaktionen (z. B. Wasserreduktion statt Natriumabscheidung), verfälscht Ergebnisse und verschwendet Energie. |
| Häufige Fallstricke | Annahme „Anode ist immer negativ“; Ignorieren des Elektrolyt-Spannungsfensters; Übersehen von Verunreinigungen. | Fehlgeschlagene Experimente, ungenaue Daten und Sicherheitsrisiken aufgrund unbeabsichtigter chemischer Prozesse. |
Sorgen Sie mit KINTEK für sichere und effektive elektrochemische Prozesse
Richten Sie ein Elektrolyse-, Beschichtungs- oder Batterieentwicklungsprojekt ein? Die richtige Elektrodenpolarität und Elektrolytwahl sind unerlässlich, um genaue Ergebnisse zu erzielen und die Sicherheit zu gewährleisten. Bei KINTEK sind wir darauf spezialisiert, hochreine Laborausrüstung und Verbrauchsmaterialien – einschließlich elektrochemischer Zellen, reiner Elektrolyte und zuverlässiger Stromversorgungen – für die einzigartigen Anforderungen Ihres Labors bereitzustellen.
Lassen Sie uns Ihnen helfen, kostspielige Fehler und Gefahren zu vermeiden. Kontaktieren Sie noch heute unsere Experten, um Ihre spezifische Anwendung zu besprechen und herauszufinden, wie die Lösungen von KINTEK Ihren elektrochemischen Arbeitsablauf verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Goldplattierte Elektrode
- Kupfersulfat-Referenzelektrode für Laboranwendungen
- Platin-Hilfselektrode für Laboranwendungen
- Nickel-Aluminium-Tabs für Lithium-Soft-Pack-Batterien
Andere fragen auch
- Was sind die Spezifikationen der Platin-Titan-Funktionselektrode? Maximale elektrochemische Leistung
- Was ist die Anwendung der RRDE? Quantitative Katalysator- und Reaktionserkenntnisse freischalten
- Was sind die Leistungsmerkmale von Platindraht-/Stabelektroden? Unübertroffene Stabilität für Ihr Labor
- Was ist die Rotierende Ring-Scheibenelektroden-Methode? Echtzeit-Reaktionsanalyse freischalten
- Was ist der Unterschied zwischen einer Ring-Scheiben-Elektrode und einer rotierenden Scheibenelektrode? Erschließen Sie tiefere elektrochemische Erkenntnisse



















