In technischen Begriffen ist eine Elektrolysezelle ein spezifischer Typ einer elektrochemischen Zelle. Obwohl sie unter diese breite Kategorie fällt, ist es entscheidend zu verstehen, dass "elektrochemische Zelle" auch ein anderes Gerät beschreibt – die galvanische Zelle –, die die genau entgegengesetzte Funktion ausführt.
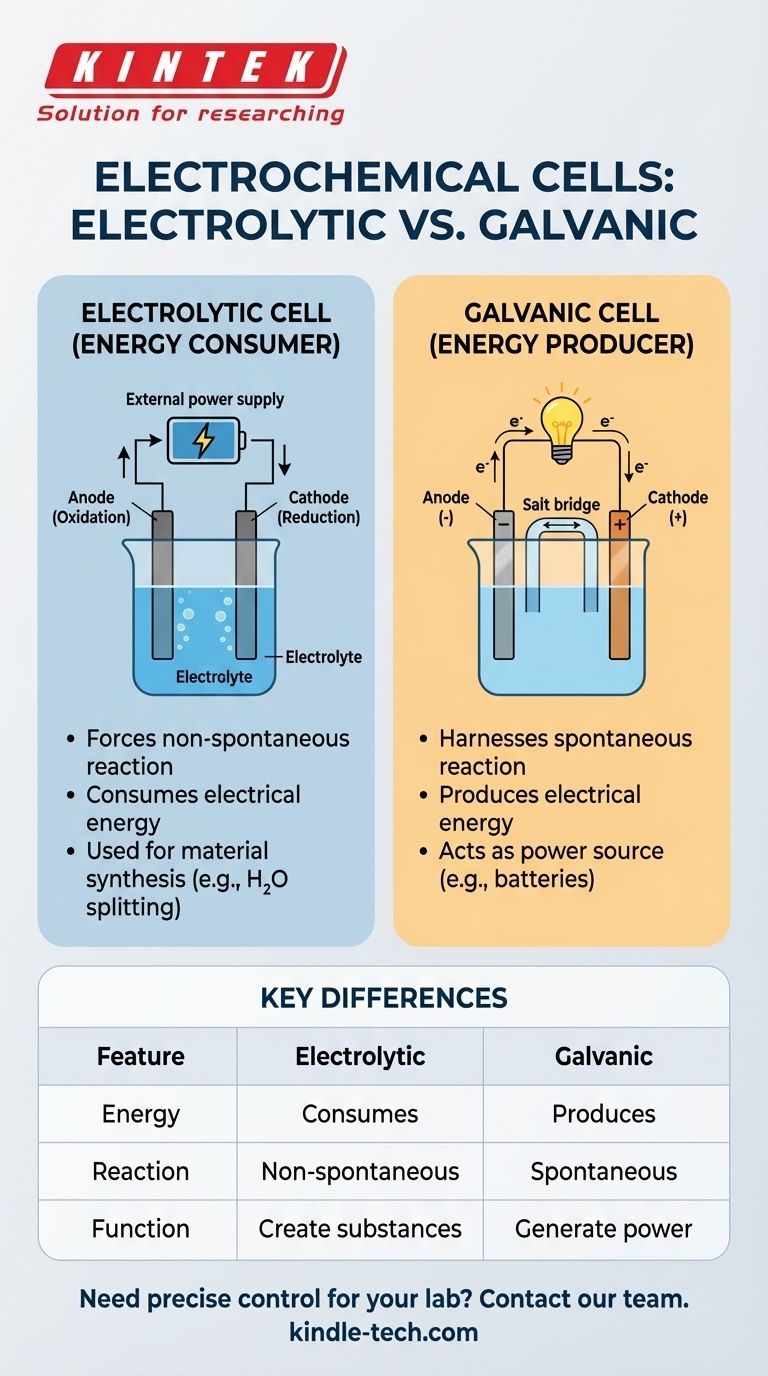
Der entscheidende Unterschied ist dieser: Eine Elektrolysezelle nutzt externe elektrische Energie, um eine chemische Reaktion zu erzwingen, die nicht von selbst ablaufen würde. Sie verbraucht Strom. Im Gegensatz dazu nutzt eine galvanische Zelle (wie eine Batterie) eine spontane chemische Reaktion, um elektrische Energie zu erzeugen.

Die Kernfunktion: Eine chemische Reaktion erzwingen
Was ist Elektrolyse?
Elektrolyse ist der Prozess, bei dem ein Gleichstrom (DC) verwendet wird, um eine ansonsten nicht-spontane chemische Reaktion anzutreiben. Einfach ausgedrückt, wird Elektrizität genutzt, um eine chemische Veränderung herbeizuführen.
Das Gerät, in dem dieser Prozess stattfindet, ist die Elektrolysezelle oder elektrolytische Zelle.
Die Rolle externer Energie
Das definierende Merkmal einer elektrolytischen Zelle ist ihr Bedarf an einer externen Stromquelle, wie einer Batterie oder einem Netzteil. Diese externe Spannung überwindet die natürliche Energiebarriere der Reaktion und zwingt die Chemikalien zur Reaktion.
Schlüsselkomponenten
Eine elektrolytische Zelle besteht aus zwei Elektroden, einer Anode und einer Kathode, die in einer flüssigen Lösung, einem sogenannten Elektrolyten, eingetaucht sind. Die externe Stromquelle zieht Elektronen von der Anode (Oxidation) und drückt sie zur Kathode (Reduktion), wodurch die gewünschte chemische Veränderung angetrieben wird.
Elektrolytisch vs. Galvanisch: Der "Elektrochemische Zelle"-Oberbegriff
Der Begriff elektrochemische Zelle ist eine übergeordnete Kategorie für jedes Gerät, das zwischen chemischer und elektrischer Energie umwandelt. Das Verständnis der beiden Haupttypen ist für die Klarheit unerlässlich.
Elektrolytische Zellen: Energieverbraucher
Diese Zellen verbrauchen elektrische Energie, um eine chemische Veränderung zu erzeugen. Ihr Hauptzweck ist es, Substanzen zu erzeugen oder Materialien durch eine erzwungene Reaktion zu verändern.
Ein gängiges Beispiel ist die Verwendung einer elektrolytischen Zelle zur Spaltung von Wasser (H₂O) in Wasserstoff- und Sauerstoffgas, ein Prozess, der einen erheblichen Energieeintrag erfordert.
Galvanische (Voltaische) Zellen: Energieerzeuger
Diese Zellen tun das Gegenteil. Sie nutzen eine spontane chemische Reaktion, um einen elektrischen Strom zu erzeugen. Dies ist das Grundprinzip aller gängigen Batterien.
Wenn Sie eine Batterie verwenden, nutzen Sie eine galvanische Zelle, um gespeicherte chemische Energie in nutzbare elektrische Energie umzuwandeln.
Warum die Unterscheidung wichtig ist
Eine elektrolytische Zelle als "elektrochemische Zelle" zu bezeichnen, ist technisch korrekt, aber unpräzise. Es ist, als würde man ein Quadrat als "Rechteck" bezeichnen. Obwohl wahr, lässt es die spezifischen Eigenschaften außer Acht, die es definieren. Der Hauptunterschied liegt immer in der Richtung der Energieumwandlung.
Gängige Anwendungen und Kompromisse
Wo Elektrolyse eingesetzt wird
Die Fähigkeit, chemische Reaktionen zu erzwingen, hat einen immensen industriellen Wert. Elektrolysezellen sind unerlässlich für die Herstellung von reinem Wasserstoff als Brennstoff, die Raffination von Metallen wie Aluminium und Kupfer aus Erzen und die Galvanisierung von Objekten mit einer dünnen Metallschicht wie Chrom oder Gold.
Der primäre Kompromiss: Energiekosten
Die Hauptbeschränkung der Elektrolyse ist ihr hoher Energieverbrauch. Da eine nicht-spontane Reaktion erzwungen wird, erfordert der Prozess immer mehr Energie als die chemische Energie, die gespeichert wird, oder der Wert des erzeugten Produkts. Diese Energiekosten sind die zentrale wirtschaftliche und ökologische Überlegung für jeden industriellen Elektrolyseprozess.
So finden Sie die richtige Zelle für Ihr Ziel
- Wenn Ihr Hauptaugenmerk auf der Energiespeicherung oder der Herstellung von Materialien (wie Wasserstoffbrennstoff oder reinem Aluminium) liegt: Sie haben es mit einer elektrolytischen Zelle zu tun, die Elektrizität verbraucht, um eine chemische Reaktion anzutreiben.
- Wenn Ihr Hauptaugenmerk auf der Stromerzeugung aus einer chemischen Quelle (wie einer Batterie) liegt: Sie haben es mit einer galvanischen (oder voltaischen) Zelle zu tun, die aus einer spontanen Reaktion Elektrizität erzeugt.
- Wenn Ihr Hauptaugenmerk auf dem allgemeinen wissenschaftlichen Bereich liegt, der beide Prozesse abdeckt: Sie sollten den Oberbegriff elektrochemische Zelle verwenden.
Letztendlich ist das Verständnis der Richtung des Energieflusses – ob er verbraucht oder erzeugt wird – der Schlüssel zur Unterscheidung zwischen diesen grundlegenden Geräten.
Zusammenfassungstabelle:
| Merkmal | Elektrolytische Zelle | Galvanische Zelle |
|---|---|---|
| Energieumwandlung | Verbraucht elektrische Energie | Erzeugt elektrische Energie |
| Reaktionstyp | Nicht-spontan (erzwungen) | Spontan |
| Primäre Funktion | Stoffe erzeugen (z.B. H₂, raffinierte Metalle) | Strom erzeugen (z.B. Batterien) |
| Stromquelle | Benötigt externe Quelle (z.B. Batterie, Netzteil) | Ist selbst die Stromquelle |
Benötigen Sie präzise Kontrolle über chemische Reaktionen in Ihrem Labor?
Ob Ihre Forschung die Materialsynthese, Galvanisierung oder Energiespeicherung umfasst, die richtige Ausrüstung ist entscheidend. KINTEK ist spezialisiert auf hochwertige Laborausrüstung und Verbrauchsmaterialien, einschließlich elektrochemischer Zellen und Netzteile, die für Zuverlässigkeit und Genauigkeit ausgelegt sind.
Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Einrichtung für Ihre spezifische Anwendung helfen. Kontaktieren Sie noch heute unser Team, um Ihre Laboranforderungen zu besprechen und zu erfahren, wie KINTEK Ihre Forschungsziele unterstützen kann.
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- Doppelte Wasserbad-Elektrolysezelle
- Anpassbare PEM-Elektrolysezellen für vielfältige Forschungsanwendungen
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
Andere fragen auch
- Was ist die richtige Methode zur Reinigung der Oberfläche einer Elektrolysezelle, die vollständig aus PTFE besteht? Sorgen Sie mit einer makellosen Oberfläche für genaue Ergebnisse
- Was sind die Hauptfunktionen einer Drei-Elektroden-Elektrolysezelle? Präzise Korrosionsprüfung für 20Cr-25Ni-Nb-Stahl
- Wie beeinflussen die Elektrolysezelle und ihr unterstützendes Elektroden system die Leistung von Titandioxid-Nanoröhren-Arrays?
- Welche Arten von Elektroden werden im All-PTFE-Elektrolysezellensystem verwendet? Optimieren Sie Ihre elektrochemische Analyse
- Wie sollten die Produkte und die flüssigen Abfälle nach einem Experiment gehandhabt werden? Gewährleistung von Laborsicherheit und Compliance
- Wie beeinflusst die Stromdichte MgO-Nanostrukturen? Steuerung der Mikromorphologie bei der elektrochemischen Synthese
- Wie sind die Nachgebrauchsverfahren für eine Fünf-Port-Wasserbad-Elektrolysezelle? Sicherheit & Langlebigkeit gewährleisten
- Welche Parameter müssen in einer Elektrolysezelle aus reinem PTFE streng kontrolliert werden? Präzision und Sicherheit gewährleisten



















