Ein gängiges Beispiel für eine Elektrode ist das Zinkgehäuse einer Alkali-Batterie oder die Kupferoberseite einer 9-Volt-Batterie. Diese Materialien fungieren als elektrische Leiter, die Kontakt mit der nichtmetallischen chemischen Paste (dem Elektrolyten) im Inneren der Batterie herstellen und so den Fluss eines elektrischen Stroms ermöglichen, der Ihr Gerät mit Strom versorgt.
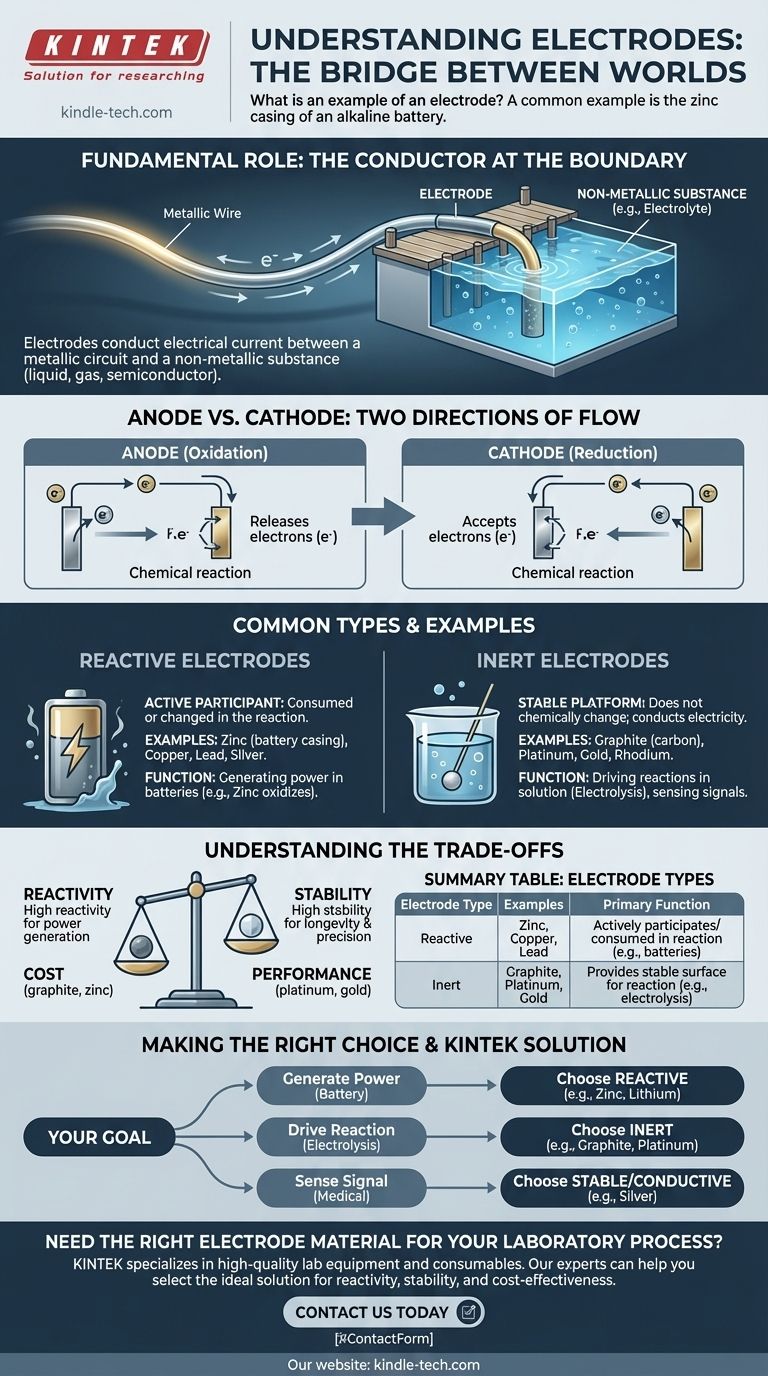
Eine Elektrode ist im Grunde eine Brücke. Ihre Aufgabe ist es, den elektrischen Strom zwischen einem normalen Metallkabel und einer nichtmetallischen Substanz, wie einer Flüssigkeit, einem Gas oder einem Halbleiter, zu leiten und so eine Vielzahl chemischer und elektronischer Prozesse zu ermöglichen.

Was ist die grundlegende Rolle einer Elektrode?
Eine Elektrode dient als entscheidender Kontaktpunkt, an dem ein elektrischer Schaltkreis auf eine nichtmetallische Komponente trifft. Ohne diese Brücke wären viele Technologien unmöglich.
Der Leiter an der Grenze
Stellen Sie sich eine Elektrode als einen Kai für Elektrizität vor. Ein Draht ist wie eine Straße, die Elektrizität an den Rand eines Sees (der nichtmetallischen Substanz, wie einem Elektrolyten) bringt. Die Elektrode ist der Kai, der es der Elektrizität ermöglicht, in das Wasser ein- oder auszutreten.
Dieser nichtmetallische Teil kann ein flüssiger Elektrolyt in einer Batterie, ein Halbleiter in einer Diode oder sogar der menschliche Körper in einem medizinischen Gerät sein.
Anode vs. Kathode: Die beiden Flussrichtungen
In elektrochemischen Systemen wie Batterien erhalten Elektroden spezifische Namen, die auf der Richtung der Reaktion basieren.
- Eine Anode ist die Elektrode, an der die Oxidation stattfindet, was bedeutet, dass sie Elektronen in den Stromkreis abgibt.
- Eine Kathode ist die Elektrode, an der die Reduktion stattfindet, was bedeutet, dass sie Elektronen aus dem Stromkreis aufnimmt.
Gängige Typen und Beispiele
Elektroden sind nicht alle gleich; ihr Material wird danach ausgewählt, ob sie an einer Reaktion teilnehmen oder diese nur beobachten sollen.
Reaktive Elektroden
Eine reaktive Elektrode ist ein aktiver Teilnehmer an einer chemischen Reaktion. Sie wird während des Prozesses verbraucht oder verändert.
Das Zinkgehäuse einer Batterie ist ein perfektes Beispiel. Wenn sich die Batterie entlädt, oxidiert das Zinkmetall und löst sich langsam im Elektrolyten auf, wodurch die Elektronen freigesetzt werden, die Ihr Gerät mit Strom versorgen. Andere gängige reaktive Elektroden sind Kupfer, Blei und Silber.
Inerte Elektroden
Eine inerte Elektrode dient als stabile, nicht teilnehmende Plattform, auf der eine Reaktion stattfinden kann. Sie leitet Elektrizität, verändert sich aber nicht chemisch selbst.
Graphit (eine Form von Kohlenstoff) ist eine weit verbreitete inerte Elektrode, da es ein ausgezeichneter Leiter und relativ kostengünstig ist. Platin, Gold und Rhodium werden ebenfalls wegen ihrer extremen Reaktionsbeständigkeit verwendet, sind aber wesentlich teurer.
Die Abwägungen verstehen
Die Wahl des Elektrodenmaterials ist eine kritische technische Entscheidung, die auf der beabsichtigten Funktion und Umgebung beruht.
Reaktivität vs. Stabilität
Der Hauptkompromiss liegt zwischen Reaktivität und Stabilität. Für eine Einwegbatterie möchten Sie eine reaktive Elektrode, die zur Stromerzeugung verbraucht werden kann.
Für einen Prozess wie die Elektrolyse (Verwendung von Elektrizität zur Spaltung von Wasser) benötigen Sie jedoch eine inerte Elektrode wie Platin oder Graphit. Die Verwendung einer reaktiven Elektrode wie Zink würde dazu führen, dass die Elektrode selbst mit dem Wasser reagiert, anstatt es zu spalten.
Kosten vs. Leistung
Hochinerte Metalle wie Gold und Platin bieten überlegene Leistung und Langlebigkeit, da sie Korrosion und unerwünschte Nebenreaktionen widerstehen.
Ihre hohen Kosten machen sie jedoch für viele Anwendungen ungeeignet. Graphit bietet ein gutes Gleichgewicht zwischen Inertheit und Leitfähigkeit zu einem Bruchteil des Preises und ist daher ideal für großtechnische industrielle Prozesse.
Die richtige Wahl für Ihr Ziel treffen
Indem Sie das Material und seine Anwendung beobachten, können Sie schnell den Zweck einer bestimmten Elektrode erfassen.
- Wenn Ihr Hauptaugenmerk auf der Stromerzeugung in einer Batterie liegt: Die Elektroden bestehen aus reaktiven Materialien wie Zink, Lithium oder Blei, die speziell dafür ausgewählt werden, in einer chemischen Reaktion verbraucht zu werden.
- Wenn Ihr Hauptaugenmerk auf der Durchführung einer Reaktion in einer Lösung (Elektrolyse) liegt: Die Elektroden bestehen aus inerten Materialien wie Graphit oder Platin, die Strom leiten können, ohne einzugreifen.
- Wenn Ihr Hauptaugenmerk auf der Erfassung eines elektrischen Signals liegt: Die Elektroden (wie in medizinischen Geräten) bestehen aus leitfähigen, stabilen Materialien wie Silber, die kleine Ströme von einer nichtmetallischen Quelle wie dem Körper genau übertragen können.
Letztendlich ist die Betrachtung einer Elektrode als Brücke zwischen der metallischen und der nichtmetallischen Welt der Schlüssel zum Verständnis ihrer Funktion in jedem Gerät.
Zusammenfassungstabelle:
| Elektrodentyp | Gängige Beispiele | Hauptfunktion |
|---|---|---|
| Reaktiv | Zink, Kupfer, Blei | Nimmt aktiv an einer chemischen Reaktion teil und wird dabei verbraucht (z. B. in Batterien). |
| Inert | Graphit, Platin, Gold | Bietet eine stabile Oberfläche für eine Reaktion, ohne verbraucht zu werden (z. B. bei der Elektrolyse). |
Benötigen Sie das richtige Elektrodenmaterial für Ihren Laborprozess? Die Wahl der richtigen Elektrode ist entscheidend für den Erfolg und die Effizienz Ihrer Experimente, sei es bei der Entwicklung neuer Batterietechnologien oder bei der Durchführung präziser Elektrolyse. KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich einer breiten Palette von Elektrodenmaterialien. Unsere Experten helfen Ihnen bei der Auswahl der idealen Lösung hinsichtlich Reaktivität, Stabilität und Kosteneffizienz. Kontaktieren Sie uns noch heute, um Ihre spezifischen Anforderungen zu besprechen und uns zu Ihrem Innovationspartner zu machen.
Visuelle Anleitung
Ähnliche Produkte
- Graphit-Scheiben-Stab- und Plattenelektrode Elektrochemische Graphitelektrode
- Elektrochemische Elektrode aus Glaskohlenstoff
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Metall-Scheibenelektrode Elektrochemische Elektrode
Andere fragen auch
- Welche Rolle spielt eine Platindrahtelektrode üblicherweise? Ein Leitfaden zu ihrer primären Verwendung als Arbeitselektrode
- Welche Spezifikationen sind für Gold- und Platinschichten verfügbar? Hochreine Platten für anspruchsvolle Anwendungen
- Was sind die Vorteile der Verwendung einer Platin-Mikroelektrode? Erhöhung der Empfindlichkeit in asymmetrischen EES-Systemen
- Warum werden Titanstäbe bei der Konstruktion von MEC-Elektroden verwendet? Gewährleistung hoher Leitfähigkeit und Korrosionsbeständigkeit
- Welche Verfahren sollten bei einem Experiment mit einer Titanelektrode befolgt werden?
- Welche regelmäßigen Kontrollen sollten an einem Elektrodenhalter durchgeführt werden? Ein 3-Schritte-Leitfaden für zuverlässige Messungen
- Was sind die Vorteile der Verwendung von beschichtetem Titangitter als DSA? Sicherstellung der hochreinen Vernickelung-Rhenium-Legierungselektroplattierung
- Was sind die Vorteile von Aluminiumelektroden bei der Mikroplastik-Elektokoagulation? Verbesserung der Behandlung und Haltbarkeit



















