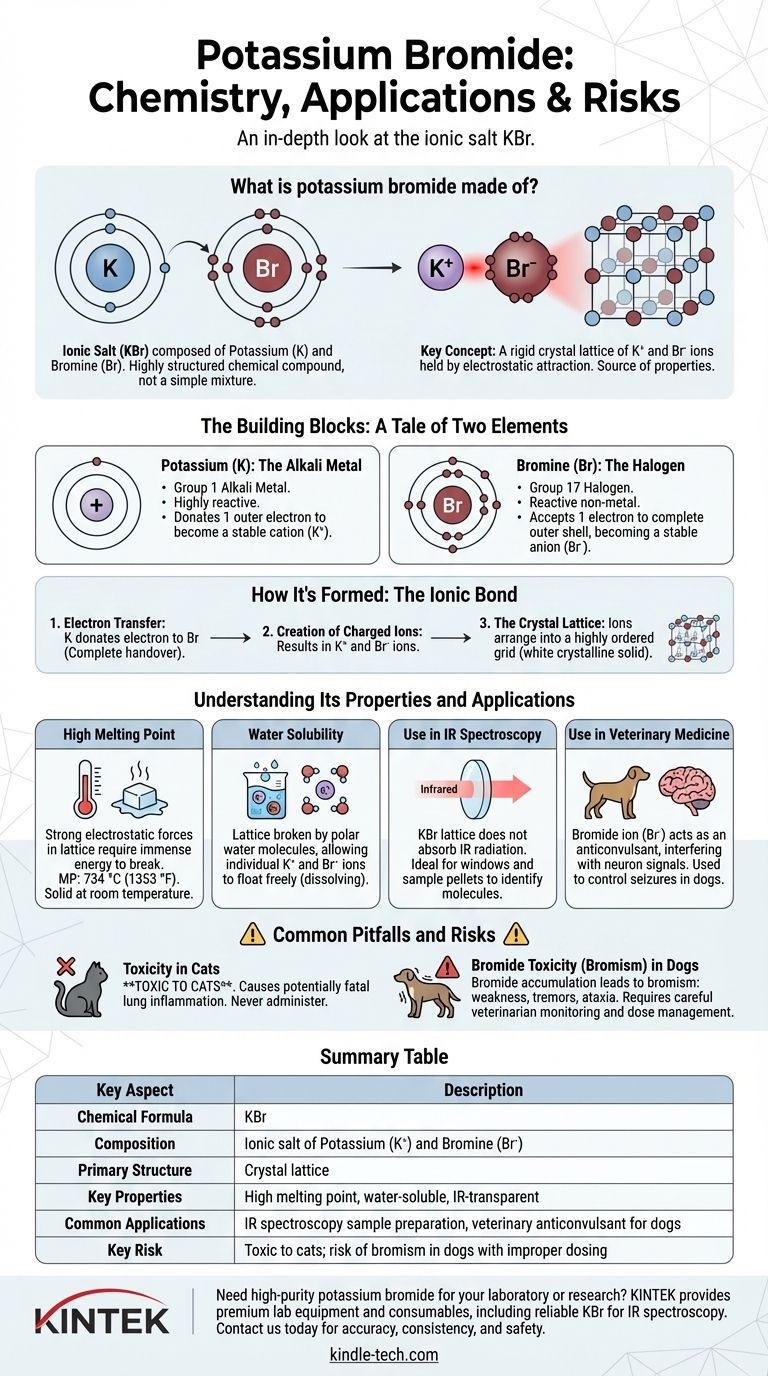
Kurz gesagt, Kaliumbromid ist ein ionisches Salz, das aus den Elementen Kalium und Brom besteht. Es ist keine einfache Mischung, sondern eine hochstrukturierte chemische Verbindung mit der Formel KBr. Das Kaliumatom gibt ein Elektron an das Bromatom ab, wodurch geladene Teilchen (Ionen) entstehen, die durch eine starke elektrostatische Anziehung zusammengehalten werden.
Der Schlüssel zum Verständnis von Kaliumbromid liegt darin, es nicht als eine Ansammlung von Atomen, sondern als ein starres Kristallgitter aus positiv geladenen Kaliumionen und negativ geladenen Bromidionen zu betrachten. Diese ionische Struktur ist die Quelle seiner wichtigsten Eigenschaften und Anwendungen.

Die Bausteine: Eine Geschichte von zwei Elementen
Die Existenz von Kaliumbromid ist ein direktes Ergebnis der grundlegenden chemischen Eigenschaften seiner beiden Bestandteile. Jedes hat ein starkes „Bestreben“, eine stabilere Elektronenkonfiguration zu erreichen.
Kalium (K): Das Alkalimetall
Kalium ist ein weiches, hochreaktives Metall, das in Gruppe 1 des Periodensystems zu finden ist. Sein definierendes Merkmal ist das Vorhandensein eines einzelnen Elektrons in seiner äußersten Schale.
Es ist energetisch weitaus stabiler, wenn es dieses einzelne Elektron abgibt. Dadurch wird es zu einem positiv geladenen Ion (K⁺).
Brom (Br): Das Halogen
Brom ist ein reaktives Nichtmetall aus Gruppe 17, den Halogenen. Sein definierendes Merkmal ist, dass es sieben Elektronen in seiner Außenschale hat, nur eines von einem vollständigen, stabilen Satz von acht entfernt.
Es nimmt bereitwillig ein Elektron auf, um diese Schale zu vervollständigen, und wird zu einem negativ geladenen Ion (Br⁻), bekannt als Bromidion.
Wie es entsteht: Die Ionenbindung
Die Bildung von Kaliumbromid ist ein klassisches Beispiel für eine Ionenbindung, die durch die Übertragung, nicht durch die gemeinsame Nutzung, von Elektronen definiert ist.
Die Elektronenübertragung
Wenn Kaliummetall und Brom reagieren, spendet jedes Kaliumatom sein einzelnes Außenelektron an ein Bromatom. Dies ist keine sanfte Teilung, sondern eine vollständige Übergabe.
Erzeugung geladener Ionen
Diese Elektronenübertragung führt zur Bildung von zwei stabilen, aber nun geladenen Teilchen: dem Kaliumkation (K⁺) und dem Bromidanion (Br⁻). Da sich entgegengesetzte Ladungen anziehen, werden sie stark zueinander hingezogen.
Das Kristallgitter
Diese positiven und negativen Ionen bilden keine einfachen Paare. Stattdessen ordnen sie sich in einem hochgeordneten, sich wiederholenden dreidimensionalen Gitter an, das als Kristallgitter bezeichnet wird. Diese starke, starre Struktur macht Kaliumbromid bei Raumtemperatur zu einem weißen, kristallinen Feststoff.
Eigenschaften und Anwendungen verstehen
Die ionische Natur von Kaliumbromid erklärt direkt sein physikalisches und chemisches Verhalten, was wiederum seine Verwendungszwecke bestimmt.
Hoher Schmelzpunkt
Die starken elektrostatischen Kräfte, die die K⁺- und Br⁻-Ionen im Kristallgitter zusammenhalten, erfordern eine enorme Energiemenge, um sie zu brechen. Deshalb ist KBr ein Feststoff mit einem hohen Schmelzpunkt von 734 °C (1353 °F).
Wasserlöslichkeit
Obwohl das Gitter stark ist, kann es durch polare Moleküle wie Wasser aufgebrochen werden. Die Wassermoleküle umgeben die einzelnen K⁺- und Br⁻-Ionen, neutralisieren ihre Ladung und ermöglichen es ihnen, sich frei zu bewegen, was wir als Auflösen des Salzes wahrnehmen.
Verwendung in der IR-Spektroskopie
Das KBr-Kristallgitter absorbiert keine Infrarotstrahlung. Diese Transparenz macht es zu einem idealen Material für die Herstellung von Fenstern und Probenpresslingen, die in der IR-Spektroskopie verwendet werden, einer Technik, die Chemikern bei der Identifizierung von Molekülen hilft.
Verwendung in der Veterinärmedizin
Das Bromidion (Br⁻) kann als Antikonvulsivum wirken, indem es den Transport von Chloridionen in den Neuronen des Zentralnervensystems stört. Aus diesem Grund wird KBr in der Veterinärmedizin zur Kontrolle von Anfällen bei Hunden eingesetzt.
Häufige Fallstricke und Risiken
Obwohl nützlich, ist Kaliumbromid nicht ohne Risiken, die für seine praktischen Anwendungen von entscheidender Bedeutung sind.
Toxizität bei Katzen
Das Hauptrisiko besteht in der veterinärmedizinischen Anwendung. Kaliumbromid ist für Katzen giftig und verursacht eine potenziell tödliche entzündliche Lungenerkrankung. Es darf ihnen niemals verabreicht werden.
Bromidtoxizität (Bromismus) bei Hunden
Selbst bei Hunden, bei denen es therapeutisch eingesetzt wird, kann sich das Bromidion im Laufe der Zeit im Körper anreichern. Wenn die Werte zu hoch werden, kann dies zu einer Erkrankung führen, die als Bromismus bezeichnet wird, mit Symptomen wie Schwäche, Zittern und Ataxie. Dies erfordert eine sorgfältige Dosisverwaltung und Überwachung durch einen Tierarzt.
Wie man dieses Wissen anwendet
Ihre Perspektive auf Kaliumbromid hängt vollständig von Ihrem Ziel ab.
- Wenn Ihr Hauptaugenmerk auf der Chemie liegt: Betrachten Sie dies als das Paradebeispiel einer Ionenbindung, die zwischen einem Alkalimetall der Gruppe 1 und einem Halogen der Gruppe 17 entsteht.
- Wenn Ihr Hauptaugenmerk auf der Laboranalyse liegt: Erkennen Sie, dass seine IR-Transparenz und die Fähigkeit, zu einem festen Pressling verpresst zu werden, die Schlüsseleigenschaften sind, die es für die Probenvorbereitung unentbehrlich machen.
- Wenn Ihr Hauptaugenmerk auf der Tiergesundheit liegt: Verstehen Sie, dass seine therapeutische Wirkung vom Bromidion herrührt, diese aber untrennbar mit dem ernsthaften Toxizitätsrisiko verbunden ist, insbesondere bei Katzen.
Letztendlich ist das Wissen, dass KBr aus Ionen besteht, die zwischen einem Metall und einem Nichtmetall übertragen werden, die Grundlage für das Verständnis seiner gesamten Verwendung und seiner Einschränkungen.
Zusammenfassungstabelle:
| Wichtiger Aspekt | Beschreibung |
|---|---|
| Chemische Formel | KBr |
| Zusammensetzung | Ionisches Salz aus Kalium (K⁺) und Brom (Br⁻) |
| Primärstruktur | Kristallgitter |
| Wichtige Eigenschaften | Hoher Schmelzpunkt, wasserlöslich, IR-transparent |
| Häufige Anwendungen | Probenvorbereitung für IR-Spektroskopie, veterinärmedizinisches Antikonvulsivum für Hunde |
| Hauptrisiko | Giftig für Katzen; Risiko des Bromismus bei Hunden bei unsachgemäßer Dosierung |
Benötigen Sie hochreines Kaliumbromid für Ihr Labor oder Ihre Forschung? KINTEK ist spezialisiert auf die Bereitstellung von erstklassigen Laborgeräten und Verbrauchsmaterialien, einschließlich zuverlässigem KBr für die IR-Spektroskopie und andere Anwendungen. Unsere Produkte gewährleisten Genauigkeit, Konsistenz und Sicherheit für Ihre Arbeit. Kontaktieren Sie uns noch heute, um zu erfahren, wie wir Ihre Laboranforderungen mit den richtigen Materialien und dem richtigen Fachwissen unterstützen können.
Visuelle Anleitung
Ähnliche Produkte
- Kundenspezifischer PTFE-Teflon-Teilehersteller für PTFE-Rührstäbchen-Rückgewinnungsstange
- Labor-Kugelmahlanlage mit Aluminiumoxid-Zirkonoxid-Mahlbehälter und Kugeln
- Assemble Square Lab Press Mold für Laboranwendungen
- Hochscherhomogenisator für pharmazeutische und kosmetische Anwendungen
- Automatische Labor-Heißpresse
Andere fragen auch
- Wie profitiert CMC von der mehrstufigen Trocknung im Laborofen? Optimierung der Reinheit und Erhaltung der chemischen Integrität
- Was ist der Unterschied zwischen einem Hochofen und einem Elektrolichtbogenofen (EAF)? Schlüsselfaktoren für die Strategie der Stahlproduktion
- Was sind die physikalischen Eigenschaften von Stickstoffgas? Ein Leitfaden zu seiner Kraft und unsichtbaren Gefahren
- Wofür wird das Sputtern (Sputter-Beschichtung) verwendet? Erzielen Sie überlegene Dünnschichten für Elektronik, Optik und Werkzeuge
- Was sind die Vor- und Nachteile von Wirbelschichtsystemen? Erschließen Sie eine überlegene Prozesseffizienz
- Wie funktioniert der Sinterprozess? Verwandlung von Pulver in dichte, hochleistungsfähige Teile
- Wofür wird Magnetron-Sputtern eingesetzt? Erstellen Sie Hochleistungs-Dünnschichten für Ihre Branche
- Was ist die Wissenschaft hinter dem Sintern? Beherrschung des thermischen Prozesses für stärkere Materialien



















