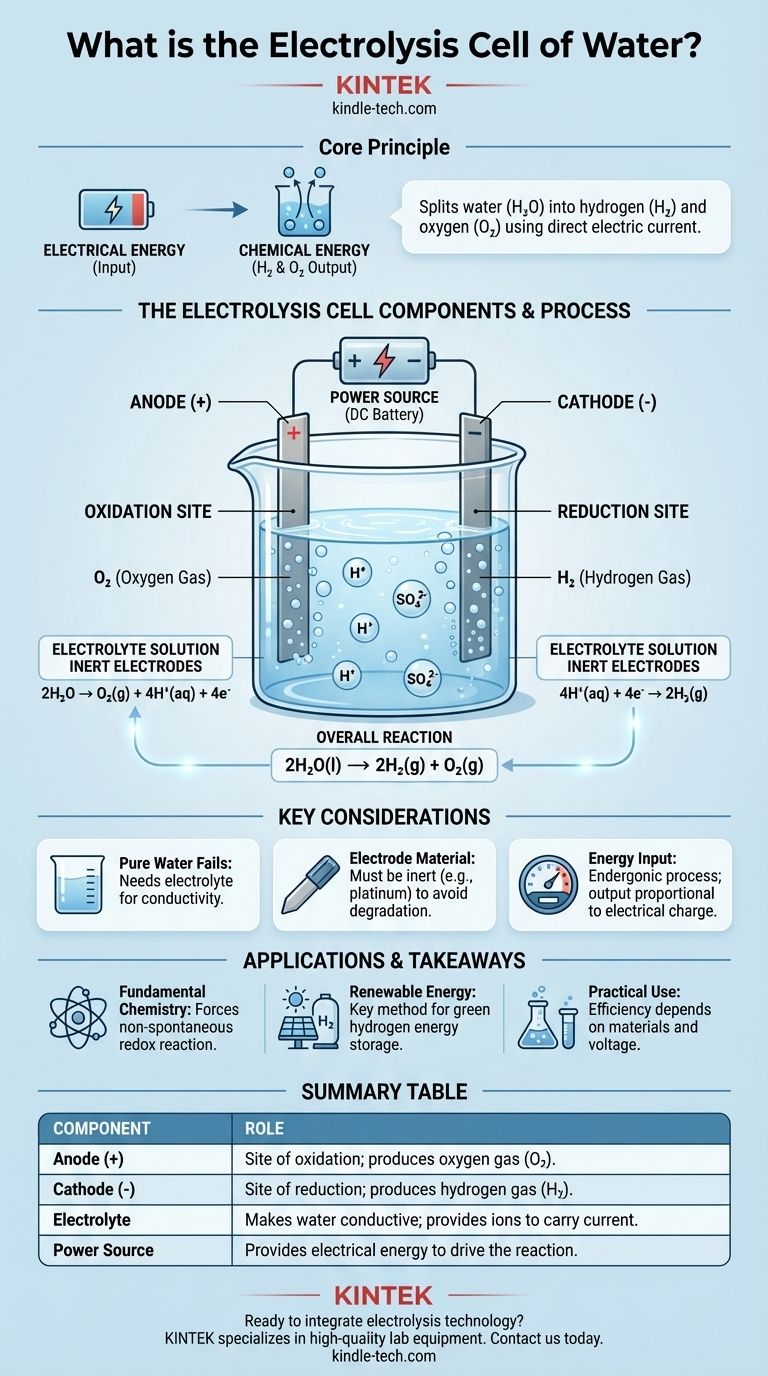
Im Kern ist eine Wasserelektrolysezelle ein Gerät, das elektrische Energie nutzt, um Wasser (H₂O) in seine Bestandteile zu zerlegen: Wasserstoffgas (H₂) und Sauerstoffgas (O₂). Dies geschieht, indem ein Gleichstrom durch Wasser geleitet wird, das eine geringe Menge eines Elektrolyten enthält, wodurch eine chemische Veränderung erzwungen wird, die nicht von selbst stattfinden würde. Die grundlegenden Komponenten sind zwei Elektroden (eine Anode und eine Kathode), die in den Elektrolyten getaucht und an eine externe Stromquelle angeschlossen sind.
Der zentrale Zweck einer Elektrolysezelle ist die Umwandlung von elektrischer Energie in chemische Energie. Sie nutzt eine externe Spannung, um eine nicht-spontane Redoxreaktion anzutreiben und speichert die eingegebene Energie effektiv in den chemischen Bindungen der resultierenden Wasserstoff- und Sauerstoffmoleküle.

Die Kernkomponenten und ihre Rollen
Eine Elektrolysezelle für Wasser arbeitet durch das präzise Zusammenspiel von drei Schlüsselkomponenten: den Elektroden, dem Elektrolyten und der Stromquelle. Jede spielt eine eigenständige und entscheidende Rolle im Prozess.
Die Elektroden: Anode und Kathode
Die Zelle enthält zwei Elektroden, die Leiter sind, durch die Elektrizität in die Lösung eintritt und sie verlässt. Diese bestehen typischerweise aus einem inerten Material, wie Platin oder Graphit, um sicherzustellen, dass sie die Reaktion erleichtern, ohne dabei selbst verbraucht zu werden.
Die Anode ist die positive Elektrode. Dies ist der Ort der Oxidation, wo Substanzen Elektronen abgeben.
Die Kathode ist die negative Elektrode. Dies ist der Ort der Reduktion, wo Substanzen Elektronen aufnehmen.
Der Elektrolyt: Wasser leitfähig machen
Reines Wasser ist ein sehr schlechter elektrischer Leiter, da es zu wenige frei bewegliche Ionen enthält, um einen Strom effektiv zu leiten.
Um dies zu beheben, wird eine geringe Menge eines Elektrolyten, wie Schwefelsäure (H₂SO₄), hinzugefügt. Der Elektrolyt löst sich im Wasser auf und liefert mobile Ionen (in diesem Fall H⁺ und SO₄²⁻), die Ladung zwischen den Elektroden transportieren und den Stromkreis schließen können.
Die Stromquelle: Die Reaktion antreiben
Die Wasserspaltung ist eine endergone Reaktion, was bedeutet, dass sie einen Energieeintrag benötigt, um stattzufinden. Wasser ist stabil und zersetzt sich nicht spontan.
Eine externe Stromquelle, wie eine Batterie oder ein Gleichstromnetzteil, liefert die notwendige Spannung. Dieser elektrische Druck „drückt“ Elektronen in die Kathode und „zieht“ sie von der Anode, wodurch die chemische Zersetzung des Wassers erzwungen wird.
Der chemische Prozess: Wie Wasser gespalten wird
Der Gesamtprozess ist eine Redoxreaktion (Reduktion-Oxidation), die in zwei unterschiedliche Halbreaktionen unterteilt ist, die an jeder Elektrode stattfinden.
Oxidation an der Anode (+)
An der positiven Anode werden Wassermoleküle oxidiert. Sie geben ihre Elektronen ab, die dann aus der Zelle in den externen Stromkreis fließen.
Diese Reaktion erzeugt Sauerstoffgas (O₂) und Wasserstoffionen (H⁺). Die Halbreaktion lautet: 2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
Reduktion an der Kathode (-)
Die an der Anode erzeugten Wasserstoffionen (H⁺) (und die aus dem sauren Elektrolyten vorhandenen) werden von der negativen Kathode angezogen.
An der Kathode nehmen diese Ionen Elektronen auf, die aus dem externen Stromkreis einfließen. Diese Reduktionsreaktion erzeugt Wasserstoffgas (H₂). Die Halbreaktion lautet: 4H⁺(aq) + 4e⁻ → 2H₂(g)
Die Gesamtreaktion
Wenn man die beiden Halbreaktionen kombiniert, heben sich die Elektronen und Wasserstoffionen auf beiden Seiten auf, wodurch das einfache und elegante Gesamtergebnis der Wasserelektrolyse sichtbar wird.
Die chemische Nettoveränderung ist: 2H₂O(l) → 2H₂(g) + O₂(g). Für je zwei gespaltene Wassermoleküle werden zwei Moleküle Wasserstoffgas und ein Molekül Sauerstoffgas produziert.
Die wichtigsten Überlegungen verstehen
Obwohl das Konzept einfach ist, sind mehrere Faktoren entscheidend für das korrekte und effiziente Funktionieren der Zelle. Das Verständnis dieser Einschränkungen offenbart die wahre Natur des Prozesses.
Warum reines Wasser versagt
Ohne einen Elektrolyten ist der Widerstand des Wassers extrem hoch. Das Anlegen einer Spannung würde zu einem vernachlässigbaren Stromfluss und somit praktisch keiner Wasserstoff- oder Sauerstoffproduktion führen. Der Elektrolyt wird nicht verbraucht; seine einzige Aufgabe ist es, als Ladungsträger zu fungieren.
Elektrodenmaterial ist entscheidend
Die Verwendung inerter Elektroden wie Platin ist unerlässlich. Würde man ein reaktives Metall wie Zink oder Kupfer für die Anode verwenden, würde die Anode selbst oxidieren und sich in der Lösung auflösen, anstatt das Wasser. Dies würde zu anderen, unbeabsichtigten Produkten führen und die Elektrode zerstören.
Energieeintrag bestimmt den Output
Elektrolyse ist keine Quelle freier Energie; sie ist ein Energieumwandlungsprozess. Die Menge des produzierten Wasserstoffs und Sauerstoffs ist direkt proportional zur Menge der durch die Zelle geleiteten elektrischen Ladung. Es erfordert eine beträchtliche Menge elektrischer Energie, um eine geringe Menge Wasserstoffgas zu produzieren.
Die richtige Wahl für Ihr Ziel treffen
Das Verständnis der Elektrolysezelle ist für verschiedene Disziplinen wertvoll. Ihre Erkenntnisse hängen von Ihrem zugrunde liegenden Ziel ab.
- Wenn Ihr Hauptaugenmerk auf der Grundlagenchemie liegt: Betrachten Sie dies als perfekte Demonstration, wie elektrische Energie eine nicht-spontane Redoxreaktion erzwingen kann, indem sie eine stabile Verbindung in ihre Elemente trennt.
- Wenn Ihr Hauptaugenmerk auf erneuerbaren Energien liegt: Erkennen Sie die Elektrolyse als eine Schlüsselmethode zur Energiespeicherung, die überschüssigen Strom aus Quellen wie Solar- oder Windenergie in Wasserstoffbrennstoff umwandelt.
- Wenn Ihr Hauptaugenmerk auf praktischer Anwendung liegt: Denken Sie daran, dass Effizienz, Rate und Produkte der Elektrolyse vollständig von den spezifisch verwendeten Materialien abhängen – dem Elektrolyten, dem Elektrodenmaterial und der angelegten Spannung.
Letztendlich ist die Wasserelektrolyse ein leistungsstarker Prozess, der Elektrizität nutzt, um die in einem einfachen Molekül gespeicherte chemische Energie freizusetzen.
Zusammenfassungstabelle:
| Komponente | Rolle in der Elektrolysezelle |
|---|---|
| Anode (Positive Elektrode) | Ort der Oxidation; produziert Sauerstoffgas (O₂). |
| Kathode (Negative Elektrode) | Ort der Reduktion; produziert Wasserstoffgas (H₂). |
| Elektrolyt | Macht Wasser leitfähig; liefert Ionen zum Ladungstransport. |
| Stromquelle | Liefert die elektrische Energie, um die nicht-spontane Reaktion anzutreiben. |
Bereit, die Elektrolysetechnologie in Ihre Laborabläufe zu integrieren? KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien für fortschrittliche chemische Prozesse. Egal, ob Sie neue Energiespeicherlösungen entwickeln oder Grundlagenforschung betreiben, unsere Expertise stellt sicher, dass Sie die zuverlässige Ausrüstung erhalten, die Sie benötigen. Kontaktieren Sie unser Team noch heute, um zu besprechen, wie wir Ihre spezifischen Laboranforderungen unterstützen können.
Visuelle Anleitung
Ähnliche Produkte
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Elektrolysezelle mit fünf Anschlüssen
- Doppelschichtige Fünfloch-Wasserbad-Elektrolysezelle
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
Andere fragen auch
- Wie ist eine H-Typ-Elektrolysezelle mit austauschbarer Membran aufgebaut? Ein Leitfaden zur präzisen elektrochemischen Trennung
- Wie sollte die H-Typ-Elektrolysezelle bei Nichtgebrauch gelagert werden? Leitfaden zur fachgerechten Lagerung und Wartung
- Welches typische experimentelle System wird mit einer doppelwandigen Wasserbad-Elektrolysezelle verwendet? Präzise elektrochemische Kontrolle erreichen
- Was ist der Zweck der Doppelglasschichtstruktur in der H-Typ-Elektrolysezelle? Präzise Temperaturregelung erreichen
- Was sind die Hauptmerkmale einer doppelwandigen elektrochemischen Zelle mit Wasserbad? Erzielen Sie eine präzise Temperaturkontrolle für Ihre Experimente



















