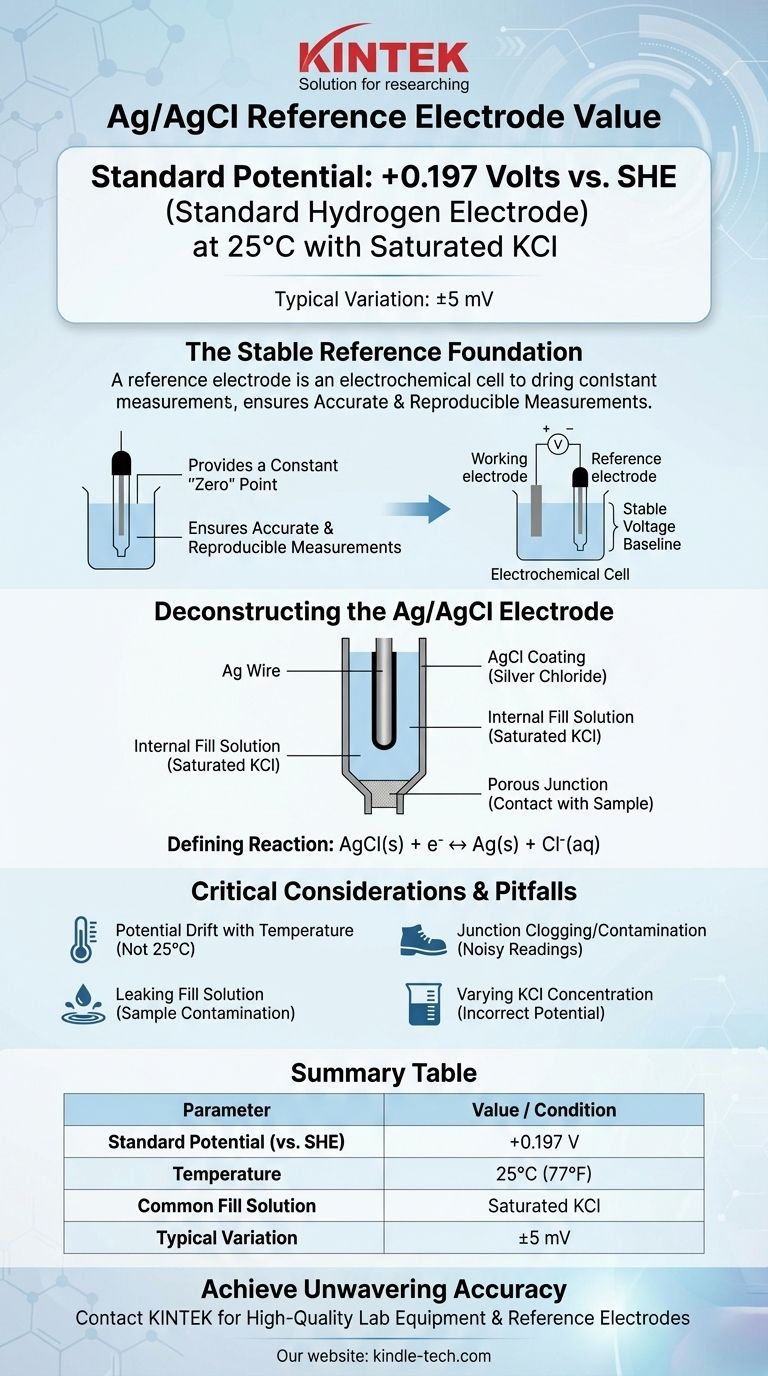
In ihrer gebräuchlichsten Konfiguration hat die Silber/Silberchlorid (Ag/AgCl)-Referenzelektrode ein Potential von +0,197 Volt relativ zur Standard-Wasserstoffelektrode (SHE) bei 25°C. Dieser Wert setzt voraus, dass die Elektrode eine gesättigte Kaliumchlorid (KCl)-Fülllösung verwendet. Geringfügige Abweichungen, oft angegeben als +199 mV (±5mV), sind aufgrund geringfügiger Unterschiede in der Herstellung und den Bedingungen üblich.
Die Kernfunktion einer Referenzelektrode besteht darin, eine unveränderliche, stabile Spannungsbasis zu liefern. Der Schlüssel zur Verwendung der Ag/AgCl-Elektrode für genaue und reproduzierbare Messungen liegt im Verständnis, dass ihr Potential durch ein spezifisches chemisches Gleichgewicht definiert wird und empfindlich auf Chloridkonzentration und Temperatur reagiert.

Die Rolle einer stabilen Referenz
Festlegung eines Nullpunkts
Alle Spannungsmessungen sind inhärent eine Potentialdifferenz zwischen zwei Punkten. In der Elektrochemie können Sie nicht das absolute Potential einer einzelnen Arbeitselektrode messen.
Eine Referenzelektrode liefert ein konstantes, bekanntes Potential, das als stabiler „Nullpunkt“ dient. Alle anderen Potentiale in Ihrer elektrochemischen Zelle werden dann relativ zu dieser unveränderlichen Referenz gemessen.
Wie Stabilität erreicht wird
Eine ideale Referenzelektrode wird als „gut gepuffert“ (well-poised) beschrieben. Das bedeutet, dass ihr Potential durch eine schnelle, reversible chemische Reaktion bestimmt wird, die durch die winzige Strommenge, die während der Messung fließt, nicht wesentlich gestört wird.
Bei der Ag/AgCl-Elektrode ergibt sich diese Stabilität aus dem Gleichgewicht zwischen festem Silberchlorid und den Silber- und Chloridionen.
Dekonstruktion der Ag/AgCl-Elektrode
Die Kernkomponenten
Eine typische Ag/AgCl-Elektrode besteht aus einem Silberdraht (Ag), der mit einer Schicht aus festem Silberchlorid (AgCl) überzogen ist.
Diese gesamte Anordnung ist in einer internen Fülllösung eingetaucht, die eine bekannte, feste Konzentration an Chloridionen (Cl⁻) enthält, meistens Kaliumchlorid (KCl). Ein poröser Übergang, oft aus Keramik oder Baumwolle, ermöglicht den elektrischen Kontakt mit der Probenlösung.
Die definierende elektrochemische Reaktion
Das Potential der Elektrode wird durch eine einfache und reversible Halbzellenreaktion festgelegt:
AgCl(s) + e⁻ ↔ Ag(s) + Cl⁻(aq)
Das Potential dieses Gleichgewichts hängt direkt von der Aktivität (effektiv der Konzentration) der Chloridionen in der Fülllösung ab.
Warum die Fülllösung entscheidend ist
Da das Potential von der Chloridkonzentration abhängt, muss ihr Wert festgelegt und bekannt sein.
Gesättigtes KCl ist die häufigste Wahl, da es einfach zuzubereiten und zu warten ist. Solange feste KCl-Kristalle vorhanden sind, bleibt die Lösung gesättigt, was eine konstante Chloridaktivität und somit ein stabiles Potential von +0,197 V gewährleistet.
Auch andere Konzentrationen, wie 3M oder 1M KCl, werden verwendet und führen zu unterschiedlichen Referenzpotentialen.
Verständnis der Kompromisse und Fallstricke
Potentialverschiebung mit der Temperatur
Das Standardpotential von +0,197 V ist nur bei 25°C (77°F) gültig. Das Potential der Elektrode ändert sich vorhersehbar mit der Temperatur. Für hochpräzise Arbeiten muss diese Temperaturabhängigkeit berücksichtigt oder kontrolliert werden.
Verstopfung und Kontamination des Übergangs
Der poröse Übergang ist die häufigste Fehlerquelle. Wenn er durch Probenmaterial verstopft wird oder der innere Elektrolyt darin kristallisiert, wird die elektrische Verbindung unterbrochen, was zu verrauschten oder völlig instabilen Messwerten führt.
Auslaufen der Fülllösung
Die interne Fülllösung tritt bauartbedingt langsam durch den Übergang aus. Wenn Ihre Probe empfindlich auf Chlorid- oder Kaliumionen reagiert, kann dieses Auslaufen eine Kontamination oder unerwünschte Nebenreaktionen verursachen, die Ihre Messung stören. In solchen Fällen kann eine Doppelelektrode mit einem anderen äußeren Elektrolyten erforderlich sein.
Annahme von gesättigtem KCl
Gehen Sie niemals davon aus, dass Ihre Ag/AgCl-Elektrode eine gesättigte KCl-Lösung verwendet. Überprüfen Sie immer die Konzentration der Fülllösung, da die Verwendung des falschen Referenzpotentials in Ihren Berechnungen eine grundlegende Fehlerquelle darstellt. Eine Elektrode mit 3M KCl beispielsweise hat ein Potential näher an +0,210 V vs. SHE.
Die richtige Wahl für Ihr Ziel treffen
Um sicherzustellen, dass Ihre Messungen fundiert sind, müssen Sie Ihre Referenzelektrode als das kritische Instrument behandeln, das sie ist.
- Wenn Ihr Hauptaugenmerk auf Routineanalysen liegt (z. B. pH-Messung): Verwenden Sie eine kommerzielle, versiegelte Elektrode, lagern Sie sie ordnungsgemäß in ihrer vorgesehenen Lösung, um den Übergang feucht zu halten, und ersetzen Sie sie, wenn die Messwerte instabil werden.
- Wenn Ihr Hauptaugenmerk auf hochpräziser Forschung liegt (z. B. Korrosionsstudien): Geben Sie zusammen mit Ihren Daten immer die spezifische verwendete Referenzelektrode an (z. B. Ag/AgCl, ges. KCl), überwachen Sie die Drift und ziehen Sie eine Kalibrierung anhand eines frisch zubereiteten Standards in Betracht.
- Wenn Ihr Hauptaugenmerk auf der Vermeidung von Probenkontamination liegt: Wählen Sie eine Doppelelektrode oder eine Elektrode mit einer Fülllösung, die chemisch mit Ihrer Probe kompatibel ist, um Ausfällungen oder Störungen am Flüssigkeitsübergang zu verhindern.
Eine zuverlässige Referenzelektrode ist die Grundlage jeder genauen elektrochemischen Messung.
Zusammenfassungstabelle:
| Parameter | Wert / Bedingung |
|---|---|
| Standardpotential (vs. SHE) | +0,197 V |
| Temperatur | 25°C (77°F) |
| Übliche Fülllösung | Gesättigtes KCl |
| Typische Variation | ±5 mV |
Erzielen Sie unerschütterliche Genauigkeit in Ihrem Labor
Ihre elektrochemischen Messungen sind nur so zuverlässig wie Ihre Referenzelektrode. KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien und liefert die präzisen und stabilen Ag/AgCl-Referenzelektroden, die Ihr Labor für reproduzierbare Ergebnisse benötigt.
Lassen Sie sich von unseren Experten bei der Auswahl der perfekten Referenzelektrode für Ihre Anwendung helfen – sei es für Routineanalysen oder hochpräzise Forschung.
Kontaktieren Sie KINTEK noch heute, um sicherzustellen, dass Ihre Messungen auf einer soliden Grundlage aufgebaut sind.
Visuelle Anleitung
Ähnliche Produkte
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Kupfersulfat-Referenzelektrode für Laboranwendungen
- Goldplattierte Elektrode
- Platin-Hilfselektrode für Laboranwendungen
- RRDE-Rotations-Scheiben (Ring-Scheiben)-Elektrode / Kompatibel mit PINE, japanischem ALS, Schweizer Metrohm Glaskohlenstoff-Platin
Andere fragen auch
- Was ist die RRDE in der Elektrochemie? Entschlüsseln Sie detaillierte Reaktionspfade mit der Zwei-Elektroden-Analyse
- Was ist der Unterschied zwischen einer Ring-Scheiben-Elektrode und einer rotierenden Scheibenelektrode? Erschließen Sie tiefere elektrochemische Erkenntnisse
- Wie sollte eine Platindraht-/Stabelektrode vor Gebrauch gereinigt werden? Ein Leitfaden für zuverlässige elektrochemische Daten
- Was ist die Anwendung der RRDE? Quantitative Katalysator- und Reaktionserkenntnisse freischalten
- Was ist die Rotierende Ring-Scheibenelektroden-Methode? Echtzeit-Reaktionsanalyse freischalten



















