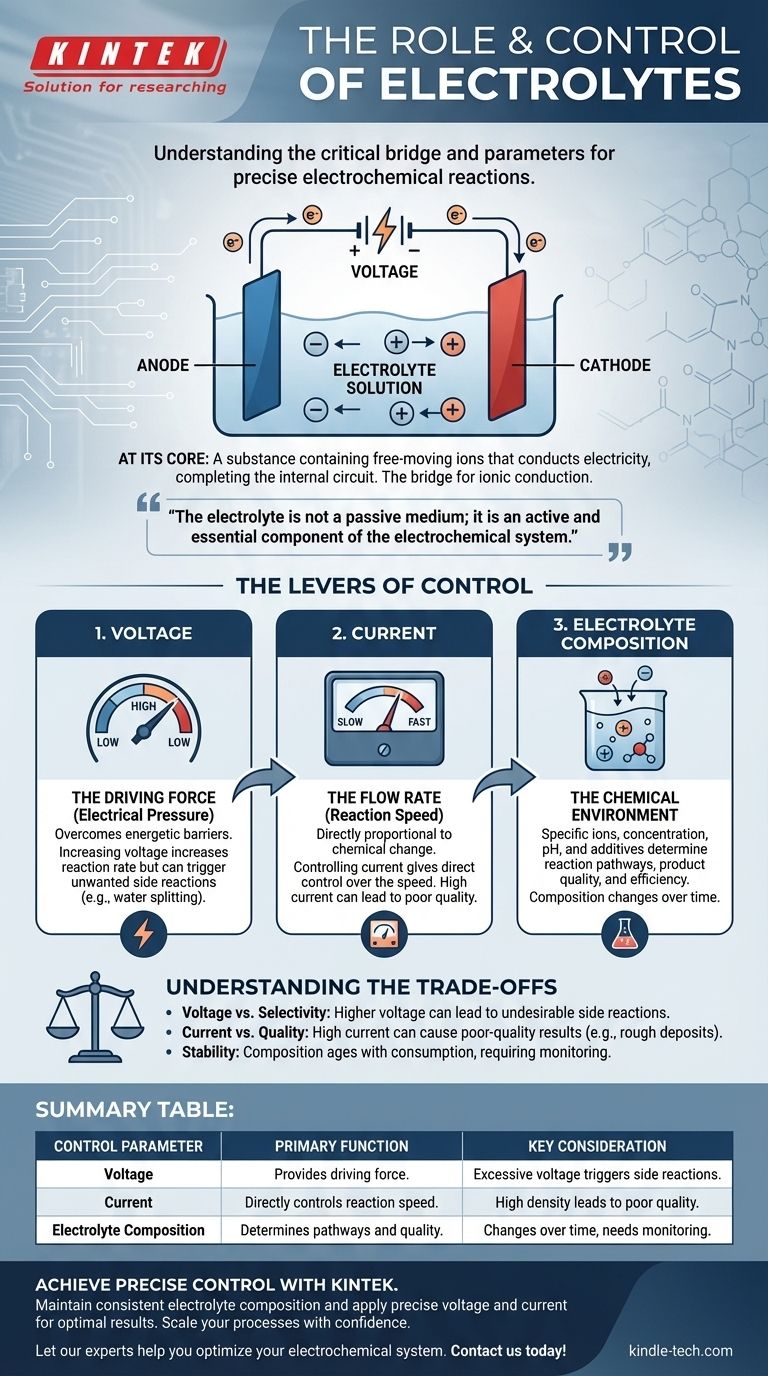
Im Kern ist ein Elektrolyt eine Substanz, die frei bewegliche Ionen enthält und Elektrizität leitet, wodurch der Stromkreis innerhalb einer elektrochemischen Zelle geschlossen wird. Er ist die entscheidende Brücke, die es ermöglicht, eine chemische Reaktion durch eine externe Energiequelle anzutreiben. Die Reaktion selbst wird präzise gesteuert, indem drei Schlüsselparameter angepasst werden: die angelegte Spannung, der resultierende Strom und die chemische Zusammensetzung des Elektrolyten.
Der Elektrolyt ist kein passives Medium; er ist eine aktive und wesentliche Komponente des elektrochemischen Systems. Zu verstehen, wie man die elektrischen Eingaben und die Chemie des Elektrolyten manipuliert, ist der Schlüssel, um eine Reaktion von einem reinen Kraftakt in einen präzise gesteuerten Vorgang zu verwandeln.

Die grundlegende Rolle des Elektrolyten
Um ein System zu steuern, muss man zuerst seine unverzichtbaren Komponenten verstehen. In der Elektrochemie ist der Elektrolyt der interne Weg, der den gesamten Prozess erst ermöglicht.
Was ist ein Elektrolyt?
Ein Elektrolyt ist typischerweise eine Lösung, die gelöste Salze, Säuren oder Basen enthält, welche in positiv geladene Kationen und negativ geladene Anionen dissoziieren. Obwohl sie oft eine wässrige (wasserbasierte) Lösung sind, können sie auch auf organischen Lösungsmitteln basieren oder sogar bei hohen Temperaturen als geschmolzene Salze vorliegen.
Die Schlüssel-Eigenschaft ist die Anwesenheit von beweglichen Ionen. Ohne sie ist der interne Stromkreis unterbrochen, und es kann keine elektrochemische Reaktion stattfinden.
Die Brücke für die Ionenleitung
Eine elektrochemische Zelle hat zwei Stromkreise. Der externe Stromkreis ist die Verkabelung, durch die Elektronen von einer Elektrode zur anderen wandern.
Der interne Stromkreis ist der Elektrolyt. Während Elektronen an einer Elektrode (der Kathode) ankommen und von der anderen (der Anode) abfließen, müssen Ionen durch den Elektrolyten wandern, um die Ladung auszugleichen. Kationen bewegen sich zur Kathode und Anionen zur Anode, wodurch der elektrische Stromkreis geschlossen wird.
Mehr als nur ein Leiter
Der Elektrolyt nimmt auch aktiv an der Reaktion teil. Seine Zusammensetzung bestimmt, welche chemischen Spezies zur Oxidation oder Reduktion zur Verfügung stehen, was die Reaktionsprodukte sein werden und wie schnell die Reaktion ablaufen kann.
Die Stellhebel der Kontrolle: Wie man die Reaktion verwaltet
Die Steuerung einer elektrochemischen Reaktion bedeutet, die Geschwindigkeit und das Ergebnis der chemischen Veränderungen an den Elektroden zu manipulieren. Dies wird durch die Verwaltung der elektrischen und chemischen Eigenschaften des Systems erreicht.
Steuerung der Spannung (Die treibende Kraft)
Spannung kann als der „elektrische Druck“ betrachtet werden, der die Reaktion vorantreibt. Eine bestimmte Mindestspannung ist erforderlich, um die energetische Barriere einer spezifischen Reaktion zu überwinden.
Eine Erhöhung der Spannung steigert im Allgemeinen die Reaktionsgeschwindigkeit. Die Anwendung einer übermäßigen Spannung ist jedoch ein stumpfes Instrument, das unerwünschte Nebenreaktionen auslösen kann.
Steuerung des Stroms (Die Durchflussrate)
Der Strom ist das Maß dafür, wie viele Elektronen pro Zeiteinheit durch den Stromkreis fließen. Gemäß den Faraday'schen Gesetzen der Elektrolyse ist das Ausmaß der chemischen Veränderung direkt proportional zur Menge der durchgeflossenen Ladung.
Daher ermöglicht Ihnen die Steuerung des Stroms eine direkte Kontrolle über die Geschwindigkeit der Reaktion. Ein konstanter Strom (galvanostatische Steuerung) stellt sicher, dass die Reaktion mit einer gleichmäßigen, vorhersagbaren Rate abläuft.
Anpassung der Elektrolytzusammensetzung (Die chemische Umgebung)
Dies ist die nuancierteste Steuerungsebene. Die spezifischen Ionen, ihre Konzentration, das Lösungsmittel und alle Zusatzstoffe verändern die Reaktionsumgebung grundlegend.
Zu den Schlüsselfaktoren gehören die Konzentration (die die Leitfähigkeit und Ionenverfügbarkeit beeinflusst), der pH-Wert (der bestimmen kann, welche Reaktionen in Wasser möglich sind) und das Vorhandensein von spezialisierten Zusatzstoffen, die Korrosion hemmen, ein galvanisiertes Finish aufhellen oder das Ergebnis anderweitig modifizieren können.
Die Kompromisse verstehen
Präzise Steuerung erfordert Bewusstsein für die Einschränkungen und Konsequenzen jeder Anpassung. Das Ausreizen eines Parameters beeinträchtigt oft einen anderen.
Das Problem Spannung vs. Selektivität
Während eine höhere Spannung die Rate erhöht, kann sie auch genügend Energie liefern, um unerwünschte Reaktionen auszulösen. Zum Beispiel kann in einer wässrigen Lösung eine übermäßige Spannung dazu führen, dass Wasser in Wasserstoff und Sauerstoff gespalten wird, wodurch Energie verbraucht und die Effizienz Ihres Hauptziels verringert wird.
Stromdichte und Qualität
Das Streben nach einem sehr hohen Strom (und damit einer hohen Reaktionsgeschwindigkeit) kann zu Ergebnissen schlechter Qualität führen. Bei der Galvanisierung kann ein zu hoher Strom dazu führen, dass Ionen nahe der Elektrodenoberfläche verbraucht werden, was zu einer rauen, porösen oder „verbrannten“ Abscheidung führt. Qualität erfordert oft Geduld und eine geringere Stromdichte.
Elektrolytstabilität und Lebensdauer
Der Elektrolyt ist nicht statisch. Seine Zusammensetzung ändert sich während der Reaktion, da Ionen verbraucht und Verunreinigungen eingebracht werden. Lösungsmittel können verdampfen und Zusatzstoffe können aufgebraucht werden. Dieses „Altern“ des Elektrolyten ist eine Hauptursache für Inkonsistenzen bei langlaufenden industriellen Prozessen und erfordert Überwachung und Wartung.
Die richtige Wahl für Ihr Ziel treffen
Ihre Kontrollstrategie hängt vollständig davon ab, was Sie erreichen möchten. Nutzen Sie diese Prinzipien, um Ihren Ansatz zu leiten.
- Wenn Ihr Hauptaugenmerk auf der Maximierung der Reaktionsgeschwindigkeit liegt: Verwenden Sie einen höheren Strom und stellen Sie sicher, dass die Elektrolytkonzentration hoch genug ist, um diese Rate ohne signifikanten Ionenverlust in der Nähe der Elektroden zu unterstützen.
- Wenn Ihr Hauptaugenmerk auf hoher Präzision oder Qualität liegt: Verwenden Sie eine niedrigere, sorgfältig kontrollierte Stromdichte oder legen Sie eine spezifische Spannung an (potentiostatische Steuerung), um sicherzustellen, dass die Reaktion reibungslos und selektiv abläuft.
- Wenn Ihr Hauptaugenmerk auf der Fehlerbehebung eines inkonsistenten Prozesses liegt: Beginnen Sie mit der Analyse des Elektrolyten. Dessen Zusammensetzung, Konzentration und mögliche Verunreinigungen sind die häufigsten Quellen für Prozessschwankungen.
Die Beherrschung dieser Prinzipien verwandelt einen elektrochemischen Prozess von einer Black Box in ein präzise abstimmbares System.
Zusammenfassungstabelle:
| Kontrollparameter | Hauptfunktion | Wichtige Überlegung |
|---|---|---|
| Spannung | Stellt die treibende Kraft für die Reaktion bereit. | Eine übermäßige Spannung kann unerwünschte Nebenreaktionen auslösen. |
| Strom | Steuert direkt die Geschwindigkeit der Reaktion. | Eine hohe Stromdichte kann zu Ergebnissen schlechter Qualität führen. |
| Elektrolytzusammensetzung | Bestimmt die Reaktionswege und die Produktqualität. | Die Zusammensetzung ändert sich im Laufe der Zeit und erfordert Überwachung. |
Bereit, präzise Kontrolle über Ihre elektrochemischen Prozesse zu erlangen?
Bei KINTEK sind wir spezialisiert auf die Bereitstellung der hochwertigen Laborgeräte und Verbrauchsmaterialien, die Sie benötigen, um Ihre Reaktionen zu meistern. Egal, ob Sie neue Materialien entwickeln, galvanisieren oder forschen, unsere Lösungen helfen Ihnen dabei:
- Eine konsistente Elektrolytzusammensetzung für zuverlässige Ergebnisse beizubehalten.
- Präzise Spannungs- und Stromsteuerung für optimale Selektivität und Qualität anzuwenden.
- Ihre Prozesse vom Labortisch bis zur Produktion mit Zuversicht zu skalieren.
Lassen Sie sich von unseren Experten bei der Optimierung Ihres elektrochemischen Systems helfen. Kontaktieren Sie uns noch heute, um Ihre spezifische Anwendung und Herausforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Elektrochemische Elektrolysezelle mit Gasdiffusion und Flüssigkeitsströmungsreaktionszelle
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- PTFE Elektrolysezelle Elektrochemische Zelle Korrosionsbeständig Abgedichtet und Nicht Abgedichtet
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
Andere fragen auch
- Welche Parameter müssen in einer Elektrolysezelle aus reinem PTFE streng kontrolliert werden? Präzision und Sicherheit gewährleisten
- Was sind die Hauptfunktionen einer Hochleistungs-Elektrolysezelle im eCO2R-Prozess? Optimieren Sie Ihre Laborergebnisse
- Was ist der Zweck der Doppelglasschichtstruktur in der H-Typ-Elektrolysezelle? Präzise Temperaturregelung erreichen
- Welche Vorteile bieten Durchfluss-Elektrolysezellen gegenüber H-Typ-Zellen? Optimierung der CO2-Elektrolyseeffizienz
- Welche Vorsichtsmaßnahmen sind hinsichtlich der Temperatur bei der Verwendung einer Elektrolysezelle aus reinem PTFE zu treffen? Gewährleisten Sie sichere & genaue Experimente



















