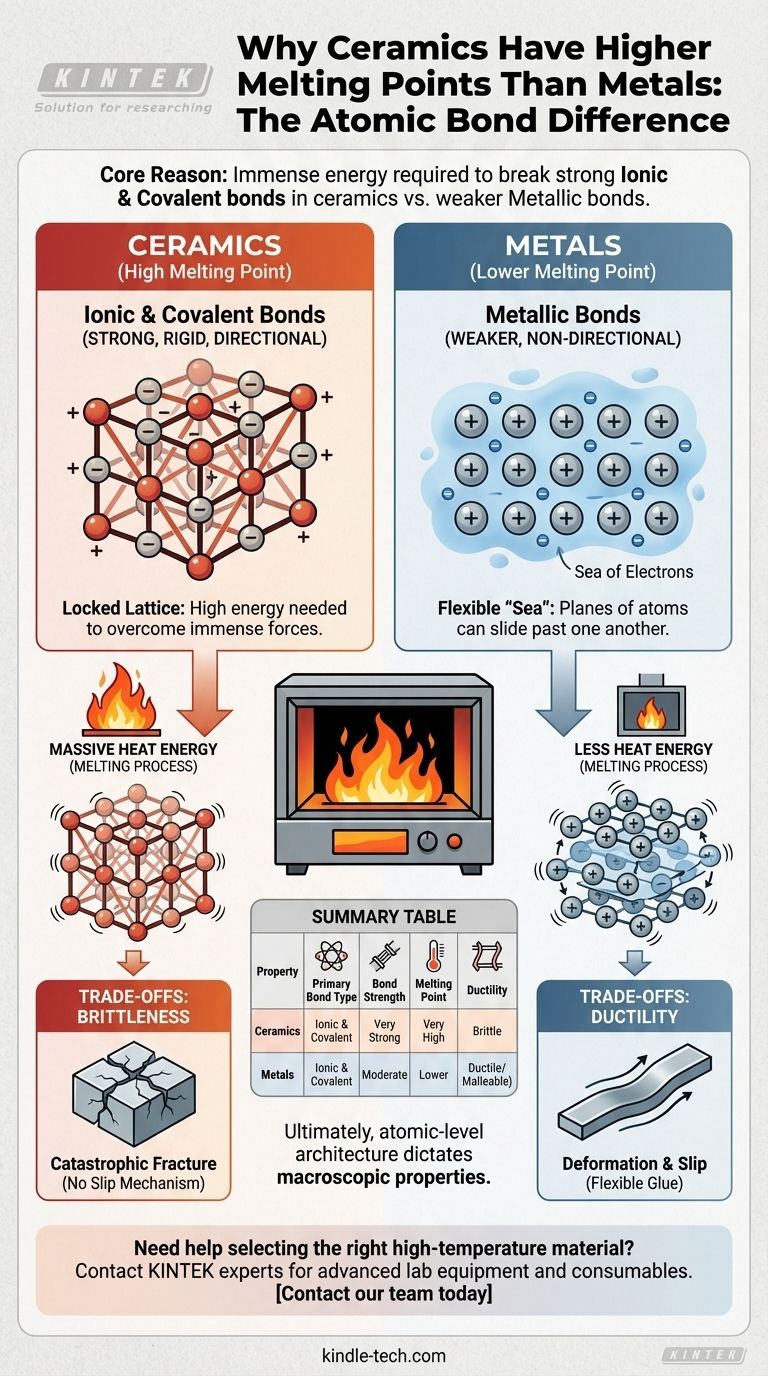
Im Grunde genommen liegt der immense Unterschied in der Schmelztemperatur zwischen Keramiken und den meisten Metallen in der fundamentalen Natur ihrer Atombindungen begründet. Keramiken werden durch extrem starke Ionen- und kovalente Bindungen zusammengehalten, deren Aufbrechen eine massive Energiemenge erfordert, während Metalle durch schwächere, nicht-gerichtete metallische Bindungen zusammengehalten werden.
Das definierende Prinzip ist einfach: Der Schmelzpunkt eines Materials ist ein direktes Maß für die Energie, die benötigt wird, um die Bindungen zu lösen, die seine Atome zusammenhalten. Die starken Ionen- und kovalenten Bindungen in Keramiken erzeugen eine starre, stabile Struktur, die zum Abbau weitaus mehr Wärmeenergie benötigt als das flexible „Elektronengas“, das metallische Bindungen kennzeichnet.

Der entscheidende Unterschied: Atomare Bindung
Um thermische Eigenschaften zu verstehen, müssen wir zunächst verstehen, wie Atome miteinander verbunden sind. Die Art und Stärke dieser Verbindungen sind die Hauptfaktoren, die den Schmelzpunkt eines Materials bestimmen.
Metallische Bindungen: Ein „Meer“ von Elektronen
In Metallen sind die äußeren Elektronen der Atome nicht an ein einzelnes Atom gebunden. Stattdessen bilden sie ein delokalisiertes „Meer von Elektronen“, das frei um ein festes Gitter positiver Metallionen fließt.
Diese Anordnung erzeugt eine starke Kohäsionskraft, aber die Bindungen sind nicht-gerichtet. Dies ermöglicht es Atomebenen, aneinander vorbeizugleiten, ohne katastrophal zu versagen, weshalb Metalle duktil und formbar sind.
Ionenbindungen: Eine starke Anziehungskraft
Viele Keramiken bilden sich durch Ionenbindungen, die zwischen positiv geladenen Ionen (Kationen) und negativ geladenen Ionen (Anionen) entstehen. Ein klassisches Beispiel ist ein Metalloxid.
Die starke elektrostatische Anziehung zwischen diesen entgegengesetzten Ladungen erzeugt sehr starke, starre und gerichtete Bindungen. Dies verriegelt die Ionen in einem hochstabilen Kristallgitter.
Kovalente Bindungen: Das geteilte Paar
Andere Keramiken, wie Siliziumkarbid, werden durch kovalente Bindungen definiert. Hier teilen sich Atome Elektronen, um stabile Elektronenpaare zu bilden, wodurch außergewöhnlich starke und stark gerichtete Verbindungen entstehen.
Diese Art der Bindung führt zu einigen der härtesten und hitzebeständigsten bekannten Materialien, da das Aufbrechen dieser geteilten Paare eine enorme Energiemenge erfordert.
Keramiken: Eine Mischung aus Stärke
Entscheidend ist, dass die meisten fortschrittlichen Keramiken einen Mix aus ionischem und kovalentem Charakter aufweisen. Diese Kombination erzeugt eine atomare Struktur mit außergewöhnlich hoher Bindungsenergie, was ein starres Gerüst schafft, das extrem widerstandsfähig gegen die durch Wärme induzierten atomaren Schwingungen ist.
Wie die Struktur die thermische Stabilität bestimmt
Die Bindung bestimmt die Atomstruktur, und diese Struktur bestimmt, wie sich das Material beim Erhitzen verhält.
Schmelzen: Der Prozess des Aufbrechens eines Gitters
Schmelzen ist der Prozess, bei dem genügend thermische Energie zugeführt wird, damit Atome oder Ionen ihre festen Positionen im Kristallgitter verlassen können. Wärme ist im Grunde atomare Schwingung; je höher die Temperatur, desto heftiger schwingen die Atome.
Warum stärkere Bindungen mehr Energie erfordern
Um das starre, richtungsgebundene Gitter einer Keramik aufzubrechen, müssen ihre Atome mit genügend Intensität schwingen, um die immensen Ionen- und kovalenten Kräfte zu überwinden, die sie an Ort und Stelle halten. Dies erfordert eine sehr hohe Temperatur.
Im Gegensatz dazu ermöglicht die delokalisierte, nicht-gerichtete Natur metallischer Bindungen, dass das Gitter mit deutlich weniger thermischer Energie gestört wird.
Die Kompromisse verstehen
Diese hohe thermische Stabilität bei Keramiken geht nicht ohne Kompromisse einher. Die Art der Bindung, die Festigkeit verleiht, bringt auch erhebliche Einschränkungen mit sich.
Festigkeit hat ihren Preis: Sprödigkeit
Die gleichen starken, gerichteten Bindungen, die Keramiken ihren hohen Schmelzpunkt verleihen, machen sie auch spröde. Wenn eine Keramik Spannungen ausgesetzt wird, gibt es keinen einfachen Mechanismus, damit Atome aneinander vorbeigleiten können.
Stattdessen brechen die starren Bindungen katastrophal. Jeder kleine Riss konzentriert die Spannung und breitet sich mit sehr geringem Energieeintrag durch das Material aus.
Der Vorteil von Metallen: Duktilität
Das „Elektronengas“ in Metallen wirkt wie ein flexibler Klebstoff. Es ermöglicht Atomebenen, unter Spannung zu gleiten und sich zu verformen, ohne den Gesamtzusammenhalt des Materials zu brechen.
Diese Eigenschaft, bekannt als Duktilität, ist ein direkter Kompromiss für schwächere Bindungen und folglich niedrigere Schmelzpunkte.
Die richtige Wahl für Ihre Anwendung treffen
Das Verständnis dieser grundlegenden Unterschiede ist entscheidend für die Materialauswahl in jedem technischen Kontext.
- Wenn Ihr Hauptaugenmerk auf der strukturellen Integrität bei hohen Temperaturen liegt: Keramiken sind aufgrund der außergewöhnlichen thermischen Stabilität, die durch ihre starken Ionen- und kovalenten Bindungen verliehen wird, die eindeutige Wahl.
- Wenn Ihr Hauptaugenmerk auf Zähigkeit, Formbarkeit und Bruchfestigkeit liegt: Metalle sind die überlegene Option, da ihre nicht-gerichteten metallischen Bindungen eine Verformung anstelle eines katastrophalen Versagens ermöglichen.
- Wenn Sie eine Balance der Eigenschaften benötigen: Ziehen Sie fortschrittliche Materialien wie Keramik-Metall-Verbundwerkstoffe (Cermets) in Betracht, die entwickelt wurden, um die Härte von Keramiken mit der Zähigkeit von Metallen zu kombinieren.
Letztendlich sind die makroskopischen Eigenschaften eines Materials eine direkte Widerspiegelung seiner Architektur auf atomarer Ebene.
Zusammenfassungstabelle:
| Eigenschaft | Keramiken | Metalle |
|---|---|---|
| Primärer Bindungstyp | Ionen- & Kovalente | Metallisch |
| Bindungsstärke | Sehr stark | Mittelmäßig |
| Schmelzpunkt | Sehr hoch | Niedriger |
| Duktilität | Spröde | Duktil/Formbar |
Benötigen Sie Hilfe bei der Auswahl des richtigen Hochtemperaturmaterials für Ihre Anwendung? Bei KINTEK sind wir auf die Bereitstellung fortschrittlicher Laborgeräte und Verbrauchsmaterialien für Materialprüfungen und Forschung spezialisiert. Ob Sie mit hochschmelzenden Keramiken oder duktilen Metallen arbeiten, unsere Experten helfen Ihnen bei der Auswahl der perfekten Lösung für die Bedürfnisse Ihres Labors. Kontaktieren Sie unser Team noch heute, um zu besprechen, wie wir Ihre Forschung unterstützen und optimale Leistung gewährleisten können!
Visuelle Anleitung
Ähnliche Produkte
- Labor-Muffelofen-Bodenhub-Muffelofen
- 1800℃ Muffelofen für Labor
- 1400℃ Muffelofen für Labor
- 1700℃ Muffelofen für Labor
- 1400℃ Labor-Hochtemperatur-Rohröfen mit Aluminiumoxidrohr
Andere fragen auch
- Was bedeutet chemische Inertheit bei Keramiken? Entdecken Sie die Kraft nicht-reaktiver Materialien
- Wie tragen Keramikisolatoren zur Sicherheit bei SHS-Experimenten bei? Verbessern Sie die Zündpräzision und den Schutz Ihres Labors
- Was ist die neue Technologie für Veneers? Entdecken Sie die digitale Revolution für ein perfektes Lächeln
- Was ist ein Keramikrohr? Ein Leitfaden zur Leistung unter extremen Bedingungen
- Sind Keramiken korrosionsbeständig? Nutzen Sie ihre inerte Natur für anspruchsvolle Anwendungen
- Wie stellen Sie Siliziumkarbid im Labor her? Beherrschen Sie Hochtemperatur-Synthesemethoden
- Wie hoch ist der spezifische Widerstand von Siliziumkarbid? Es ist eine einstellbare Eigenschaft von <0,1 Ohm-cm bis hin zu hochwiderstandsfähig.
- Was ist ein anderer Name für Keramik? Ein Leitfaden für Töpferei, Porzellan und technische Materialien



















