Einführung in die Quecksilberelektrode
Definition und Zusammensetzung
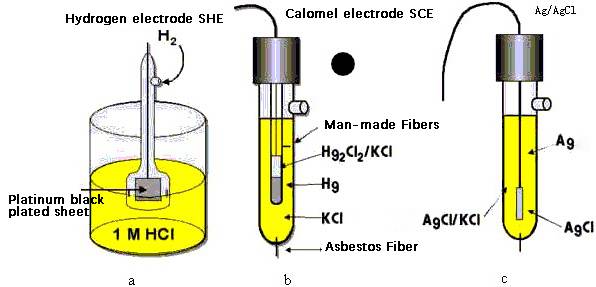
Die Quecksilberelektrode ist ein spezielles Gerät, das aus einer Lösung von metallischem Quecksilber und seinen unlöslichen Salzen besteht, Hg₂Cl₂ (Kalomel) und KCl (Kaliumchlorid).Die Zusammensetzung dieser Elektrode ist von entscheidender Bedeutung, da sie ihre Betriebseigenschaften direkt beeinflusst.Das Elektrodenpotenzial der Glyquelektrode reagiert sehr empfindlich auf die Konzentration von Chloridionen, eine Eigenschaft, die in der analytischen Chemie häufig genutzt wird.Diese Empfindlichkeit wird quantifiziert und tabellarisch dargestellt, so dass präzise Messungen in verschiedenen Versuchsaufbauten möglich sind.
Eine der bemerkenswerten Eigenschaften der Glyque-Elektrode ist ihr minimaler Temperaturkoeffizient des elektrischen Potentials.Diese Eigenschaft ist besonders vorteilhaft, wenn die Elektrode in eine Kaliumchloridlösung mit einer Konzentration von 0,1 mol-dm³ getaucht wird.Unter solchen Bedingungen ist die Veränderung des elektrischen Potenzials bei Temperaturänderungen vernachlässigbar, was stabile und zuverlässige Messungen gewährleistet.Diese Stabilität ist einer der Hauptgründe, warum die Glyque-Elektrode in vielen analytischen Anwendungen bevorzugt wird, insbesondere dort, wo präzise und konsistente Messwerte wichtig sind.
Vorbereitung und Verwendung als Salzbrücke
Die mit Kaliumchlorid gesättigte Glyquelektrode lässt sich einfach präparieren und dient während ihres Betriebs als effiziente Salzbrücke.Diese einfache Herstellung und Funktionalität machen sie zu einer bevorzugten Wahl für verschiedene Anwendungen in der analytischen Chemie.
Zur Herstellung der Glyquelektrode als Salzbrücke wird eine Lösung von metallischem Quecksilber mit seinen unlöslichen Salzen, insbesondere Hg₂Cl₂ und KCl, kombiniert.Die Konzentration der Chloridionen in der Lösung hat einen direkten Einfluss auf das Potenzial der Elektrode, das ein entscheidender Faktor für ihre Leistung ist.Bemerkenswert ist, dass der Temperaturkoeffizient des elektrischen Potenzials gering ist, insbesondere wenn die Kaliumchloridlösung bei einer Konzentration von 0,1 mol-dm gehalten wird.
In der Praxis fungiert die Glyquelektrode als Leitung, die die Bewegung von Ionen zwischen zwei Lösungen erleichtert, ohne eine direkte Vermischung zu ermöglichen.Diese Fähigkeit ist von entscheidender Bedeutung für die Aufrechterhaltung der Integrität der chemischen Umgebung in jeder Lösung, wodurch genaue und zuverlässige Messungen bei potentiometrischen Methoden gewährleistet werden.
Die Rolle der Glyquelektrode als Salzbrücke wird durch ihre Kompatibilität mit anderen Elektroden, wie z. B. der Kalomelelektrode, die als stabile Referenz dient, noch verstärkt.Diese Paarung ermöglicht eine präzise Bestimmung der Elektrodenpotentiale und festigt den Status der Glyquelektrode als sekundäre Standardelektrode.

Grundlegende Informationen
Chinesischer Name
Die Glyquelektrode, auf Chinesisch bekannt als 甘汞电极 (Gān gǒng diàn jí), ist ein spezielles Instrument der analytischen Chemie.Diese Elektrode besteht aus metallischem Quecksilber, seinen unlöslichen Salzen Hg₂Cl₂ und einer Kaliumchloridlösung (KCl).Das Potenzial der Elektrode reagiert empfindlich auf die Konzentration von Chloridionen, was sie zu einer wertvollen Komponente in verschiedenen Analyseverfahren macht.Der Temperaturkoeffizient des elektrischen Potenzials ist minimal, insbesondere bei Verwendung einer 0,1 mol-dm-Kaliumchloridlösung, was Stabilität und Reproduzierbarkeit der Messungen gewährleistet.
Im Kontext der chinesischen wissenschaftlichen Nomenklatur ist der Begriff 甘汞 (Gān gǒng) bedeutet direkt \"süßes Quecksilber" oder \"Glycymercury", was die primäre Zusammensetzung der Elektrode widerspiegelt.Diese Namensgebung unterstreicht die einzigartigen Eigenschaften der Elektrode und ihre Rolle in der analytischen Chemie, wo sie sowohl als Indikator als auch als Referenzelektrode in potentiometrischen Verfahren dient.Ihr chinesischer Name steht nicht nur für ihre chemische Zusammensetzung, sondern unterstreicht auch ihre Bedeutung in der Praxis, wo sie wegen ihrer einfachen Zubereitung und ihrer Verwendung als Salzbrücke oft bevorzugt wird.
Anwendbare Temperatur
Die Glyquelektrode ist so konzipiert, dass sie innerhalb eines bestimmten Temperaturbereichs optimal funktioniert, und zwar unter 70°C .Der Betrieb der Elektrode oberhalb dieses Schwellenwerts kann zu einer Instabilität ihres Potenzialwerts führen, wodurch sie für genaue Messungen in der analytischen Chemie weniger zuverlässig wird.Diese Temperaturbegrenzung ist entscheidend für die Aufrechterhaltung der Leistung und Langlebigkeit der Elektrode und stellt sicher, dass sie eine brauchbare Option für verschiedene Anwendungen bleibt.
Um zu verstehen, warum diese Temperaturbeschränkung besteht, ist es wichtig, die Komponenten der Glyque-Elektrode zu betrachten, insbesondere das Hg₂Cl₂ (Kalomel) und KCl (Kaliumchlorid) Lösungen.Bei Temperaturen über 70 °C kann die thermische Aktivität das Gleichgewicht dieser Lösungen stören, was zu Schwankungen des Elektrodenpotentials führt.Diese Instabilität kann die Genauigkeit der Messungen beeinträchtigen, insbesondere bei empfindlichen analytischen Verfahren.
| Temperaturbereich | Elektrodenstabilität |
|---|---|
| Unter 70°C | Stabil und zuverlässig |
| Über 70°C | Instabil und unzuverlässig |
Um die Integrität der Elektrode zu erhalten und konsistente Ergebnisse zu gewährleisten, ist es unerlässlich, die Elektrode innerhalb ihres empfohlenen Temperaturbereichs zu halten.Diese Vorsichtsmaßnahme stellt sicher, dass die Glyque-Elektrode ein zuverlässiges Werkzeug in der analytischen Chemie bleibt, insbesondere bei Anwendungen, die präzise und reproduzierbare Messungen erfordern.
Elektrodenpotential
Die Glyquelektrode weist ein stabiles und gut dokumentiertes Elektrodenpotenzial auf, das für ihre Verwendung in der analytischen Chemie entscheidend ist.Insbesondere hält diese Elektrode unter Standardbedingungen ein Potenzial von +0,2415 V aufrecht, was sie zu einer zuverlässigen Referenz bei verschiedenen elektrochemischen Messungen macht.
Dieser spezifische Potenzialwert ist besonders wichtig, wenn die Elektrode in Verbindung mit der Standard-Wasserstoffelektrode (SHE) verwendet wird.Durch den Vergleich des Potenzials der Glyque-Elektrode mit dem der SHE können Forscher das relative Elektrodenpotenzial anderer Systeme genau bestimmen.Dieses Verfahren ist für die Kalibrierung und Standardisierung elektrochemischer Messungen unerlässlich und gewährleistet die Genauigkeit und Reproduzierbarkeit der Versuchsergebnisse.
Darüber hinaus ist das Potenzial der Glyquelektrode bekanntlich relativ unempfindlich gegenüber Temperaturschwankungen, insbesondere wenn sie in eine 0,1 mol-dm Kaliumchloridlösung getaucht wird.Diese Eigenschaft erhöht ihre Nützlichkeit als Referenzelektrode noch weiter, da sie Potenzialschwankungen aufgrund von Umgebungsschwankungen minimiert.
Zusammenfassend lässt sich sagen, dass das stabile Potenzial der Glyque-Elektrode von +0,2415 V in Verbindung mit ihrem niedrigen Temperaturkoeffizienten sie zu einem unschätzbaren Werkzeug im Bereich der analytischen Chemie macht, insbesondere bei potentiometrischen Messungen und als sekundäre Standardelektrode.
Merkmale
Eines der herausragenden Merkmale der Glyquelektrode ist ihr kleine Temperaturkoeffizient des elektrischen Potentials .Diese Eigenschaft ist besonders vorteilhaft in der analytischen Chemie, wo Präzision und Stabilität von größter Bedeutung sind.Der Temperaturkoeffizient bezieht sich auf die Änderung des Elektrodenpotenzials in Abhängigkeit von Temperaturschwankungen.Bei der Glyquelektrode bleibt dieser Koeffizient minimal, insbesondere wenn die Elektrode in eine Kaliumchloridlösung mit einer Konzentration von 0,1 mol-dm getaucht wird.Diese Stabilität sorgt dafür, dass das Elektrodenpotenzial auch bei schwankenden Temperaturbedingungen relativ konstant bleibt, was die Elektrode für den Einsatz in verschiedenen Analyseverfahren sehr zuverlässig macht.
Der geringe Temperaturkoeffizient ist eine direkte Folge der Zusammensetzung der Elektrode, die metallisches Quecksilber, Hg₂Cl₂ und KCl-Lösung enthält.Die Wechselwirkung zwischen diesen Komponenten trägt zur Aufrechterhaltung eines konstanten Potenzials bei, was für genaue Messungen bei potentiometrischen Methoden entscheidend ist.Diese Eigenschaft verbessert nicht nur die Reproduzierbarkeit der Elektrode, sondern erweitert auch ihre Anwendbarkeit in verschiedenen Versuchsaufbauten, in denen die Temperaturkontrolle möglicherweise nicht perfekt eingehalten werden kann.
Zusammenfassend lässt sich sagen, dass der geringe Temperaturkoeffizient des elektrischen Potenzials der Glyque-Elektrode eine Schlüsseleigenschaft ist, die ihre Eignung als Referenzelektrode in der analytischen Chemie unterstreicht, wo Beständigkeit und Zuverlässigkeit von wesentlicher Bedeutung sind.
Bestandteile
Die Glyquelektrode besteht aus drei Hauptbestandteilen: metallisches Quecksilber (Hg), quecksilberhaltiges Chlorid (Hg₂Cl₂) und eine Kaliumchloridlösung (KCl).Jede dieser Komponenten spielt eine entscheidende Rolle für die Funktion und Stabilität der Elektrode.
-
Metallisches Quecksilber (Hg): Es bildet den Kern der Elektrode und ist für den Aufbau der elektrochemischen Grenzfläche unerlässlich.Aufgrund seiner hohen Dichte und seines niedrigen Schmelzpunkts eignet es sich für die Aufrechterhaltung eines stabilen Elektrodenpotenzials.
-
Quecksilberchlorid (Hg₂Cl₂): Diese auch als Kalomel bekannte Verbindung ist in Wasser unlöslich und dient als Puffer zur Stabilisierung des Elektrodenpotentials.Sie sorgt dafür, dass die Elektrode gleichmäßig auf Änderungen der Chloridionenkonzentration reagiert.
-
Kaliumchlorid (KCl)-Lösung: Diese Lösung dient mehreren Zwecken.Erstens liefert sie die notwendigen Chloridionen für die Wechselwirkung mit dem Quecksilberchlorid.Zweitens hilft es bei der Herstellung der Elektrode, indem es die Auflösung anderer Komponenten erleichtert.Die KCl-Konzentration reicht in der Regel von 0,1 mol-dm bis zu gesättigten Lösungen, wobei letztere aufgrund ihrer einfachen Herstellung und Stabilität häufiger verwendet werden.
Die Kombination dieser Komponenten ergibt eine Elektrode mit einem kleinen Temperaturkoeffizienten des elektrischen Potenzials, was sie für den Einsatz in der analytischen Chemie, insbesondere bei potentiometrischen Methoden, sehr zuverlässig macht.

Anwendungsbereiche
Die Glyquelektrode findet ihre Hauptanwendung im Bereich der analytischen Chemie .Diese Spezialelektrode dient als zentrales Instrument in verschiedenen Analyseverfahren, insbesondere in potentiometrischen Methoden .Bei diesen Methoden fungiert die Glyquelektrode häufig als Indikatorelektrode Sie ist eine Indikatorelektrode, deren Potenzial sich in Abhängigkeit von der Konzentration bestimmter Ionen in der zu analysierenden Lösung ändert.
Einer der wichtigsten Vorteile der Glyquelektrode in der analytischen Chemie ist ihre Stabilität und Reproduzierbarkeit .Diese Eigenschaften machen sie zu einem idealen Kandidaten für die Verwendung in Verbindung mit einer Referenzelektrode wie z. B. die Kalomelelektrode.Zusammen bilden sie eine zuverlässige elektrochemische Zelle, die präzise Messungen der Elektrodenpotentiale ermöglicht.Dieser Aufbau ist entscheidend für Anwendungen, die von pH-Messungen bis zur Bestimmung verschiedener Ionenkonzentrationen reichen.
Darüber hinaus ist die Fähigkeit der Glyquelektrode, als sekundäre Standardelektrode unterstreicht ihre Bedeutung in der analytischen Chemie.Durch die Kopplung mit der Standard-Wasserstoffelektrode können Forscher das Elektrodenpotenzial der Glyque-Elektrode genau kalibrieren und bestimmen und so die Genauigkeit und Zuverlässigkeit ihrer analytischen Messungen gewährleisten.
Zusammenfassend lässt sich sagen, dass die Rolle der Glyque-Elektrode in der analytischen Chemie vielfältig ist. Sie umfasst ihre Verwendung als Indikatorelektrode, ihre Stabilität bei potentiometrischen Messungen und ihre Kalibrierungsmöglichkeiten als sekundäre Standardelektrode.Diese Anwendungen unterstreichen ihre Unverzichtbarkeit im Bereich der analytischen Chemie.
Grundlegende Inhalte in der analytischen Chemie
Indikator- und Referenzelektroden
Bei potentiometrischen Methoden fungiert die Glyquelektrode als Indikatorelektrode, während die Kalomelelektrode als stabile Referenzelektrode dient.Die Kalomel-Elektrode ist aus metallischem Quecksilber, Kalomel (Hg₂Cl₂) und Kaliumchlorid (KCl) aufgebaut.Diese Konfiguration gewährleistet, dass die Kalomel-Elektrode ein stabiles und bekanntes Elektrodenpotenzial beibehält, das für genaue potentiometrische Messungen entscheidend ist.
Um diese Stabilität zu erreichen, verwendet die Kalomelelektrode ein Redoxsystem mit konstanten Konzentrationen ihrer Komponenten, wodurch ein gepuffertes System entsteht.Diese Eigenschaft macht die Kalomelelektrode zu einer idealen Referenzelektrode (RE) in der potentiometrischen Analyse.Im Gegensatz zur Indikatorelektrode, die unterschiedlich auf Veränderungen des Analyten reagiert, bleibt die Referenzelektrode mit einer festen Reaktion konstant und bietet eine zuverlässige Basis für Potenzialmessungen.
Die Unterscheidung zwischen Indikator- und Referenzelektroden ist bei potentiometrischen Titrationen von grundlegender Bedeutung.Indikatorelektroden, wie z. B. die Glyque-Elektrode, ändern ihr Potenzial als Reaktion auf den Analyten und spiegeln so die Konzentration der zu messenden Substanz wider.Im Gegensatz dazu halten Referenzelektroden wie die Kalomelelektrode ein konstantes Potenzial aufrecht und stellen sicher, dass alle beobachteten Potenzialänderungen auf den Analyten und nicht auf das Messsystem selbst zurückzuführen sind.
Es gibt verschiedene Arten von Indikatorelektroden, darunter Glasmembran-, Kristallmembran- und Polymermembran-Elektroden, die jeweils für unterschiedliche analytische Anforderungen geeignet sind.Die Kalomel-Elektrode bleibt jedoch aufgrund ihrer Zuverlässigkeit und Einfachheit bei der Aufrechterhaltung eines stabilen Potenzials ein Grundnahrungsmittel bei Referenzelektrodenanwendungen.
Standard-Wasserstoffelektrode
Die Standard-Wasserstoffelektrode (SHE) dient als zentrale Referenz in der Elektrochemie und bietet eine standardisierte Grundlage für die Bestimmung der relativen elektrischen Potentialwerte anderer Elektroden.Trotz ihrer Stabilität ist die SHE für ihre Komplexität im Betrieb bekannt, was sie für den routinemäßigen Einsatz im Labor oft unpraktisch macht.
Der SHE arbeitet unter Standardbedingungen mit Wasserstoffgas bei einem Druck von 1 Atmosphäre und einer Konzentration von 1 M Wasserstoffionen in Lösung.Dadurch wird sichergestellt, dass das Elektrodenpotenzial konstant und zuverlässig bleibt.Die Notwendigkeit einer ständigen Versorgung mit Wasserstoffgas und die akribische Wartung, die zur Aufrechterhaltung dieser Bedingungen erforderlich ist, machen die SHE jedoch umständlich und für viele Anwendungen unpraktisch.
Im Gegensatz dazu bieten andere Referenzelektroden, wie die Kalomel-Elektrode, eine benutzerfreundlichere Alternative.Diese Elektroden sind zwar nicht so universell einsetzbar wie die SHE, liefern aber ein stabiles und reproduzierbares Referenzpotenzial, das für genaue Messungen in der analytischen Chemie unerlässlich ist.
Die Hauptaufgabe des SHE besteht darin, einen Nullpotential-Bezugspunkt zu schaffen, an dem die Potentiale anderer Elektroden gemessen werden können.Diese Standardisierung ist für die genaue Interpretation elektrochemischer Daten von entscheidender Bedeutung und bildet die Grundlage für das Gebiet der Elektrochemie.Trotz ihrer Einschränkungen bleibt die SHE ein unverzichtbares Instrument für die Kalibrierung und Validierung elektrochemischer Instrumente.
Sekundäre Standardelektrode
Die Glyquelektrode dient in Verbindung mit der Standard-Wasserstoffelektrode als zuverlässiges Instrument zur Bestimmung des Elektrodenpotentials und wird daher auch als Sekundär-Standardelektrode bezeichnet.Diese Paarung ermöglicht präzise Messungen, die in der analytischen Chemie, wo Genauigkeit von größter Bedeutung ist, von entscheidender Bedeutung sind.
Die Standard-Wasserstoffelektrode (SHE) wird in der Regel als Referenz verwendet, um den relativen elektrischen Potentialwert anderer Elektroden zu bestimmen.Die SHE ist jedoch für ihre Stabilität bekannt, ist aber aufgrund ihrer Komplexität und der Notwendigkeit einer kontinuierlichen Wasserstoffgaszufuhr umständlich zu bedienen.Im Gegensatz dazu bietet die Glyquelektrode eine praktischere Alternative.
In Verbindung mit SHE kann die Glyquelektrode das Potenzial genau bestimmen und wird so zu einem Sekundärstandard.Diese Fähigkeit ist besonders wertvoll in der analytischen Chemie, wo Reproduzierbarkeit und Stabilität für zuverlässige Ergebnisse entscheidend sind.Das Potenzial der Glyquelektrode wird von der Chloridionenkonzentration beeinflusst, die genau kontrolliert und gemessen werden kann, was zu ihrer Genauigkeit beiträgt.
Diese sekundäre Standardfunktion der Glyquelektrode unterstreicht ihre Bedeutung bei potentiometrischen Methoden, bei denen sie häufig als Indikatorelektrode dient.Ihre Fähigkeit, genaue Potenzialmessungen zu liefern, vereinfacht den Prozess der Kalibrierung anderer Elektroden, wodurch die Gesamtpräzision der analytischen Messungen verbessert wird.
Verwendungsmöglichkeiten und Anwendungen
Referenzelektrode in der Potentiometrie
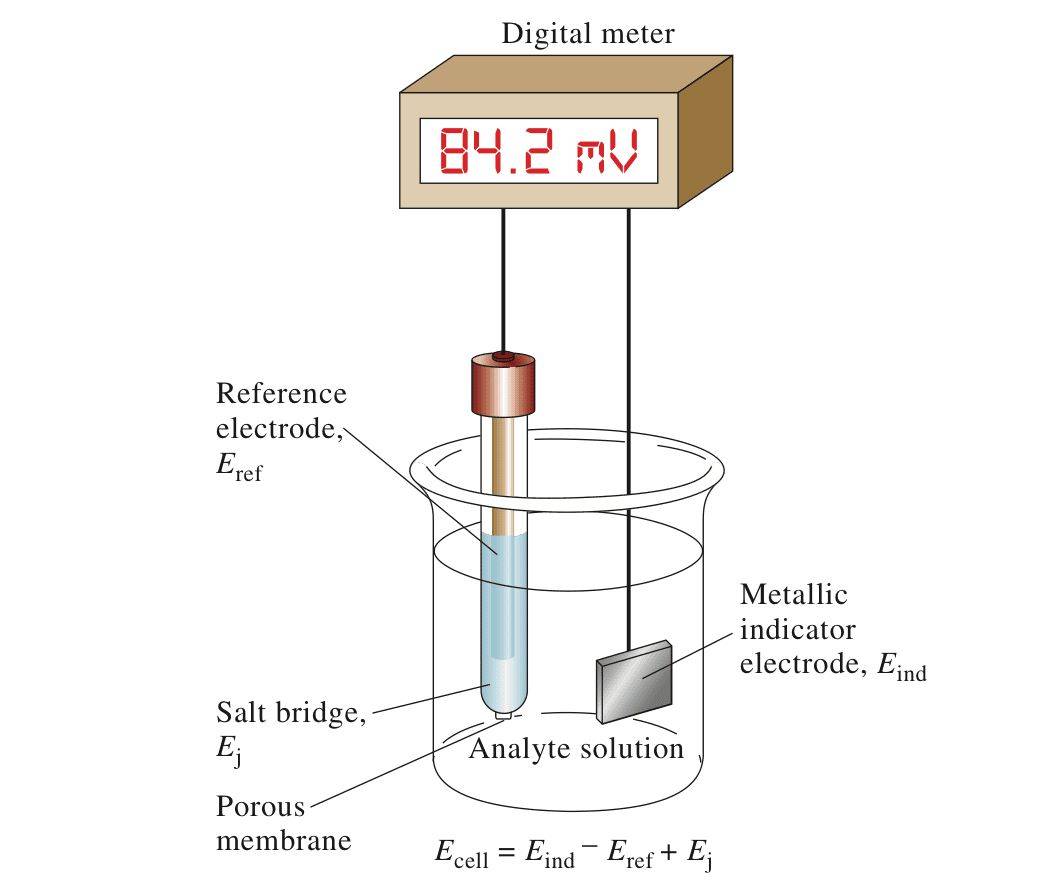
Die Glyquelektrode wird aufgrund ihrer außergewöhnlichen Reproduzierbarkeit und Stabilität häufig als Referenzelektrode in der Potentiometrie eingesetzt.Bei potentiometrischen Messungen ist die Rolle der Referenzelektrode von größter Bedeutung, da sie als konsistenter und zuverlässiger Punkt dient, an dem das Potenzial anderer Elektroden gemessen wird.Diese Stabilität ist entscheidend für genaue Messwerte, da jede Schwankung des Potenzials der Referenzelektrode zu fehlerhaften Ergebnissen führen kann.
Um diese Stabilität zu gewährleisten, sind Referenzelektroden so konzipiert, dass sie ein konstantes Potenzial aufrechterhalten, idealerweise auf einer absoluten Skala.Dies wird durch zwei Schlüsseleigenschaften erreicht: minimaler Stromfluss und "gute Ausrichtung".Eine gut gepolte Elektrode behält ihr Potenzial auch bei geringem Stromfluss bei und stellt sicher, dass ihr Referenzwert unbeeinflusst bleibt.
Es gibt zwar verschiedene Arten von Bezugselektroden, aber zu den am häufigsten verwendeten und im Handel erhältlichen gehören die Silber/Silberchlorid-, die gesättigte Kalomel-, die Quecksilber/Quecksilber(Quecksilber)-Oxid-, die Quecksilber/Quecksilbersulfat- und die Kupfer/Kupfersulfat-Elektrode.Diese Elektroden werden wegen ihrer Zuverlässigkeit und einfachen Anwendung in verschiedenen analytischen Anwendungen bevorzugt.
Bei potentiometrischen Titrationen ist die Unterscheidung zwischen Indikator- und Referenzelektroden entscheidend.Die Indikatorelektrode reagiert auf Veränderungen des Analyten und spiegelt die Konzentrationsschwankungen wider, während die Referenzelektrode stabil bleibt und ein festes Potenzial liefert.Dieser doppelte Aufbau gewährleistet, dass die Potenzialmessungen sowohl genau als auch reproduzierbar sind, was die Glyquelektrode zu einer idealen Wahl für diese Anwendungen macht.
Elektrodenreaktion und Symbole
Die Elektrodenreaktion für die Glyquelektrode ist ein grundlegender Prozess, der die Reduktion von Quecksilberchlorid (Hg₂Cl₂) zu elementarem Quecksilber (Hg) und Chloridionen (Cl-) beinhaltet.Diese Reaktion kann wie folgt dargestellt werden:
Hg₂Cl₂ + 2e⁻ → 2Hg + 2Cl⁻
Dieser elektrochemische Prozess ist entscheidend für die Funktion der Elektrode als Referenz in der analytischen Chemie.Die Symbole, die zur Beschreibung der Glyquelektrode in einer Standardnotation verwendet werden, sind:
Pt | Hg(l) | Hg₂Cl₂(s) | KCl(saturated)
Hier bedeuten die Symbole:
- Pt:Der inerte Platindraht, der als Stromkollektor dient.
- Hg(l):Das flüssige Quecksilber, das das aktive Metall in der Elektrode ist.
- Hg₂Cl₂(s):Das feste Quecksilberchlorid, das sich im Gleichgewicht mit dem Quecksilber befindet.
- KCl(gesättigt):Die gesättigte Kaliumchloridlösung, die die für die Elektrodenreaktion notwendigen Chloridionen liefert.
Diese Notation ist wichtig, um die Zusammensetzung der Elektrode und die Bedingungen, unter denen sie arbeitet, genau darzustellen und die Konsistenz und Reproduzierbarkeit der Versuchsaufbauten zu gewährleisten.
Temperatureinschränkungen
Die Kalomel-Elektrode ist zwar bei Standard-Labortemperaturen sehr zuverlässig, zeigt jedoch eine bemerkenswerte Instabilität, wenn sie erhöhter Hitze ausgesetzt wird.Insbesondere wird ihr Potenzialwert oberhalb von 70 °C unregelmäßig, so dass sie für präzise Messungen unter solchen Bedingungen ungeeignet ist.Darüber hinaus kann eine längere Aussetzung an Temperaturen über 100°C die Lebensdauer der Elektrode erheblich verkürzen.Daher ist es zwingend erforderlich, die Verwendung der Kalomelelektrode auf Temperaturen unter 70°C zu beschränken, um sowohl die Genauigkeit als auch die Langlebigkeit zu gewährleisten.
In der Praxis erfordert diese Einschränkung eine sorgfältige Abwägung bei der Auswahl der geeigneten Elektrode für verschiedene Versuchsaufbauten.So können beispielsweise in der analytischen Chemie bei hohen Temperaturen alternative Referenzelektroden mit breiteren Temperaturtoleranzen bevorzugt werden.Auf diese Weise wird sichergestellt, dass die Integrität der erfassten Daten nicht durch die inhärenten Temperaturbeschränkungen der Kalomelelektrode beeinträchtigt wird.
Arten von Elektroden
Klassifizierung von Elektroden
Elektroden lassen sich aufgrund ihrer Zusammensetzung und der Art der elektrochemischen Reaktionen, die sie ermöglichen, grob in mehrere Kategorien einteilen.Zu diesen Kategorien gehören Metall-Metallionen-Elektroden, Gas-Ionen-Elektroden, Metall-Metall-unlösliche Salzelektroden und Redox-Elektroden.Jeder Typ hat unterschiedliche Eigenschaften und Anwendungen in der Elektrochemie.
-
Metall-Metall-Ionen-Elektroden:Diese Elektroden bestehen aus einem Metall, das in eine Lösung eingetaucht ist, die seine eigenen Ionen enthält.Das Potenzial solcher Elektroden wird durch die Metallionenkonzentration in der Lösung bestimmt.
-
Gas-Ionen-Elektroden:Bei diesen Elektroden befindet sich ein Gas (z. B. Wasserstoff oder Chlor) mit seinen Ionen in Lösung im Gleichgewicht.Ein typisches Beispiel ist die Standard-Wasserstoffelektrode (SHE), die als universelle Referenzelektrode verwendet wird.
-
Metall-Metall unlösliche Salzelektroden:Zu dieser Kategorie gehören Elektroden, bei denen ein Metall mit einem unlöslichen Salz des Metalls und einer Lösung, die das Anion des Salzes enthält, in Kontakt ist.Die Glyquelektrode, die aus metallischem Quecksilber in Kontakt mit seinem unlöslichen Salz Hg₂Cl₂ und einer Kaliumchloridlösung besteht, fällt unter diese Klassifizierung.Das Elektrodenpotenzial der Glyquelektrode wird durch die Konzentration von Chloridionen beeinflusst und ist für seine Stabilität und Reproduzierbarkeit bekannt, weshalb sie gerne als Referenzelektrode in der Potentiometrie verwendet wird.
-
Redox-Elektroden:Bei diesen Elektroden findet ein Redoxpaar in Lösung statt, wobei die Redoxreaktion an einem inerten Elektrodenmaterial wie Platin abläuft.Das Potenzial einer Redoxelektrode wird durch das Verhältnis der oxidierten zu den reduzierten Spezies in der Lösung bestimmt.
Die Glyzerin-Elektrode mit ihrer einzigartigen Zusammensetzung und ihrem stabilen Potenzial ist besonders in der analytischen Chemie von Bedeutung, wo sie als zuverlässige Referenzelektrode dient.Ihre Klassifizierung als Metall-Metall-unlösliche Salzelektrode unterstreicht ihre besondere Rolle bei elektrochemischen Messungen und ihre Kompatibilität mit verschiedenen Analyseverfahren.

Andere typische Elektroden
Im Bereich der unlöslichen Metall-Metall-Salzelektroden sticht die Silber-Silberchlorid-Elektrode als bemerkenswertes Gegenstück zur Glyque-Elektrode hervor.Diese Elektrode wird aufgrund ihrer Stabilität und Reproduzierbarkeit in verschiedenen Anwendungen der analytischen Chemie eingesetzt.
Zusammensetzung und Funktionsweise
Die Silber-Silberchlorid-Elektrode besteht aus einem mit einer dünnen Schicht Silberchlorid (AgCl) überzogenen Silberdraht, der in eine Kaliumchloridlösung (KCl) getaucht ist.Dieser Aufbau gewährleistet ein stabiles Elektrodenpotential und eignet sich daher hervorragend für Referenzelektroden bei potentiometrischen Messungen.
| Bauteil | Rolle |
|---|---|
| Silberdraht | Bietet die leitende Oberfläche für die Elektrodenreaktion. |
| Silberchlorid (AgCl) | Bildet eine stabile und unlösliche Schicht, die zur Stabilität der Elektrode beiträgt. |
| Kaliumchlorid (KCl) | Wirkt als Elektrolyt und erleichtert die Ionenleitung. |
Elektrodenreaktion
Die Elektrodenreaktion für die Silber-Silberchlorid-Elektrode kann wie folgt dargestellt werden:
[ \text{AgCl} + \text{e}^- \rightarrow \text{Ag} + \text{Cl}^- ]
Diese Reaktion verdeutlicht die Übertragung von Elektronen vom Silberchlorid auf den Silberdraht, wobei ein konstantes Potenzial aufrechterhalten wird.
Anwendungen
Die Silber-Silberchlorid-Elektrode wird häufig eingesetzt in:
- Potentiometrische Messungen:Als zuverlässige Referenzelektrode aufgrund ihres stabilen Potentials.
- Umweltüberwachung:Für genaue pH- und Ionenkonzentrationsmessungen in wässrigen Lösungen.
- Medizinische und biologische Anwendungen:In Geräten, die präzise und stabile elektrische Potentiale benötigen.
Zusammenfassend lässt sich sagen, dass die Silber-Silberchlorid-Elektrode neben der Glyque-Elektrode eine entscheidende Rolle in der Kategorie der Metall-Metall-unlöslichen Salzelektroden spielt und robuste Lösungen für verschiedene Anforderungen der analytischen Chemie bietet.
Ähnliche Produkte
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Elektrochemische Elektrode aus Glaskohlenstoff
- Gold-Elektrodenblech Gold-Elektrode
- Goldplattierte Elektrode
- Platinblechelektrode für Labor- und Industrieanwendungen
Ähnliche Artikel
- So stellen Sie Ihre eigene Ag/AgCl-Referenzelektrode für elektrochemische Experimente her
- Umfassender Leitfaden für Referenzelektroden: Typen, Anwendungen und Auswahlkriterien
- Ein umfassender Leitfaden zu Referenzelektroden
- Gesättigte Kalomel-Referenzelektroden verstehen: Zusammensetzung, Einsatzmöglichkeiten und Überlegungen
- Elektrochemische Elektroden in der chemischen Analyse

















