Definition und Funktion einer Elektrode
Inhaltsverzeichnis
Beschreibung einer Elektrode
Eine Elektrode ist ein Punkt, an dem Strom in den Elektrolyten ein- und austritt. Es handelt sich um einen Leiter, der eine Verbindung mit einem nichtmetallischen Teil eines Stromkreises herstellt. Elektroden können aus Materialien wie Gold, Platin, Kohlenstoff, Graphit oder Metall bestehen. Sie dienen als Oberfläche für Redoxreaktionen in elektrochemischen Zellen. Es gibt verschiedene Arten von Elektroden, einschließlich Anode und Kathode.
Rolle einer Elektrode in einer elektrochemischen Zelle
Elektroden sind wesentliche Bestandteile elektrochemischer Zellen. Sie transportieren in der Zelle erzeugte Elektronen von einer Halbzelle zur anderen und erzeugen so eine elektrische Ladung. Die Kathode ist die Elektrode, an der der Strom die Zelle verlässt, während die Anode die Elektrode ist, an der der Strom eintritt. Der Elektrolyt in der Zelle fungiert als Leitung für den Elektronenfluss zwischen Kathode und Anode. Das Zellpotential wird auf Basis eines Standard-Elektrodensystems mit einem Referenzpotential von 0 Volt berechnet.

Unterschied zwischen einer Anode und einer Kathode
Anode und Kathode haben in einer elektrochemischen Zelle unterschiedliche Rollen. In Elektrolysezellen ist die Kathode negativ geladen und an dieser Elektrode findet eine Reduktionsreaktion statt. Während des Betriebs der Zelle bewegen sich Elektronen in die Kathode. Andererseits ist in Elektrolysezellen die Anode positiv geladen und an dieser Elektrode findet eine Oxidationsreaktion statt. Während des Betriebs der Zelle bewegen sich Elektronen aus der Anode. Es ist wichtig zu beachten, dass sich die Rollen von Anode und Kathode je nach Richtung des Elektronenflusses ändern können.
Zusammenfassend sind Elektroden Leiter, die in elektrochemischen Zellen verwendet werden, um den Elektronentransfer zu erleichtern. Sie spielen eine entscheidende Rolle für die Funktion dieser Zellen und werden je nach Art der stattfindenden chemischen Reaktion als Anoden oder Kathoden klassifiziert. Das Verständnis der Rollen und Funktionen von Elektroden ist für das Studium der Elektrochemie von entscheidender Bedeutung.
Mechanik einer Elektrode
Prozess der Oxidation und Reduktion an der Elektrodenoberfläche
Eine Elektrode ist eine Metalloberfläche, auf der ein Oxidations-Reduktions-Gleichgewicht zwischen dem Metall und der Lösung, in die es gegeben wird, hergestellt wird. Die Elektrode kann entweder eine Anode oder eine Kathode sein.
Anode: Die Anode erhält Strom oder Elektronen aus der Elektrolytmischung, wodurch diese oxidiert wird. Wenn Atome oder Moleküle in die Nähe der Oberfläche der Anode kommen, gibt die Lösung Elektronen ab, was zur Bildung positiver Ionen führt.
Kathode: Die Kathode hingegen gibt Elektronen an die Lösung ab, was zu einer Reduktion führt.
Eine Elektrode sollte stabil und korrosionsbeständig sein, es sei denn, die Elektrode dient als Opferelektrode oder wird für bestimmte Prozesse verwendet. Mechanische Einwirkungen können zu einer Verschlechterung der Elektroden führen, beispielsweise durch die Freisetzung von Graphitpartikeln, die möglicherweise gefiltert werden müssen. Auch ein Aufquellen der Elektrode kann bei bestimmten Materialien problematisch sein.
Rolle von Anode und Kathode in diesen Prozessen
Anoden und Kathoden spielen eine entscheidende Rolle in elektrochemischen Systemen wie Batterien, Brennstoffzellen, Photovoltaikzellen, Elektrolysezellen und Dioden.

Anode: Die Anode bezeichnet die Elektrode, an der die Oxidation stattfindet bzw. an der Elektronen abfließen. Es ist der Anschluss oder Leiter, an dem Elektronen die elektrochemische Zelle verlassen und eine Oxidation verursachen. Bei Primärzellen ist die Anode fest montiert und kann nicht wieder aufgeladen werden, während bei Sekundärzellen die Anode je nach Stromrichtung ihre Polarität ändern kann.
Kathode: Als Kathode bezeichnet man die Elektrode, an der die Reduktion stattfindet bzw. an der Elektronen einströmen. An der Kathode gelangen Elektronen in die Zelle und sind an Reduktionsreaktionen beteiligt. Ähnlich wie die Anode kann auch die Kathode in Sekundärzellen ihre Polarität ändern.
Korrosion an Elektroden kann schwerwiegend sein, insbesondere wenn im Elektrolyten schwankende Potentiale vorliegen oder wenn unterschiedliche Metalle als Anode und Kathode verwendet werden. Allerdings können Inhibitoren und andere vorbeugende Maßnahmen dazu beitragen, Elektrodenangriffe zu reduzieren.
Elektrolyse ist ein Prozess, der in Elektrolysezellen stattfindet, bei dem elektrische Energie verwendet wird, um nicht spontane chemische Reaktionen durchzuführen. Die Oxidation erfolgt an der Anode (positive Platte), während die Reduktion an der Kathode (negative Platte) erfolgt.
Das Verständnis der Mechanik einer Elektrode, einschließlich der Oxidations- und Reduktionsprozesse, sowie der Rolle von Anode und Kathode ist bei verschiedenen elektrochemischen Anwendungen von entscheidender Bedeutung.
Materialzusammensetzung einer Elektrode
Anforderungen an ein Elektrodenmaterial
Die Effizienz elektrochemischer Zellen wird durch die physikalischen Eigenschaften der Elektroden bestimmt. Die Materialzusammensetzung einer Elektrode spielt eine entscheidende Rolle für ihre Leistung. Die Hauptanforderung an ein Elektrodenmaterial ist die Leitfähigkeit. Als Elektrode kann jedes leitende Material wie Metalle, Halbleiter, Graphit oder leitfähige Polymere verwendet werden. In vielen Fällen bestehen Elektroden aus einer Kombination von Materialien mit jeweils einer spezifischen Aufgabe. Zu diesen Materialien gehören:
- Aktive Materialien: Dies sind die Partikel, die in der Elektrode oxidiert oder reduziert werden.
- Leitende Wirkstoffe: Sie verbessern die Leitfähigkeit der Elektrode.
- Bindemittel: Sie werden verwendet, um die aktiven Partikel in der Elektrode einzuschließen.
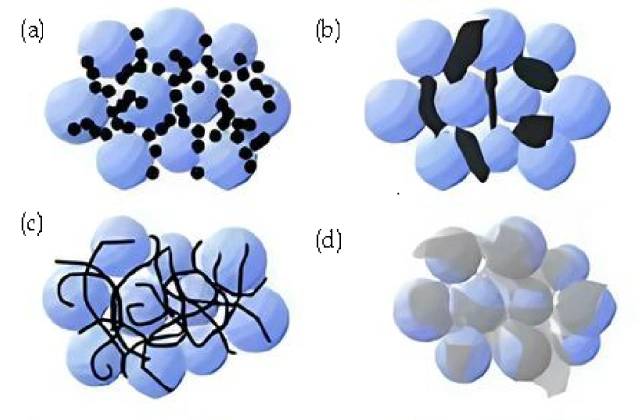
![Zusammenfassung der leitfähigen Wirkstoffe (a. Ruß, starre Nanopartikel; Punkt-zu-Punkt-Kontakt. b. Leitfähiger Graphit, starre Mikropartikel; Punkt-zu-Punkt-Kontakt. c. Kohlenstoff-Nanoröhrchen, flexibel; Linien- und Punktkontakt d. Graphit , flexibles Blatt; Flächen- und Punktkontakt. )]()
Zusammenfassung der leitfähigen Wirkstoffe (a. Ruß, starre Nanopartikel; Punkt-zu-Punkt-Kontakt. b. Leitfähiger Graphit, starre Mikropartikel; Punkt-zu-Punkt-Kontakt. c. Kohlenstoff-Nanoröhrchen, flexibel; Linien- und Punktkontakt d. Graphit , flexibles Blatt; Flächen- und Punktkontakt. )
Weitere wichtige Eigenschaften von Elektroden sind neben der Leitfähigkeit der elektrische Widerstand, die spezifische Wärmekapazität, das Elektrodenpotential und die Härte. Auch die Materialkosten sind ein wichtiger Faktor, der bei technologischen Anwendungen berücksichtigt werden muss.
Beispiele für inerte und reaktive Elektroden
Abhängig von ihrer Beteiligung an der Oxidations-Reduktionsreaktion (Redoxreaktion) kann eine Elektrode entweder inert oder reaktiv sein. Inerte Elektroden nehmen nicht an der Reaktion teil und sind chemisch nicht reaktiv. Beispiele für inerte Elektroden sind Graphit (Kohlenstoff), Platin, Gold und Rhodium. Diese Materialien werden verwendet, wenn der einzige Zweck der Elektrode darin besteht, den Stromfluss in der elektrochemischen Zelle zu erleichtern.
Andererseits nehmen reaktive Elektroden aktiv an der Redoxreaktion teil. Sie unterliegen zusammen mit den Reaktanten einer Oxidation oder Reduktion. Beispielsweise ist eine Magnesiumelektrode eine aktive Elektrode, da sie an der Reaktion teilnimmt. Die Wahl zwischen inerten und reaktiven Elektroden hängt von den spezifischen Anforderungen des elektrochemischen Prozesses ab.
Rolle der Elektrode bei der Reaktion
Die Elektrode dient als Plattform für die Redoxreaktion. In einigen Fällen werden feste Formen der Reaktanten als Elektroden verwendet. Beispielsweise sind in einer elektrochemischen Kupfer-Silber-Zelle Kupfer und Silber sowohl die Reaktanten als auch die Elektroden. Die Reaktanten-Elektroden erleichtern die Übertragung von Elektronen und Ionen während der Redoxreaktion.
Alternativ wird bei Reaktionen, die eine inerte Elektrode erfordern, ein Metall verwendet, das nicht an der Reaktion teilnimmt. Ein Beispiel hierfür ist Platin in der Standard Hydrogen Electrode (SHE)-Reaktion. Die inerte Elektrode ermöglicht den Stromfluss, ohne die chemische Reaktion zu beeinträchtigen.
Die Wahl des Elektrodenmaterials ist entscheidend für die Erzielung optimaler Ausbeuten und Selektivität in elektrochemischen Prozessen. Die Eigenschaften des Materials beeinflussen die Kinetik und Thermodynamik des Elektronentransfers und können über Erfolg oder Misserfolg einer Transformation entscheiden. Bei der Auswahl des geeigneten Elektrodenmaterials spielen auch Überlegungen wie Kosten, Stabilität und Manipulierbarkeit in verschiedene Formen eine Rolle.
Die Materialzusammensetzung und die innere Struktur einer Elektrode sind wesentliche Faktoren, die ihre Leistung bestimmen. Die Kombination aus aktiven Materialien, Leitmitteln und Bindemitteln in einer Elektrodenaufschlämmung verbessert deren Leitfähigkeit und Funktionalität. Die Mischung wird dann auf einen Leiter aufgetragen, der als Stromkollektor in der elektrochemischen Zelle fungiert.
Zusammenfassend lässt sich sagen, dass die Materialzusammensetzung einer Elektrode, ob inert oder reaktiv, einen erheblichen Einfluss auf deren Effizienz und Funktionalität in elektrochemischen Prozessen hat. Die Wahl des Elektrodenmaterials sollte auf den spezifischen Anforderungen der Anwendung basieren und Faktoren wie Leitfähigkeit, Stabilität und Kosten berücksichtigen.
Beispiele für Elektroden
Beispiele für häufig verwendete inerte und reaktive Elektroden
Es kann zwischen aktiven Elektroden und inerten Elektroden unterschieden werden. Beispielsweise ist eine Magnesiumelektrode normalerweise eine aktive Elektrode, da sie an der Oxidations-Reduktions-(Redox-)Reaktion beteiligt ist. Eine Platinelektrode ist normalerweise eine inerte Elektrode, da sie nicht an der Oxidations-Reduktions-Reaktion teilnimmt. Eine inerte Elektrode ist chemisch nicht reaktiv und nur vorhanden, damit Strom durch die elektrochemische Zelle fließen kann.
Elektrodenbeispiele in der analytischen Chemie
Beispiele für typische Materialien, die für Elektroden in der analytischen Chemie verwendet werden, sind amorpher Kohlenstoff, Gold und Platin. Bei pH-Messungen werden häufig Glaselektroden verwendet; Bei dieser Anwendung wird das Glas chemisch dotiert, um selektiv gegenüber Wasserstoffionen zu sein.
Elektrodenbeispiele in Batterien
Batterien enthalten je nach Batterietyp unterschiedliche Elektroden.
- Blei-Säure-Batterien basieren auf Bleielektroden.
- Zink-Kohlenstoff-Batterien bestehen aus Zink- und amorphen Kohlenstoffelektroden.
- Lithium-Polymer-Batterien verfügen über Elektroden aus einer festen Polymermatrix, in der sich Lithiumionen bewegen und als Ladungsträger fungieren können.
![Blei-Säure-Batterien, Zink-Kohle-Batterien und Lithium-Polymer-Batterien]()
Blei-Säure-Batterien, Zink-Kohle-Batterien und Lithium-Polymer-Batterien
Elektrodenbeispiele in der Elektrolyse
Mit elektrischer Energie lassen sich Salze und Erze in Metalle umwandeln.
- Beim Hall-Heroult-Verfahren zur Gewinnung von Aluminiummetall aus Aluminiumoxid bestehen sowohl Anode als auch Kathode aus Graphit.
- Natriummetall wird durch Elektrolyse unter Verwendung einer Kohlenstoffanode und einer Eisenkathode hergestellt.
Inerte Elektroden
Ein Metall, das keine chemischen Reaktionen stört oder daran beteiligt ist, wird als inerte Elektrode bezeichnet. Allerdings wird es immer noch zur Übertragung von Elektrizität verwendet, indem Elektronen durch die Lösung geleitet werden, anstatt Ionen auszutauschen.
Beispiele für inerte Elektroden sind Graphit, Platin, Gold und Rhodium.
Elektroden in der quantitativen Analyse
Bei der potentiometrischen Analyse reagiert eine Indikatorelektrode auf Unterschiede in der Aktivität oder „effektiven Konzentration“ des Analyten. Diese Einfachheit macht die Potentiometrie im Vergleich zur Atomspektroskopie oder Ionenchromatographie zu einer wirtschaftlichen Technik. Diese Verfahren können anhand der kontrollierten Aspekte der Zelle klassifiziert werden.
Verwendungsmöglichkeiten von Elektroden
Elektroden werden verwendet, um Strom durch nichtmetallische Objekte zu leiten, diese auf vielfältige Weise zu verändern und die Leitfähigkeit für verschiedene Zwecke zu messen. Einige Beispiele sind:

- Elektroden für Brennstoffzellen
- Elektroden für medizinische Zwecke, wie EEG (zur Aufzeichnung der Gehirnaktivität), EKG (Aufzeichnung von Herzschlägen), ECT (elektrische Hirnstimulation), Defibrillator (Aufzeichnung und Abgabe von Herzstimulation)
- Elektroden für elektrophysiologische Techniken in der biomedizinischen Forschung
- Elektroden zur Ausführung auf dem elektrischen Stuhl
- Elektroden zum Galvanisieren
- Elektroden zum Lichtbogenschweißen
- Elektroden für kathodischen Schutz
- Elektroden zur Erdung
- Elektroden für die chemische Analyse mit elektrochemischen Methoden
- Nanoelektroden für hochpräzise Messungen in der Nanoelektrochemie
- Inerte Elektroden für die Elektrolyse (aus Platin)
- Membran-Elektroden-Anordnung
- Elektroden für die Elektroschockwaffe Taser
Standard-Wasserstoffelektrode (SHE)
Definition und Bedeutung von SHE
Eine Standard-Wasserstoffelektrode (SHE) ist eine Elektrode, die Wissenschaftler als Referenz für alle potenziellen Halbzellenreaktionen verwenden. Der Wert des Standardelektrodenpotentials beträgt Null und ist somit die Grundlage für die Berechnung von Zellpotentialen mit unterschiedlichen Elektroden oder Konzentrationen. Für genaue Messungen und Vergleiche in elektrochemischen Experimenten ist eine gemeinsame Referenzelektrode wie die SHE von entscheidender Bedeutung.
Materialzusammensetzung und Reaktionsprozess von SHE
Der SHE besteht aus einer 1,0 M H+(aq)-Lösung, die ein quadratisches Stück platiniertes Platin enthält. Das Platin ist mit einem Platindraht verbunden und ermöglicht so den Elektronenaustausch. In einem Glasrohr wird Wasserstoffgas durch und in die Lösung geleitet, was zu folgender Reaktion führt:
2H+(aq) + 2e- ⇌ H2(g)
Dieses Gleichgewicht zwischen Wasserstoffionen und Wasserstoffgas legt das Referenzpotential des SHE fest.

Herausforderungen bei der Einrichtung und Nutzung von SHE
Das Einrichten und Verwenden des SHE kann einige Herausforderungen mit sich bringen. Eine Herausforderung besteht darin, die Stabilität der Referenzelektrode über die Zeit und bei wechselnden Temperaturen sicherzustellen. Die Komponenten des SHE müssen stabil sein und feste, reproduzierbare Elektrodenpotentiale bereitstellen.
Eine weitere Herausforderung liegt in der Konstruktion der Referenzelektrode. Der SHE besteht aus einem Glasmantel mit einem kleinen Einlass oben und mehreren Auslässen unten. Im Inneren des Glasmantels befindet sich ein an beiden Enden verschlossenes Glasrohr, das den platinierten Platindraht und am unteren Ende eine platinierte Platinplatte enthält. Der Glasmantel und das Rohr werden in ein Gefäß mit 1 M HCl-Lösung getaucht. Die ordnungsgemäße Konstruktion dieser Komponenten ist für die ordnungsgemäße Funktion des SHE von entscheidender Bedeutung.
Zusammenfassend lässt sich sagen, dass die Standard-Wasserstoffelektrode ein wichtiges Werkzeug in der Elektrochemie ist und als Referenz für die Messung und den Vergleich von Elektrodenpotentialen dient. Seine Konstruktion und Verwendung erfordern sorgfältige Aufmerksamkeit, um Stabilität und Genauigkeit bei experimentellen Messungen sicherzustellen.
Drei-Elektroden-System
Das Drei-Elektroden-System ist ein wesentlicher Bestandteil der Voltammetrie. Es besteht aus drei Elektroden: der Arbeitselektrode, der Referenzelektrode und der Hilfselektrode. Jede Elektrode spielt im System eine bestimmte Rolle.
Beschreibung des Drei-Elektroden-Systems
Das Drei-Elektroden-System wird in der elektroanalytischen Chemie zur Durchführung voltammetrischer Analysen verwendet. Es ermöglicht die Messung und Steuerung des Stromflusses in einer elektrochemischen Zelle. Das System besteht aus folgenden Elektroden:
Arbeitselektrode : Die Arbeitselektrode ist für den Transport von Elektronen zu und von den in der Zelle vorhandenen Substanzen verantwortlich. Es erleichtert die elektrochemischen Reaktionen, die während der Voltammetrie ablaufen.
Referenzelektrode : Eine Referenzelektrode hat ein festgelegtes Elektrodenpotential. Es kann als Halbzelle in einer elektrochemischen Zelle verwendet werden. Durch den Vergleich des Potentials der Arbeitselektrode mit der Referenzelektrode kann das Elektrodenpotential der Arbeitselektrode ermittelt werden.
Hilfselektrode : Die Hilfselektrode sorgt dafür, dass kein Strom durch die Referenzzelle fließt. Es gleicht den Strom mit dem der Arbeitselektrode aus. Die Hilfselektrode wird auch Gegenelektrode genannt.
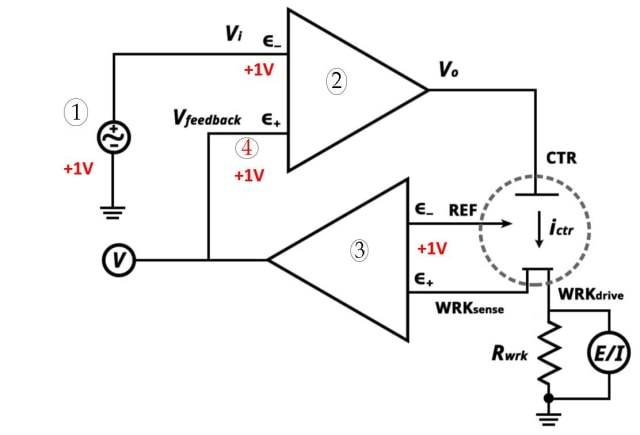
![Drei-Elektroden-System (1. Potentiostatischer Sollwert 2. Operationsverstärker mit hoher Verstärkung 3. Elektrometer 4. Sehr nah)]()
Drei-Elektroden-System (1. Potentiostatischer Sollwert 2. Operationsverstärker mit hoher Verstärkung 3. Elektrometer 4. Sehr nah)
Rollen der Arbeits-, Referenz- und Hilfselektroden
Im Drei-Elektroden-System hat jede Elektrode eine bestimmte Rolle:
Die Arbeitselektrode erleichtert die elektrochemischen Reaktionen, indem sie Elektronen zu und von den Substanzen in der Zelle transportiert.
Die Referenzelektrode stellt ein bekanntes Elektrodenpotential bereit, anhand dessen das Potential der Arbeitselektrode gemessen werden kann. Es dient als Bezugspunkt zur Bestimmung des Elektrodenpotentials der Arbeitselektrode.
Die Hilfselektrode, auch Gegenelektrode genannt, sorgt dafür, dass der Strom durch die elektrochemische Zelle fließt, ohne die Referenzelektrode zu passieren. Es gleicht den Strom mit dem der Arbeitselektrode aus.
Das Drei-Elektroden-System bietet deutliche Vorteile gegenüber Zwei-Elektroden-Aufbauten. Es ermöglicht die Isolierung der Arbeitselektrode und ermöglicht so die genaue und sichere Untersuchung spezifischer Reaktionen. Dieser Aufbau wird häufig bei elektrochemischen Experimenten verwendet.
Zwei-Elektroden-Aufbauten hingegen werden in Fällen verwendet, in denen die Messung der gesamten Zellspannung von Bedeutung ist, beispielsweise in elektrochemischen Energiegeräten wie Batterien, Brennstoffzellen und Superkondensatoren. Es kann auch verwendet werden, wenn erwartet wird, dass das Gegenelektrodenpotential während des gesamten Experiments stabil bleibt.
Insgesamt ist das Drei-Elektroden-System ein entscheidendes Werkzeug in der Voltammetrie, das eine präzise Messung und Steuerung elektrochemischer Reaktionen ermöglicht.
Beispiele für Referenzelektroden
Beschreibung und Verfahren der Calomel-Elektrode
Die Kalomelelektrode besteht aus einem Glasrohr mit einem Seitenarm. Am Boden der Röhre befindet sich reines Quecksilber, in das ein Platindraht für elektrische Verbindungen eingeschmolzen ist. Oberhalb des Quecksilbers befindet sich eine Paste aus Quecksilberchlorid (Kalomel) in Quecksilber. Der Rest des Röhrchens ist mit einer gesättigten KCl-Lösung gefüllt. Der Seitenarm dient zum Eintauchen in jede Lösung, die zum Ankoppeln der Kalomelelektrode verwendet wird.

Funktionsweise: Die Kalomelelektrode kann als negative Elektrode fungieren und je nach Art der anderen Elektrode, mit der sie gekoppelt ist, sind zwei Reaktionen möglich. Als negative Elektrode treten folgende Reaktionen auf:
- 2 Hg(l) → 2 Hg+ + 2 e–
- 2 Hg+ + 2 Cl– → Hg2Cl2(s)
Die Nettooxidationsreaktion ist die Bildung von Quecksilberchlorid.
Vorteile der Kalomel-Elektrode:
- Im Vergleich zur Standard-Wasserstoffelektrode (SHE) relativ einfacher herzustellen und zu warten.
- Besteht aus fester Paste und flüssigem Quecksilber und ist daher bequem zu verwenden
- Erfordert keine separate Salzbrücke, da bereits ein Seitenrohr mit KCl-Lösung enthalten ist
- Das Potenzial ändert sich im Laufe der Zeit und bei geringfügigen Temperaturänderungen nicht nennenswert
Nachteile der Kalomel-Elektrode:
- Bei der Messung von Halbzellenpotentialen ist eine Potenzialkompensation erforderlich
- Kann nicht zur Messung von Potentialen verwendet werden, bei denen K+- und Cl–-Ionen interferieren
- Das Oxidationspotential hängt von der KCl-Konzentration ab, daher können Konzentrationsänderungen das Potential der Elektrode beeinflussen.
Beschreibung und Verfahren der Silber-Silberchlorid-Elektrode
Die Silber-Silberchlorid-Elektrode wird aufgrund ihrer Erschwinglichkeit und geringeren Toxizität im Vergleich zur Kalomel-Elektrode häufig als Referenzelektrode verwendet. Diese Elektrode besteht aus massivem Silber und seinem ausgefällten Salz AgCl. Es wird hergestellt, indem ein Draht aus massivem Silber mit AgCl beschichtet und in ein Röhrchen mit KCl- und AgCl-Lösung getaucht wird.

Funktionsweise: Die Silber-Silberchlorid-Elektrode ermöglicht die Bildung von Ionen und den Ein- und Ausfluss von Elektronen in das Elektrodensystem. In Verbindung mit einer anderen Elektrode kann es als Referenzelektrode fungieren.
Vorteile der Silber-Silberchlorid-Elektrode:
- Kostengünstig und weit verbreitet
- Weniger toxisch im Vergleich zur Calomel-Elektrode
- Einfach einzurichten und zu reproduzieren
- Bequem und leicht zu transportieren
- Kompakt und kleiner, benötigt wenig Platz
- Es ist keine separate Salzbrücke erforderlich, da bereits ein Seitenrohr mit KCl-Lösung enthalten ist
- Das Potenzial bleibt über die Zeit und bei leichten Temperaturschwankungen relativ stabil
Referenzelektroden sind in der elektrochemischen Analyse unerlässlich, da sie ein stabiles und konstantes Potenzial für Sinnesmessungen bereitstellen. Die Kalomel-Elektrode und die Silber-Silberchlorid-Elektrode sind zwei Beispiele, die häufig in der wässrigen Elektrochemie verwendet werden. Sie haben ihre Vor- und Nachteile und ihre Eignung hängt von der konkreten Anwendung und den Anforderungen ab.
Ähnliche Produkte
- Elektrochemische Elektrolysezelle zur Beschichtungsbewertung
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Platinblechelektrode für Labor- und Industrieanwendungen
- Flache Korrosions-Elektrolysezelle
- Gold-Elektrodenblech Gold-Elektrode
Ähnliche Artikel
- Das Gefäß der Wahrheit: Warum der Behälter wichtiger ist als die Chemie
- Fortschrittliche Elektrolysezellentechniken für modernste Laborforschung
- Das zerbrechliche Gefäß der Wahrheit: Ein Wartungsmanifest für Elektrolysezellen
- Handmessgeräte für die Schichtdicke: Präzise Messungen für Galvanik und industrielle Beschichtungen
- Das Transparenz-Paradox: Die zerbrechliche Kunst der Elektrolysezellen meistern