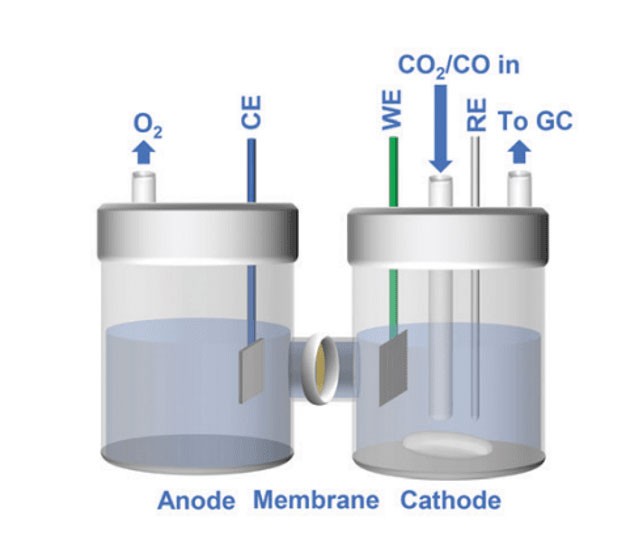
Einführung in Quarz-Elektrolyt-Zellen
Elektrolytische Zellen aus Quarz sind von zentraler Bedeutung für die Umwandlung von elektrischer in chemische Energie und spielen eine entscheidende Rolle in verschiedenen industriellen Prozessen. Diese Zellen zeichnen sich durch die Verwendung von Quarz als Schlüsselmaterial aus, das nicht nur hohen Temperaturen standhält, sondern auch chemisch inert ist. Quarz-Elektrolysezellen bestehen im Kern aus Elektroden und Elektrolyten, die zusammen präzise Oxidations- und Reduktionsreaktionen ermöglichen. Diese Einführung legt den Grundstein für eine tiefere Erkundung der Mechanismen, Anwendungen und Vorteile von Quarz-Elektrolysezellen, wobei ihre Bedeutung in Branchen von der Metallproduktion bis zur Pharmazie hervorgehoben wird.
Wirkungsmechanismus von Quarz-Elektrolysezellen
Quarz-Elektrolysezellen sind spezielle Geräte, die in verschiedenen industriellen Prozessen eingesetzt werden, insbesondere bei der Elektroraffination und Elektrogewinnung von Nichteisenmetallen wie Aluminium, Kupfer, Zink und Blei. Diese Zellen sind so konzipiert, dass sie die Ionenwanderung und die effiziente Durchführung von Oxidations- und Reduktionsreaktionen durch den Einsatz einer Quarzstruktur und eines sorgfältig ausgewählten Elektrolytmediums erleichtern.
Ionenwanderung und Elektrodenrollen
In einer Quarz-Elektrolysezelle beginnt der Prozess, wenn eine externe Spannung an das System angelegt wird. Diese Spannung treibt die Ionenwanderung innerhalb des Elektrolyten an. Positive Ionen (Kationen) werden von der negativ geladenen Kathode angezogen, während sich negative Ionen (Anionen) zur positiv geladenen Anode bewegen. Diese Ionenbewegung ist für die Leitung von Elektrizität und die Auslösung chemischer Reaktionen von entscheidender Bedeutung.
An der Kathode finden Reduktionsreaktionen statt. Hier nehmen Kationen Elektronen auf und lagern sich an der Kathodenoberfläche ab. Bei der Elektroraffination von Kupfer beispielsweise nehmen Kupferionen (Cu²⁺) Elektronen auf, um reines Kupfermetall zu bilden, das dann auf der Kathode abgeschieden wird. Dieser Prozess ist für die Gewinnung von hochreinen Metallen, die in verschiedenen industriellen Anwendungen eingesetzt werden, unerlässlich.
An der Anode finden dagegen Oxidationsreaktionen statt. Die Anionen verlieren Elektronen und setzen andere Ionen oder Moleküle frei. Im Falle der Kupferelektroraffination besteht die Anode aus unreinem Kupfer. Wenn sich das Kupfer auflöst, gibt es Verunreinigungen an den Elektrolyten ab, die dann entfernt werden, so dass an der Kathode reines Kupfer zurückbleibt.

Die Bedeutung des Elektrolytmediums
Das Elektrolytmedium in einer Quarz-Elektrolysezelle spielt eine entscheidende Rolle für die Effizienz und Effektivität der Reaktionen. Der Elektrolyt muss ein guter Ionenleiter sein und unter den Bedingungen der Reaktion stabil sein. Gängige Elektrolyte sind wässrige Lösungen von Salzen, Säuren oder Basen sowie geschmolzene Salze.
Die Wahl des Elektrolyten hängt von den spezifischen Anforderungen der Reaktion ab, wie dem gewünschten pH-Wert, der Ionenkonzentration und der Temperatur, bei der die Reaktion stattfindet. Bei der Herstellung von hochreinem Aluminium wird zum Beispiel ein geschmolzenes Gemisch aus Kryolith (Na₃AlF₆) und Aluminiumoxid (Al₂O₃) als Elektrolyt verwendet. Dieses Gemisch hat einen niedrigen Schmelzpunkt und eine hohe Leitfähigkeit, was es ideal für die elektrolytische Reduktion von Aluminiumoxid zu Aluminium macht.
Quarzstruktur und ihre Vorteile
Die Verwendung von Quarz in elektrolytischen Zellen bietet mehrere Vorteile. Quarz ist ein hervorragender Isolator, der dazu beiträgt, die Integrität des elektrischen Feldes innerhalb der Zelle aufrechtzuerhalten. Außerdem ist Quarz resistent gegen chemische Korrosion, so dass die Zelle auch unter rauen Bedingungen ohne Beeinträchtigung arbeiten kann.
Die Quarzstruktur ermöglicht auch eine präzise Steuerung der Ionenverteilung und des Stromflusses. Diese Präzision ist entscheidend für die Optimierung der Effizienz der Reaktionen und die Minimierung von Energieverlusten. Außerdem ermöglicht die Transparenz von Quarz die visuelle Überwachung der Reaktionen, was für die Prozesskontrolle und die Fehlersuche von Vorteil ist.
Anwendungen in der Metallreinigung und Galvanotechnik
Quarz-Elektrolysezellen werden in großem Umfang bei der Reinigung von Metallen und in Galvanisierungsprozessen eingesetzt. Bei der Metallreinigung, z. B. bei der Elektroraffination von Kupfer, wird das unreine Metall als Anode verwendet, und auf der Kathode wird ein reines Metall abgeschieden. Bei diesem Verfahren werden Verunreinigungen entfernt und es entsteht ein hochreines Metall, das für verschiedene industrielle Anwendungen geeignet ist.
In der Galvanotechnik werden Quarz-Elektrolysezellen verwendet, um eine dünne Schicht des gewünschten Metalls auf ein Substrat aufzubringen. Durch dieses Verfahren werden die Eigenschaften des Substrats verbessert, z. B. sein Aussehen, seine Haltbarkeit und seine Korrosionsbeständigkeit. Die Galvanotechnik wird häufig in der Automobil-, Luft- und Raumfahrt- sowie in der Elektronikindustrie eingesetzt.
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass Quarz-Elektrolysezellen bei der Herstellung von hochreinen Metallen und bei verschiedenen elektrochemischen Prozessen unverzichtbar sind. Ihr Wirkungsmechanismus umfasst die Ionenwanderung, die Rolle der Elektroden bei der Erleichterung von Oxidations- und Reduktionsreaktionen sowie die Bedeutung des Elektrolytmediums. Die Verwendung von Quarz bietet eine Reihe von Vorteilen, darunter Isolierung, Korrosionsbeständigkeit und präzise Kontrolle der Reaktionen. Diese Zellen sind in der Metallreinigung und Galvanotechnik weit verbreitet und tragen zum Fortschritt verschiedener industrieller Anwendungen bei.
Anwendungen von Quarz-Elektrolysezellen
Quarz-Elektrolysezellen spielen eine entscheidende Rolle in verschiedenen industriellen Anwendungen, insbesondere bei der Herstellung von hochreinen Metallen, der Wasserelektrolyse und in der pharmazeutischen Industrie. Diese Zellen sind so konstruiert, dass sie hohen Temperaturen und korrosiven Umgebungen standhalten, was sie ideal für Prozesse macht, die Präzision und Zuverlässigkeit erfordern.
Produktion von hochreinen Metallen
Eine der Hauptanwendungen von Quarz-Elektrolysezellen ist die Herstellung von hochreinen Metallen wie Aluminium und Kupfer. Der elektrolytische Prozess beinhaltet die Verwendung eines Gleichstroms, um eine nicht spontane chemische Reaktion anzutreiben. Bei der Aluminiumherstellung wird das Rohmaterial Bauxit in einem geschmolzenen Kryolithbad aufgelöst. Die Aluminiumionen werden dann an der Kathode reduziert, was zur Abscheidung von reinem Aluminium führt. Dieses Verfahren ist sehr energieintensiv, gewährleistet aber einen Reinheitsgrad von bis zu 99,99 %.
In ähnlicher Weise wird hochreines Kupfer durch ein Verfahren hergestellt, das als Elektroraffination bekannt ist. Bei diesem Verfahren wird unreines Kupfer als Anode verwendet, und wenn der Strom durch die Elektrolysezelle fließt, werden reine Kupferionen an der Kathode abgeschieden. Die Verunreinigungen verbleiben entweder im Elektrolyten oder bilden einen separaten Schlamm am Boden der Zelle, wodurch die Reinheit des Endprodukts gewährleistet wird.
Wasserelektrolyse
Quarz-Elektrolysezellen werden auch häufig in der Wasserelektrolyse eingesetzt, einem Verfahren, bei dem Wasser in seine Bestandteile Wasserstoff und Sauerstoff aufgespalten wird. Dieses Verfahren ist besonders nützlich für Industrien, die große Mengen dieser Gase benötigen, wie z. B. die chemische und pharmazeutische Industrie. Bei der Elektrolyse von Wasser wird ein elektrischer Strom durch Wasser geleitet, das gelöste Ionen (in der Regel aus einem Salz oder einer Säure) enthält. Die Wasserstoff-Ionen (H+) wandern zur Kathode, wo sie zu Wasserstoffgas reduziert werden, während die Hydroxid-Ionen (OH-) zur Anode wandern, wo sie zu Sauerstoffgas oxidiert werden.

Pharmazeutische Industrie
In der pharmazeutischen Industrie werden Quarz-Elektrolysezellen bei der Herstellung verschiedener Chemikalien und Verbindungen eingesetzt. So werden beispielsweise durch die Elektrolyse von Natriumchloridlösung (Sole) Chlorgas und Natriumhydroxid (Ätznatron) hergestellt, die beide wichtige Rohstoffe für die Synthese vieler Arzneimittel sind. Die präzise Steuerung des elektrolytischen Prozesses durch Quarzzellen gewährleistet die hohe Reinheit und Konsistenz dieser Chemikalien, die für pharmazeutische Anwendungen entscheidend sind.
Elektroplattieren und Oberflächenbehandlung
Eine weitere wichtige Anwendung von Quarz-Elektrolysezellen ist die Galvanisierung und Oberflächenbehandlung. Bei der Galvanisierung wird eine dünne Schicht eines bestimmten Metalls auf die Oberfläche eines anderen Metalls aufgebracht, um dessen Eigenschaften zu verbessern, z. B. die Korrosionsbeständigkeit, die Verschleißfestigkeit oder die Ästhetik. Quarzzellen bieten eine stabile und kontrollierte Umgebung für diese Prozesse und gewährleisten gleichmäßige und hochwertige Beschichtungen.
Energieverbrauch und Effizienz
Der Energieverbrauch bei elektrolytischen Verfahren variiert je nach dem herzustellenden Metall. Für die elektrolytische Herstellung von Aluminium werden beispielsweise etwa 13-15 kWh Strom pro Kilogramm Metall benötigt. Im Gegensatz dazu verbraucht die Kupferraffination durch Elektrolyse zwischen 150 und 300 kWh pro Tonne raffiniertes Kupfer. Trotz des hohen Energiebedarfs machen die Effizienz und die Reinheit der Endprodukte diese Verfahren in der modernen Industrie unverzichtbar.
Zusammenfassend lässt sich sagen, dass Quarz-Elektrolysezellen in verschiedenen Industriezweigen unverzichtbar sind, da sie eine präzise Steuerung und hohe Effizienz bei der Produktion von hochreinen Metallen, der Wasserelektrolyse und pharmazeutischen Chemikalien bieten. Ihre Fähigkeit, in rauen Umgebungen zu arbeiten, und ihre Langlebigkeit machen sie zu einem unverzichtbaren Werkzeug in der modernen Fertigungs- und Verarbeitungsindustrie.
Vorteile der Verwendung von Quarz in elektrolytischen Zellen
Quarz, eine Form von Siliziumdioxid (SiO2), ist für seine einzigartigen Eigenschaften bekannt, die es zu einem idealen Material für den Einsatz in Elektrolysezellen machen. Diese Zellen sind in verschiedenen industriellen Prozessen von entscheidender Bedeutung, unter anderem bei der Herstellung von Chemikalien, Metallen und Halbleitern. Dass Quarz gegenüber anderen Materialien wie Glas den Vorzug erhält, liegt vor allem an seiner hohen Temperaturbeständigkeit, seiner chemischen Inertheit und seinen hervorragenden elektrischen Eigenschaften.
Hohe Temperaturbeständigkeit
Quarz kann Temperaturen von bis zu 1100 °C standhalten, deutlich mehr als Glas, das bei etwa 700 °C erweicht. Diese Hochtemperaturbeständigkeit ist in elektrolytischen Zellen, in denen die Temperaturen aufgrund der elektrischen Ströme und chemischen Reaktionen erheblich ansteigen können, von entscheidender Bedeutung. Die Fähigkeit von Quarz, seine strukturelle Integrität unter solchen Bedingungen aufrechtzuerhalten, gewährleistet die Langlebigkeit und Effizienz des elektrolytischen Prozesses.
Chemische Inertheit
Quarz ist gegenüber den meisten Chemikalien, einschließlich Säuren, Laugen und Salzen, sehr beständig. Diese chemische Inertheit ist besonders in Elektrolysezellen von Vorteil, wo die Umgebung aufgrund der verwendeten Elektrolyte oft stark korrosiv ist. Durch die Verwendung von Quarz wird das Risiko chemischer Reaktionen, die die Komponenten der Zelle angreifen könnten, minimiert, wodurch die Haltbarkeit und Leistung der Zelle erhöht wird.

Elektrische Eigenschaften
Im Gegensatz zu Glas, das ein guter Isolator ist, ist Quarz ein hervorragender Leiter für Elektrizität. Diese Eigenschaft ist in Elektrolysezellen von entscheidender Bedeutung, da die effiziente Leitung von Elektrizität für den effektiven Ablauf des Elektrolyseprozesses unerlässlich ist. Die hohe Durchschlagfestigkeit und der geringe elektrische Verlust von Quarz machen es zu einem idealen Material für Elektroden und andere elektrische Komponenten in der Zelle.
Reinheit und Transparenz
Quarz ist hochrein, mit einem SiO2-Gehalt von mindestens 99,9 %. Diese hohe Reinheit ist in Branchen wie der Halbleiterherstellung, wo selbst Spuren von Verunreinigungen den Prozess beeinträchtigen können, unerlässlich. Die Transparenz von Quarz vom ultravioletten bis zum infraroten Spektrum ermöglicht außerdem eine bessere Überwachung und Kontrolle des elektrolytischen Prozesses, was eine höhere Qualität der Ergebnisse gewährleistet.
Mechanische und optische Eigenschaften
Quarz weist außergewöhnliche mechanische Eigenschaften auf, darunter hohe Steifigkeit, Elastizität und Stoßfestigkeit. Diese Eigenschaften stellen sicher, dass Quarzkomponenten den in Elektrolysezellen auftretenden mechanischen Belastungen standhalten, ohne ihre strukturelle Integrität zu beeinträchtigen. Darüber hinaus ermöglichen die ausgezeichneten optischen Übertragungseigenschaften von Quarz die präzise Überwachung und Einstellung des elektrolytischen Prozesses, was zu einer höheren Effizienz und Genauigkeit beiträgt.
Anwendungen in elektrolytischen Zellen
Aufgrund seiner einzigartigen Eigenschaften eignet sich Quarz für eine breite Palette von Anwendungen in Elektrolysezellen. Rohre und Stäbe aus Quarz werden beispielsweise in der Halbleiterherstellung für Reinigungsbäder nach dem Ätzen und der Bearbeitung sowie in Rohren, die einer Wärmebehandlung unterzogen werden, verwendet. In Labors wird Quarz in Schaugläsern, in der Optik und in verschiedenen industriellen Prozessen verwendet, wo seine Stoßfestigkeit und chemische Inertheit von unschätzbarem Wert sind.
Zusammenfassend lässt sich sagen, dass die Verwendung von Quarz in Elektrolysezellen seine überlegenen Eigenschaften nutzt, darunter Hochtemperaturbeständigkeit, chemische Inertheit, hervorragende elektrische Eigenschaften sowie mechanische und optische Vorteile. Diese Eigenschaften verbessern nicht nur die Leistung und Langlebigkeit von Elektrolysezellen, sondern tragen auch zur Produktion von hochwertigen Ergebnissen in verschiedenen industriellen Anwendungen bei.
Vergleich mit anderen Arten von elektrolytischen Zellen
Elektrolytische Zellen sind ein grundlegender Typ elektrochemischer Zellen, der sich in Aufbau, Funktion und typischen Anwendungen deutlich von galvanischen Zellen unterscheidet. Das Verständnis dieser Unterschiede ist entscheidend für die Auswahl des geeigneten Zellentyps für bestimmte Anwendungen in Forschung und Industrie.
Hauptunterschiede zwischen elektrolytischen und galvanischen Zellen
-
Energieumwandlung:
- Galvanische Zellen: Diese Zellen wandeln chemische Energie spontan in elektrische Energie um. Sie werden durch Redoxreaktionen angetrieben, die auf natürliche Weise ablaufen und einen Elektronenfluss von der Anode zur Kathode durch einen externen Stromkreis erzeugen. Beispiele hierfür sind Batterien und Brennstoffzellen.
- Elektrolytische Zellen: Im Gegensatz dazu benötigen elektrolytische Zellen eine externe elektrische Energiequelle, um nicht spontane chemische Reaktionen anzutreiben. Sie werden in Prozessen wie der Elektrolyse eingesetzt, bei denen elektrische Energie verwendet wird, um Verbindungen zu zersetzen oder Reaktionen in eine gewünschte Richtung zu lenken.
-
Spontaneität der Reaktionen:
- Galvanische Zellen: Die Reaktionen in galvanischen Zellen sind spontan, d. h. sie laufen ohne eine externe Energiequelle ab, sobald die Zelle eingerichtet ist.
- Elektrolytische Zellen: Die Reaktionen in elektrolytischen Zellen sind nicht spontan und erfordern die Zufuhr von elektrischer Energie, um abzulaufen.
-
Elektrodenpolaritäten:
- Galvanische Zellen: In galvanischen Zellen ist die Anode die negative Elektrode, an der die Oxidation stattfindet, und die Kathode ist die positive Elektrode, an der die Reduktion stattfindet.
- Elektrolytische Zellen: In elektrolytischen Zellen sind die Polaritäten umgekehrt. Die Anode ist positiv und die Kathode negativ, was die Notwendigkeit einer externen Energiequelle widerspiegelt, um die Elektronen gegen ihren natürlichen Fluss zu zwingen.

Typische Verwendungszwecke von elektrolytischen und galvanischen Zellen
- Galvanische Zellen: Sie werden häufig in alltäglichen Geräten wie Batterien (z. B. Alkali- und Lithium-Ionen-Batterien), Brennstoffzellen und Solarzellen verwendet. Sie sind für tragbare elektronische Geräte unerlässlich, da sie durch spontane chemische Reaktionen eine zuverlässige Quelle für elektrische Energie darstellen.
- Elektrolytische Zellen: Sie werden in industriellen Prozessen wie der Galvanisierung (Beschichtung eines Metalls auf ein anderes), der Wasserelektrolyse (Erzeugung von Wasserstoff und Sauerstoff) und der Metallraffination (z. B. Kupferraffination) eingesetzt. Sie sind auch für die Herstellung von Chemikalien wie Natriumhydroxid und Chlor durch die Elektrolyse von Salzsole von entscheidender Bedeutung.
Strukturelle Unterschiede
- Galvanische Zellen: Sie bestehen in der Regel aus zwei verschiedenen Elektrolytlösungen in getrennten Behältern, die durch eine Salzbrücke verbunden sind, um die elektrische Neutralität zu wahren. Die Elektroden (Anode und Kathode) sind in diese Lösungen eingetaucht, und ein externer Stromkreis ermöglicht den Elektronenfluss.
- Elektrolytische Zellen: Sie haben oft eine einfachere Struktur, bei der beide Elektroden in eine einzige Elektrolytlösung eingetaucht sind. Die externe Stromquelle ist mit den Elektroden verbunden, um den elektrolytischen Prozess anzutreiben.
Schlussfolgerung
Obwohl sowohl elektrolytische als auch galvanische Zellen zu den elektrochemischen Zellen gehören und Redoxreaktionen beinhalten, dienen sie aufgrund der Art ihrer Reaktionen und der Energieumwandlungen, die sie ermöglichen, grundlegend unterschiedlichen Zwecken. Das Verständnis dieser Unterschiede hilft bei der Auswahl des geeigneten Zellentyps für bestimmte Anwendungen, sei es für die spontane Erzeugung elektrischer Energie oder für den Antrieb chemischer Reaktionen durch die Zufuhr elektrischer Energie.
Schlussfolgerung
Zusammengefasst,quarz-elektrolytische Zellen als kritische Komponenten in modernen industriellen Prozessen hervor, indem sie ihre einzigartigen Eigenschaften nutzen, um präzise chemische Reaktionen und die Herstellung hochreiner Metalle zu ermöglichen. Ihre Fähigkeit, hohen Temperaturen zu widerstehen, und ihre chemische Inertheit machen sie zu einer überlegenen Alternative in verschiedenen Anwendungen, von der Wasserelektrolyse bis zur pharmazeutischen Produktion. Trotz Herausforderungen wie Wartung und Elektrodenverschleiß verspricht die laufende Forschung Innovationen, die ihre Effizienz verbessern und ihren Nutzen erweitern werden. Mit der weiteren Entwicklung der Industrie wird die Rolle der Quarz-Elektrolysezellen zweifellos zunehmen, was ihre Bedeutung für die Weiterentwicklung technologischer und chemischer Prozesse unterstreicht.
Ähnliche Produkte
- Elektrochemische Quarz-Elektrolysezelle für elektrochemische Experimente
- Optische Elektrolysezelle mit Seitenfenster
- H-Typ Elektrolysezelle Dreifache elektrochemische Zelle
- Multifunktionale Elektrolysezellen-Wasserbäder, einlagig, doppelwandig
- H-Typ doppelwandige optische elektrolytische elektrochemische Zelle mit Wasserbad
Ähnliche Artikel
- Das Gläserne Herz des Experiments: Präzision durch systematische Pflege
- Das Gefäß der Wahrheit: Warum der Behälter wichtiger ist als die Chemie
- Das Gläserne Herz: Warum gute Wissenschaft in schmutzigen Zellen stirbt
- Die unsichtbare Variable: Warum Rituale nach dem Experiment die wissenschaftliche Wahrheit definieren
- Die Architektur der Präzision: Beherrschen der Fünf-Port-Wasserbad-Elektrolysezelle