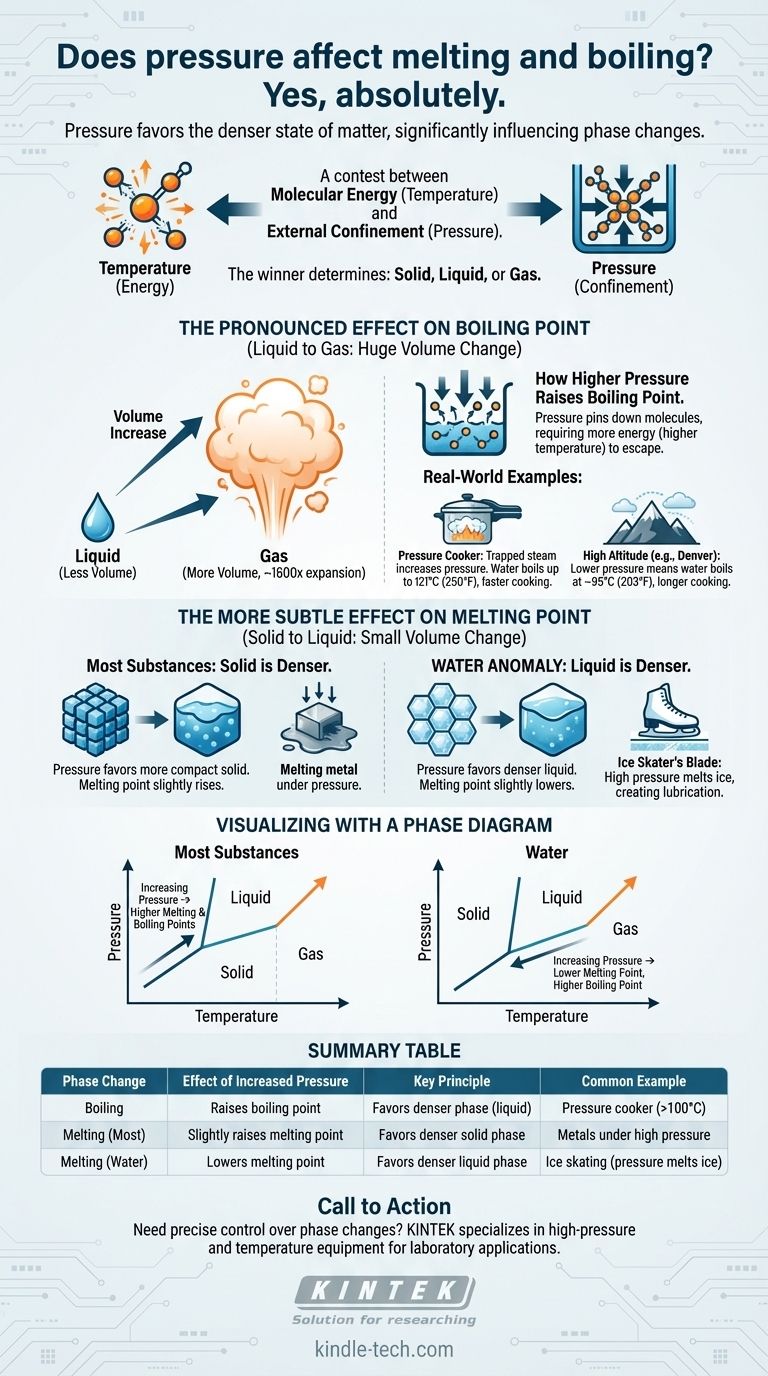
Ja, absolut. Druck ist ein entscheidender Faktor, der die Temperaturen, bei denen Stoffe ihren Zustand ändern, direkt beeinflusst. Eine Erhöhung des Umgebungsdrucks hebt im Allgemeinen den Siedepunkt einer Flüssigkeit erheblich an. Seine Auswirkung auf den Schmelzpunkt ist subtiler, folgt aber einem klaren Prinzip: Druck begünstigt den dichteren Aggregatzustand.
Das Kernprinzip ist ein Wettbewerb zwischen molekularer Energie (Temperatur) und äußerer Einschränkung (Druck). Die Temperatur liefert den Molekülen die Energie, um in einen ungeordneteren Zustand zu entweichen, während der Druck sie in einen kompakteren, dichteren Zustand zwingt. Der Gewinner dieses Wettbewerbs bestimmt, ob ein Stoff fest, flüssig oder gasförmig ist.

Warum Druck Phasenübergänge beeinflusst
Der Kampf zwischen Energie und Einschränkung
Ein Phasenübergang, wie Schmelzen oder Sieden, tritt ein, wenn Moleküle genügend thermische Energie aufnehmen, um die Kräfte zu überwinden, die sie in einer festen Struktur halten. Die Temperatur liefert diese Energie.
Druck hingegen ist eine äußere Kraft, die die Moleküle zusammendrückt. Er wirkt als eine Form der Einschränkung und erschwert es den Molekülen, sich auszubreiten und in eine weniger dichte Phase überzugehen.
Eine Frage des Volumens und der Dichte
Der Schlüssel zum Verständnis der Auswirkung des Drucks liegt im Volumen. Wenn eine Substanz schmilzt oder siedet, ändern sich ihr Volumen und ihre Dichte.
Druck wird immer die Phase bevorzugen, die weniger Volumen einnimmt – die dichtere Phase. Diese eine Regel erklärt, warum Druck Schmelzen und Sieden unterschiedlich beeinflusst.
Die ausgeprägte Wirkung auf den Siedepunkt
Von flüssig zu gasförmig: Eine enorme Volumenänderung
Der Übergang von flüssig zu gasförmig beinhaltet eine massive Volumenvergrößerung. Ein einzelner Tropfen Wasser dehnt sich beispielsweise aus, um einen über 1.600-mal größeren Raum einzunehmen, wenn er zu Dampf wird.
Da diese Volumenänderung so groß ist, hat der Druck einen sehr starken und direkten Einfluss auf den Siedepunkt.
Wie höherer Druck den Siedepunkt erhöht
Wenn Sie den Druck auf die Oberfläche einer Flüssigkeit erhöhen, „fixieren“ Sie im Wesentlichen die Moleküle. Sie benötigen nun deutlich mehr kinetische Energie (eine höhere Temperatur), um in die Gasphase zu entweichen.
Deshalb steigt der Siedepunkt nahezu aller Substanzen mit zunehmendem Druck.
Praxisbeispiel: Der Schnellkochtopf
Ein Schnellkochtopf funktioniert, indem er einen Topf verschließt und den entstehenden Wasserdampf einschließt. Dieser eingeschlossene Dampf erhöht den Druck im Inneren dramatisch.
Unter diesem hohen Druck kann der Siedepunkt von Wasser von 100 °C (212 °F) auf bis zu 121 °C (250 °F) ansteigen. Dieses heißere Wasser überträgt Wärme schneller und verkürzt die Kochzeiten drastisch.
Praxisbeispiel: Kochen in großer Höhe
In großen Höhen tritt das Gegenteil ein. In Denver, Colorado (auf 5.280 Fuß Höhe), ist der atmosphärische Druck geringer.
Da weniger atmosphärischer Druck die Wassermoleküle unten hält, können sie leichter in die Gasphase entweichen. Wasser siedet dort bei etwa 95 °C (203 °F), was bedeutet, dass Speisen länger gekocht werden müssen.
Die subtilere Auswirkung auf den Schmelzpunkt
Von fest zu flüssig: Eine geringe Volumenänderung
Im Gegensatz zum Sieden ist die Volumenänderung beim Schmelzen sehr gering. Die Dichten einer Substanz in ihrem festen und flüssigen Zustand sind normalerweise recht ähnlich.
Da die Volumenänderung minimal ist, hat der Druck einen weitaus geringeren Einfluss auf den Schmelzpunkt.
Für die meisten Substanzen: Höherer Druck erhöht den Schmelzpunkt
Die meisten Materialien – von Metallen über Wachse bis hin zu Kohlendioxid – sind in fester Form dichter als in flüssiger Form.
In diesen Fällen begünstigt eine Druckerhöhung die kompaktere feste Phase. Dies macht das Schmelzen etwas schwieriger, weshalb eine höhere Temperatur erforderlich ist. Der Schmelzpunkt steigt mit dem Druck.
Die Anomalie von Wasser: Eine entscheidende Ausnahme
Wasser ist eine bemerkenswerte und seltene Ausnahme. Festes Wasser (Eis) ist weniger dicht als flüssiges Wasser, weshalb Eis schwimmt.
Da flüssiges Wasser die dichtere Phase ist, begünstigt eine Druckerhöhung auf Eis die Bildung von Flüssigkeit. Das bedeutet, dass Eis unter hohem Druck bei einer Temperatur unter 0 °C (32 °F) schmilzt.
Praxisbeispiel: Die Kufe des Eisläufers
Die klassische Veranschaulichung dieses Prinzips ist der Eisläufer. Die dünne Kufe des Schlittschuhs konzentriert das gesamte Gewicht des Läufers auf einer winzigen Fläche und erzeugt so einen enormen Druck auf das Eis.
Dieser hohe Druck bewirkt, dass das Eis direkt unter der Kufe bei einer leicht niedrigeren Temperatur schmilzt, wodurch eine mikroskopische Wasserschicht entsteht, die den Weg der Kufe schmiert.
Die Abwägungen verstehen: Visualisierung mit einem Phasendiagramm
Ein Phasendiagramm ist eine einfache Karte, die den Zustand einer Substanz (fest, flüssig oder gasförmig) bei jeder Kombination von Temperatur und Druck anzeigt.
Die Flüssig-Gas-Grenze
Die Linie, die die flüssige und die gasförmige Phase trennt, verläuft immer nach oben und rechts. Dies bestätigt visuell, dass Sie, wenn Sie den Druck erhöhen (sich auf der vertikalen Achse nach oben bewegen), auch die Temperatur erhöhen müssen (sich auf der horizontalen Achse nach rechts bewegen), damit die Substanz siedet.
Die Fest-Flüssig-Grenze
Die Linie zwischen der festen und der flüssigen Phase ist nahezu vertikal, was zeigt, dass der Druck einen viel geringeren Einfluss auf das Schmelzen hat.
Bei den meisten Substanzen neigt sich diese Linie leicht nach rechts (höherer Druck, höherer Schmelzpunkt). Bei Wasser neigt sich diese Linie einzigartig nach links, was zeigt, dass höherer Druck zu einem niedrigeren Schmelzpunkt führt.
Schlüsselprinzipien für die praktische Anwendung
Um dieses Wissen effektiv anzuwenden, konzentrieren Sie sich auf die Substanz und die Art des beteiligten Phasenübergangs.
- Wenn Sie mit Sieden oder Kondensation zu tun haben: Denken Sie daran, dass der Druck der dominierende Faktor ist. Höherer Druck bedeutet einen höheren Siedepunkt und niedrigerer Druck bedeutet einen niedrigeren Siedepunkt.
- Wenn Sie mit Schmelzen oder Gefrieren zu tun haben (für die meisten Materialien): Die Auswirkung des Drucks ist gering. Höherer Druck erhöht den Schmelzpunkt leicht, indem er den dichteren festen Zustand begünstigt.
- Wenn Sie speziell mit Wassereis zu tun haben: Denken Sie daran, dass es die Ausnahme ist. Höherer Druck senkt den Gefrier-/Schmelzpunkt, indem er den dichteren flüssigen Zustand begünstigt.
Das Verständnis, wie Druck und Temperatur zusammenwirken, gibt Ihnen direkte Kontrolle über den physikalischen Zustand der Materie.
Zusammenfassungstabelle:
| Phasenübergang | Auswirkung von erhöhtem Druck | Schlüsselprinzip | Häufiges Beispiel |
|---|---|---|---|
| Sieden | Erhöht den Siedepunkt | Begünstigt den dichteren Zustand (flüssig) | Schnellkochtopf (Wasser siedet >100°C) |
| Schmelzen (Die meisten Materialien) | Erhöht den Schmelzpunkt leicht | Begünstigt den dichteren festen Zustand | Metalle unter hohem Druck |
| Schmelzen (Wasser/Eis) | Senkt den Schmelzpunkt | Begünstigt den dichteren flüssigen Zustand | Eislaufen (Druck schmilzt Eis) |
Benötigen Sie präzise Kontrolle über Phasenübergänge in Ihren Laborprozessen? KINTEK ist spezialisiert auf Hochdruck- und Hochtemperaturanlagen für Laboranwendungen. Ob Sie neue Materialien entwickeln, chemische Synthesen durchführen oder das Phasenverhalten untersuchen – unsere Reaktoren und Öfen bieten die exakte Druck- und Temperaturkontrolle, die Sie benötigen. Kontaktieren Sie noch heute unsere Experten, um zu besprechen, wie unsere Lösungen Ihre Forschungseffizienz und -genauigkeit verbessern können.
Visuelle Anleitung
Ähnliche Produkte
- Anpassbare Hochdruckreaktoren für fortschrittliche wissenschaftliche und industrielle Anwendungen
- Mini-Hochdruck-Autoklavreaktor aus Edelstahl für Laboranwendungen
- Hochdruck-Laborautoklav-Reaktor für Hydrothermalsynthese
- Edelstahl-Hochdruck-Autoklav-Reaktor Labor-Druckreaktor
- Hochdruck-Rohröfen für Laboratorien
Andere fragen auch
- Was sind die gängigen Anwendungen von Ultra-Tieftemperatur-Gefrierschränken? Bewahren Sie Ihre wertvollsten Proben auf
- Was ist der Zweck des Niedertemperatur-Glühprozesses? Optimieren Sie jetzt Ihre Nickeloxid-Dünnschichten
- Was sind die Vor- und Nachteile sowie die Anwendungen von Blech? Der ultimative Leitfaden zur Materialauswahl
- Was sind die 3 Arten von Biomasse-Energiequellen? Entfesseln Sie das Potenzial organischer Materialien
- Was kann Sintern bewirken? Pulver in hochleistungsfähige feste Teile umwandeln
- Warum wird vor der BWO/BMO-Synthese ein Labor-Ultraschallreiniger oder ein Hochenergie-Ultraschallhomogenisator verwendet?
- Welche drei Arten von Graphit gibt es? Ein Leitfaden zu natürlichem und synthetischem Graphit für den industriellen Einsatz
- Erfordert Pyrolyse einen Katalysator? Höherwertige Kraftstoffe aus Abfall gewinnen



















