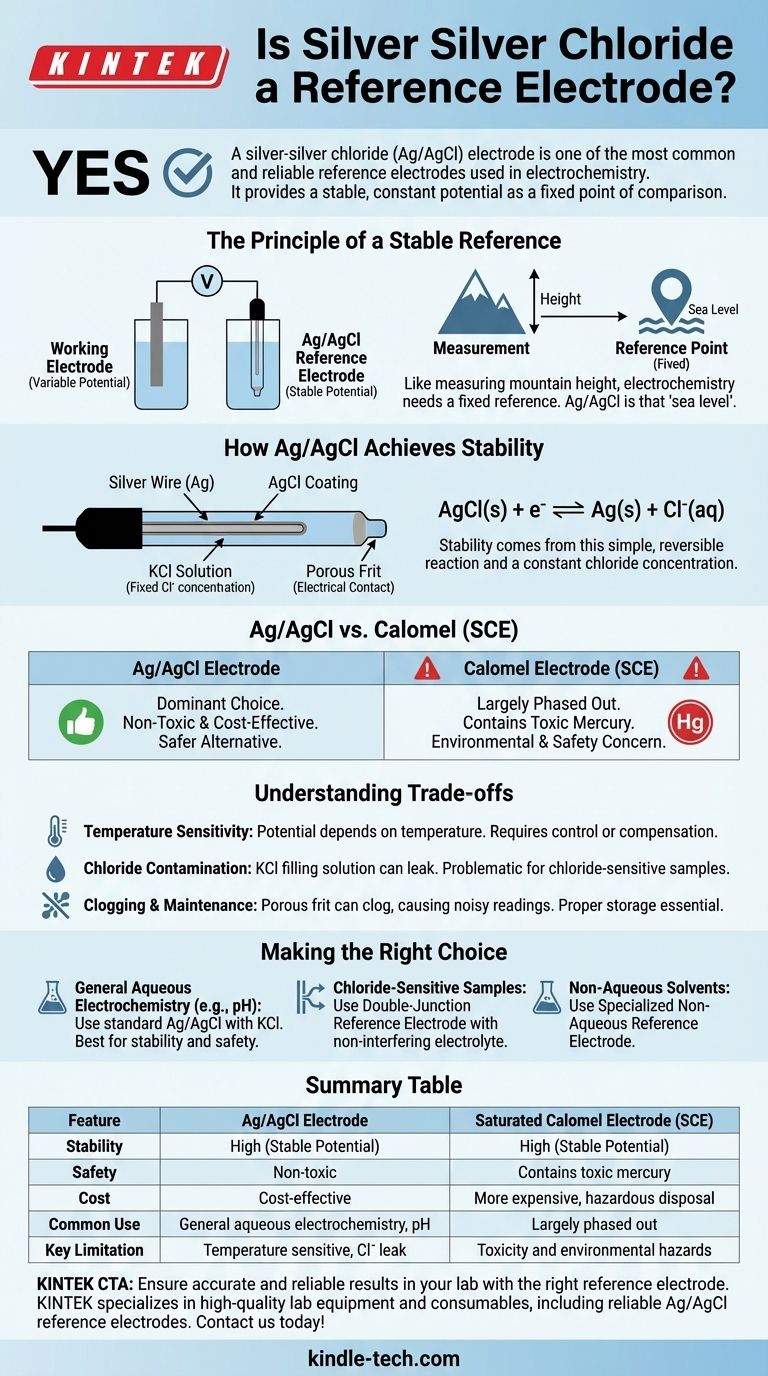
Ja, eine Silber-Silberchlorid (Ag/AgCl)-Elektrode ist eine der gebräuchlichsten und zuverlässigsten Referenzelektroden in der Elektrochemie. Sie liefert ein stabiles, konstantes Potenzial, das als fester Bezugspunkt dient und es Ihnen ermöglicht, das Potenzial einer anderen Elektrode (der Arbeitselektrode) innerhalb einer elektrochemischen Zelle genau zu messen. Diese Stabilität macht sie unverzichtbar für Anwendungen, die von der pH-Messung bis zur zyklischen Voltammetrie reichen.
Die Kernfunktion einer Referenzelektrode besteht darin, eine unveränderliche Spannungsgrundlinie bereitzustellen. Die Ag/AgCl-Elektrode erreicht dies durch ein spezifisches, stabiles chemisches Gleichgewicht und ist somit ein vertrauenswürdiger und kostengünstiger Standard in der modernen Elektrochemie.

Das Prinzip einer stabilen Referenz
Um zu verstehen, warum die Ag/AgCl-Elektrode so effektiv ist, müssen wir zunächst verstehen, was eine gute Referenz ausmacht. Eine elektrochemische Messung ist immer ein Vergleich des Potenzials zwischen zwei Punkten.
Was ist eine Referenzelektrode?
Eine Referenzelektrode ist eine Halbzelle mit einem bekannten, stabilen Elektrodenpotenzial. Ihre Aufgabe ist es, konstant zu bleiben, unabhängig von Änderungen, die in der anderen Hälfte der Zelle (der Arbeitselektrode und der Probenlösung) auftreten.
Stellen Sie es sich wie die Messung der Höhe eines Berges vor. Sie benötigen einen festen Bezugspunkt, wie den Meeresspiegel, um eine sinnvolle Messung zu erhalten. In der Elektrochemie ist die Referenzelektrode der Meeresspiegel.
Wie Ag/AgCl Stabilität erreicht
Die Stabilität der Ag/AgCl-Elektrode ergibt sich aus einer einfachen, reversiblen chemischen Reaktion. Sie besteht aus einem Silberdraht, der mit einer dünnen Schicht Silberchlorid (AgCl) überzogen ist, die alle in eine Lösung mit fester Konzentration an Chloridionen (Cl⁻), typischerweise Kaliumchlorid (KCl), eingetaucht sind.
Das Potenzial wird durch das Gleichgewicht zwischen dem festen Silbermetall und seinem Salz festgelegt:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Da die Konzentration der Chloridlösung im Inneren der Elektrode konstant gehalten wird, bleibt das Potenzial dieser Teilreaktion außergewöhnlich stabil.
Ag/AgCl im Vergleich zu anderen Referenzelektroden
Die Ag/AgCl-Elektrode ist nicht die einzige Option, aber ihre Vorteile haben sie zu einer dominierenden Wahl gegenüber älteren Standards wie der gesättigten Kalomel-Elektrode (SCE) gemacht.
Der Aufstieg von Ag/AgCl
Der Hauptgrund für die weite Verbreitung von Ag/AgCl sind ihre Sicherheit und Leistung. Sie ist relativ kostengünstig in der Herstellung und, was am wichtigsten ist, ungiftig.
Der Niedergang der Kalomel-Elektrode (SCE)
Die Kalomel-Elektrode, die eine Quecksilber-/Quecksilber(I)-chlorid-Paste verwendet, war einst ein gängiger Standard. Sie wurde jedoch in vielen Laboren weitgehend ersetzt.
Der Hauptgrund ist die Toxizität. Quecksilber ist ein gefährlicher Stoff, was die Verwendung, Lagerung und Entsorgung von Kalomel-Elektroden zu einem erheblichen Umwelt- und Sicherheitsproblem macht.
Die Abwägungen verstehen
Obwohl die Ag/AgCl-Elektrode eine ausgezeichnete Allzweckwahl ist, ist sie nicht ohne Einschränkungen. Das Verständnis dieser Kompromisse ist entscheidend für genaue Messungen.
Temperaturempfindlichkeit
Das Potenzial einer Ag/AgCl-Elektrode ist temperaturabhängig. Für hochpräzise Arbeiten muss die Temperatur der Zelle kontrolliert und angegeben oder eine temperaturkompensierende Sonde verwendet werden.
Chloridkontamination
Die Elektrode ist mit einer konzentrierten KCl-Lösung gefüllt. Eine kleine Menge dieser Lösung kann aus der porösen Fritte an der Elektrodenspitze in Ihre Probe gelangen. Wenn Ihr Experiment empfindlich auf Chloridionen reagiert, kann dies eine Fehlerquelle darstellen.
Verstopfung und Wartung
Die poröse Fritte, die den elektrischen Kontakt mit der Probe ermöglicht, kann verstopfen, was zu verrauschten oder driftenden Potenzialablesungen führt. Die richtige Lagerung (mit der Spitze in ihrer Fülllösung) und regelmäßige Wartung sind für eine lange Lebensdauer und genaue Ergebnisse unerlässlich.
Die richtige Wahl für Ihre Anwendung treffen
Die Auswahl der richtigen Referenzelektrode und Fülllösung ist entscheidend für den experimentellen Erfolg. Ihre Wahl hängt vollständig von der Chemie Ihrer Probe ab.
- Wenn Sie allgemeine wässrige Elektrochemie durchführen (wie die meisten pH- oder Ionenmessungen): Eine Ag/AgCl-Elektrode mit einer Standard-KCl-Fülllösung ist aufgrund ihrer Stabilität und Sicherheit fast immer die beste Wahl.
- Wenn Ihre Probe mit Chloridionen reagiert oder empfindlich darauf reagiert: Sie müssen eine "Doppel-Junction"-Referenzelektrode verwenden, bei der eine äußere Kammer mit einem nicht störenden Elektrolyten (wie Kaliumnitrat) das innere Ag/AgCl-Element von Ihrer Probe isoliert.
- Wenn Sie in nicht-wässrigen Lösungsmitteln arbeiten: Sie benötigen eine spezielle nicht-wässrige Referenzelektrode, da Standard-Wasserelektroden nicht richtig funktionieren und Ihr Lösungsmittel kontaminieren würden.
Letztendlich geht es bei der Auswahl der richtigen Referenzelektrode darum, sicherzustellen, dass sie ein inerter, stabiler Beobachter der chemischen Reaktion bleibt, die Sie untersuchen möchten.
Zusammenfassungstabelle:
| Merkmal | Ag/AgCl-Elektrode | Gesättigte Kalomel-Elektrode (SCE) |
|---|---|---|
| Stabilität | Hoch (stabiles Potenzial) | Hoch (stabiles Potenzial) |
| Sicherheit | Ungiftig | Enthält giftiges Quecksilber |
| Kosten | Kosteneffizient | Teurer, gefährliche Entsorgung |
| Häufige Verwendung | Allgemeine wässrige Elektrochemie, pH-Messung | Aufgrund von Sicherheitsbedenken weitgehend ersetzt |
| Wichtigste Einschränkung | Temperaturempfindlich, potenzielle Chloridkontamination | Toxizität und Umweltrisiken |
Sichern Sie sich genaue und zuverlässige Ergebnisse in Ihrem Labor mit der richtigen Referenzelektrode. KINTEK ist spezialisiert auf hochwertige Laborgeräte und Verbrauchsmaterialien, einschließlich zuverlässiger Ag/AgCl-Referenzelektroden, die auf Ihre elektrochemischen Anwendungen zugeschnitten sind. Unsere Experten helfen Ihnen bei der Auswahl der perfekten Elektrode, um Stabilität zu gewährleisten und Kontaminationen in Ihren Experimenten zu vermeiden. Kontaktieren Sie uns noch heute, um die Präzision und Sicherheit Ihres Labors zu verbessern!
Visuelle Anleitung
Ähnliche Produkte
- Referenzelektrode Kalomel Silberchlorid Quecksilbersulfat für Laborzwecke
- Metall-Scheibenelektrode Elektrochemische Elektrode
- Goldplattierte Elektrode
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Graphit-Scheiben-Stab- und Plattenelektrode Elektrochemische Graphitelektrode
Andere fragen auch
- Warum werden Dimensionsstabile Anoden (DSA) für die Indium-Elektrogewinnung bevorzugt? Sorgen Sie für hochreine Ergebnisse.
- Warum werden nickelbasierte Materialien für Elektroden in alkalischen Wasserelektrolyseuren bevorzugt? Der wirtschaftliche und technische Vorteil
- Was ist eine permanente Kupfer/Kupfersulfat-Referenzelektrode? Ein Schlüsselwerkzeug für die genaue Korrosionsüberwachung
- Wie ist der korrekte Ablauf zum Polieren einer Metallscheibenelektrode? Eine Schritt-für-Schritt-Anleitung für zuverlässige Ergebnisse
- Was sind Elektrodenmaterialien? Ein Leitfaden zur Auswahl des richtigen Leiters für Ihre Anwendung
- Was sind die Vorteile von Pt- und Ag/AgCl-Elektroden beim Legierungstest? Gewährleistung von Präzision bei der elektrochemischen Analyse
- Warum ist eine hochreine Cobaltplatte als Anode im galvanischen Abscheidungssystem für ternäre Kobalt-Molybdän-Zirkonium (Co-Mo-Zr)-Beschichtungen notwendig?
- Was sind die Aufgaben von Pt-Gegenelektroden und Ag/AgCl-Referenzelektroden? Präzision bei elektrochemischen Tests meistern

















