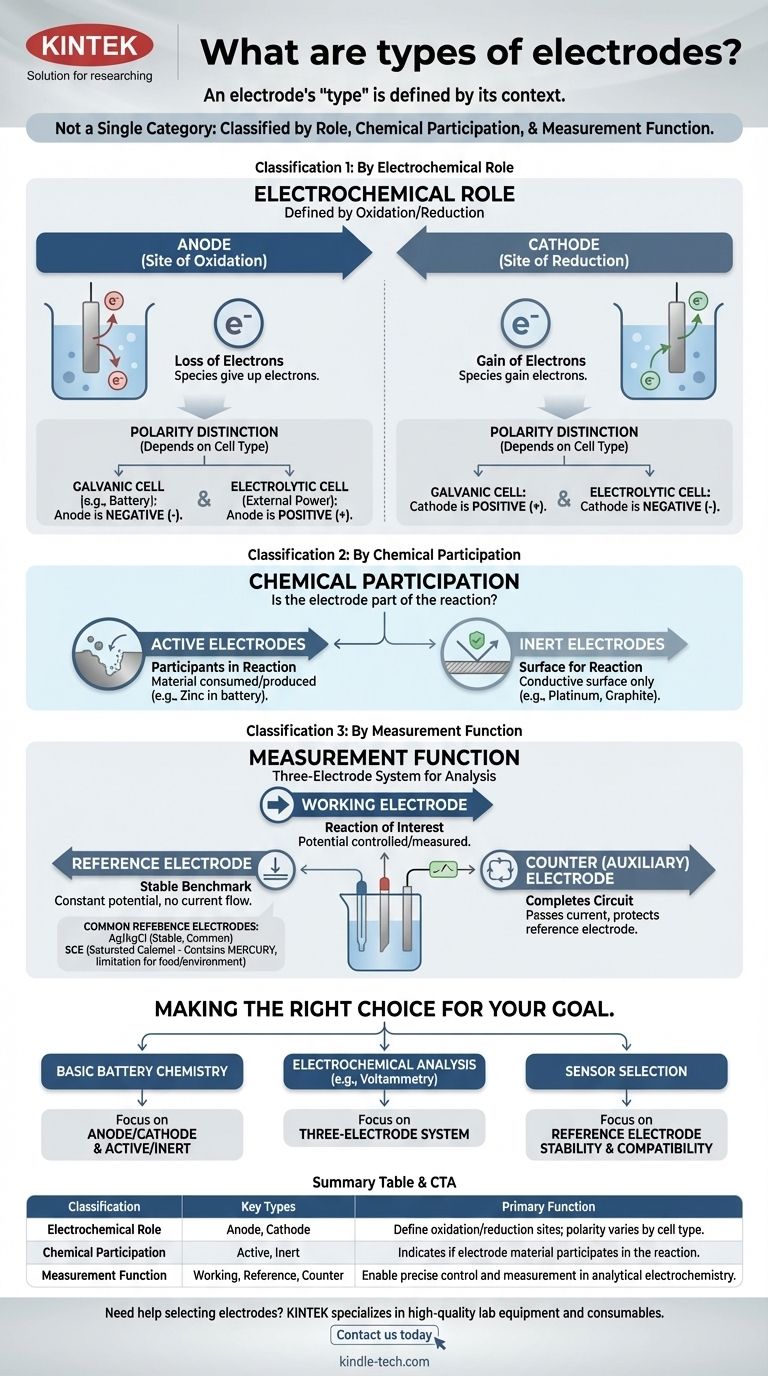
Der Begriff „Elektrode“ ist keine einzelne Kategorie. Vielmehr werden Elektroden auf verschiedene, unterschiedliche Weisen klassifiziert, basierend auf ihrer Rolle in einer Reaktion, ihrer chemischen Beteiligung und ihrer Funktion innerhalb eines Messsystems. Das Verständnis dieser verschiedenen Klassifizierungssysteme ist der Schlüssel zum Erfassen ihres Zwecks in jeder elektrochemischen Zelle.
Die wichtigste Erkenntnis ist, dass der „Typ“ einer Elektrode durch ihren Kontext definiert wird. Dasselbe Stück Metall kann eine Anode oder eine Kathode, aktiv oder inert sein, abhängig von dem elektrochemischen System, in das Sie es einsetzen.
Klassifizierung 1: Nach elektrochemischer Rolle
Die grundlegendste Klassifizierung definiert eine Elektrode anhand ihrer Rolle in den beiden Hälften einer elektrochemischen Reaktion: Oxidation und Reduktion.
Die Anode: Der Ort der Oxidation
Die Anode ist definitionsgemäß die Elektrode, an der die Oxidation stattfindet – der Elektronenverlust. Spezies an der Anode geben ihre Elektronen an die Elektrode ab.
Die Kathode: Der Ort der Reduktion
Die Kathode ist die Elektrode, an der die Reduktion stattfindet – der Elektronenempfang. Die Kathode gibt ihre Elektronen an Spezies in der Lösung ab.
Der entscheidende Unterschied: Anoden-/Kathodenpolarität
Ein häufiger Verwechslungspunkt ist die Ladung (+ oder -) der Anode und Kathode. Diese Polarität hängt von der Art der Zelle ab:
- In einer galvanischen Zelle (wie einer Batterie) erzeugt die spontane Reaktion Energie. Die Anode ist der negative Pol und die Kathode der positive Pol.
- In einer elektrolytischen Zelle treibt eine externe Stromquelle eine nicht-spontane Reaktion an. Die Anode ist der positive Pol und die Kathode der negative Pol.
Klassifizierung 2: Nach chemischer Beteiligung
Diese Klassifizierung beschreibt, ob das Elektrodenmaterial selbst Teil der chemischen Reaktion ist.
Aktive Elektroden: Teilnehmer an der Reaktion
Eine aktive Elektrode besteht aus einem Material, das während der Reaktion der Zelle entweder verbraucht oder erzeugt wird. Zum Beispiel löst sich in einer Zink-Kupfer-Batterie die Zinkanode auf und nimmt aktiv an der Oxidations-Halbreaktion teil.
Inerte Elektroden: Eine Oberfläche für die Reaktion
Eine inerte Elektrode nimmt nicht an der chemischen Reaktion teil. Sie dient lediglich als leitfähige Oberfläche, an der Oxidation oder Reduktion stattfinden kann. Platin und Kohlenstoff (Graphit) sind gängige inerte Elektroden, die verwendet werden, um Reaktionen zu erleichtern, an denen Gase oder gelöste Ionen beteiligt sind.
Klassifizierung 3: Nach Messfunktion
In der analytischen Elektrochemie wird häufig ein Drei-Elektroden-System für präzise Messungen verwendet. Dies führt zu einer funktionalen Klassifizierung.
Die Arbeitselektrode
Dies ist die Elektrode, an der die interessierende Reaktion stattfindet. Ihr Potenzial ist die primäre Variable, die gesteuert oder gemessen wird.
Die Referenzelektrode: Der stabile Maßstab
Eine Referenzelektrode liefert ein stabiles, konstantes Potenzial, gegen das das Potenzial der Arbeitselektrode gemessen wird. Ihr eigenes Potenzial ändert sich nicht, unabhängig davon, ob Strom fließt oder wie die Zusammensetzung der Hauptlösung ist.
Die Gegenelektrode (oder Hilfselektrode)
Der einzige Zweck dieser Elektrode ist es, den Stromkreis zu schließen. Sie leitet den gesamten Strom, den die Arbeitselektrode benötigt, und stellt sicher, dass nur ein vernachlässigbarer Strom durch die empfindliche Referenzelektrode fließt, wodurch deren Stabilität geschützt wird.
Die Kompromisse verstehen: Gängige Referenzelektroden
Die Wahl der Referenzelektrode ist entscheidend für genaue Messungen und hängt von der chemischen Umgebung ab.
Ag/AgCl: Das gängige Arbeitstier
Die Silber/Silberchlorid (Ag/AgCl)-Elektrode ist die gebräuchlichste Referenzelektrode. Sie ist stabil, kostengünstig und im Allgemeinen zuverlässig, was sie zur Standardwahl für viele wässrige Lösungen macht.
Gesättigte Kalomel-Elektrode (SCE): Die klassische Alternative
Die gesättigte Kalomel-Elektrode (SCE) ist ein älterer, hochstabiler Standard. Sie wird häufig in Situationen eingesetzt, in denen die Probenlösung mit Silber- oder Chloridionen inkompatibel ist, die die Ag/AgCl-Elektrode stören könnten.
Das Quecksilberproblem: Eine wesentliche Einschränkung
Der größte Nachteil der SCE ist, dass sie Quecksilber enthält. Dies macht sie für Anwendungen in Lebensmitteln, Getränken oder Umweltprüfungen ungeeignet, bei denen eine Quecksilberkontamination ein erhebliches Problem darstellt.
Die richtige Wahl für Ihr Ziel treffen
Ihre Anwendung bestimmt, welche Klassifizierung am wichtigsten ist.
- Wenn Ihr Hauptaugenmerk auf dem Verständnis der grundlegenden Batteriemerkmale liegt: Beherrschen Sie die Konzepte von Anode/Kathode und aktiven/inerten Elektroden.
- Wenn Ihr Hauptaugenmerk auf der Durchführung elektrochemischer Analysen (wie Voltammetrie) liegt: Das Drei-Elektroden-System (Arbeitselektrode, Referenzelektrode, Gegenelektrode) ist das wesentliche Rahmenwerk.
- Wenn Ihr Hauptaugenmerk auf der Auswahl eines Sensors für eine bestimmte Umgebung liegt: Ihr Hauptanliegen wird die chemische Kompatibilität und Stabilität Ihrer Referenzelektrode sein, z. B. die Wahl zwischen Ag/AgCl und einer Alternative.
Das Verständnis dieser sich überschneidenden Klassifizierungen ermöglicht es Ihnen, das Verhalten jedes elektrochemischen Systems zu steuern und zu interpretieren.

Zusammenfassungstabelle:
| Klassifizierung | Schlüsseltypen | Hauptfunktion |
|---|---|---|
| Elektrochemische Rolle | Anode, Kathode | Definieren Oxidations-/Reduktionsstellen; Polarität variiert je nach Zelltyp (galvanisch/elektrolytisch) |
| Chemische Beteiligung | Aktiv, Inert | Gibt an, ob das Elektrodenmaterial an der Reaktion beteiligt ist oder nur als Oberfläche dient |
| Messfunktion | Arbeitselektrode, Referenzelektrode, Gegenelektrode | Ermöglicht präzise Steuerung und Messung in der analytischen Elektrochemie |
Benötigen Sie Hilfe bei der Auswahl der richtigen Elektroden für die elektrochemischen Anwendungen Ihres Labors? Bei KINTEK sind wir auf die Bereitstellung hochwertiger Laborgeräte und Verbrauchsmaterialien spezialisiert, die auf Ihre Forschungsbedürfnisse zugeschnitten sind. Ob Sie an Batterieentwicklung, Sensordesign oder analytischen Messungen arbeiten, unsere Expertise stellt sicher, dass Sie die optimalen Elektroden für Genauigkeit und Leistung erhalten. Kontaktieren Sie uns noch heute, um Ihre Anforderungen zu besprechen und Ihre elektrochemischen Arbeitsabläufe zu verbessern!
Visuelle Anleitung
Ähnliche Produkte
- Rotierende Platindisk-Elektrode für elektrochemische Anwendungen
- Goldplattierte Elektrode
- Kupfersulfat-Referenzelektrode für Laboranwendungen
- Platin-Hilfselektrode für Laboranwendungen
- Platinblechelektrode für Labor- und Industrieanwendungen
Andere fragen auch
- Wie wird ein Drei-Elektroden-Elektrochemie-Potentiostat zur Untersuchung von Ga0.25Zn4.67S5.08 verwendet? Enthüllung photokatalytischer Mechanismen
- Warum ist die Wartung und Pflege von Elektroden wichtig, und was beinhaltet sie? Gewährleisten Sie Datenintegrität und maximieren Sie den ROI
- Welche chemischen Kompatibilitätsbeschränkungen gelten für aktive Metallelektroden? Schützen Sie Magnesium vor Säureschäden
- Was ist der Unterschied zwischen einer Ring-Scheiben-Elektrode und einer rotierenden Scheibenelektrode? Erschließen Sie tiefere elektrochemische Erkenntnisse
- Was sind die Nachteile von Goldelektroden? Wichtige Einschränkungen für Ihre Laborprojekte
- Welche kritischen Vorsichtsmaßnahmen sind bezüglich Elektrodenpolarität und Elektrolytwahl zu beachten? Sorgen Sie für sichere und effektive elektrochemische Prozesse
- Wie kann die Sauberkeit einer vorbehandelten Glasgraphenelektrode überprüft werden? Gewährleistung genauer elektrochemischer Ergebnisse
- Was ist eine RVC-Glaskohlenstoffplatte? Ein Hochleistungsmaterial für anspruchsvolle Anwendungen



















